酸度计法快速检测牛奶中残留的β-内酰胺酶
2010-03-25刘珊珊张子德马俊莲
刘珊珊,周 正,周 巍,张子德,马俊莲,*
(1.河北农业大学食品科技学院,河北 保定 071001;2.河北省食品质量监督检验研究院,河北 石家庄 050051)
酸度计法快速检测牛奶中残留的β-内酰胺酶
刘珊珊1,周 正2,周 巍2,张子德1,马俊莲1,*
(1.河北农业大学食品科技学院,河北 保定 071001;2.河北省食品质量监督检验研究院,河北 石家庄 050051)
为了快速、准确地检测牛奶制品中残留的β-内酰胺酶的含量,利用β-内酰胺酶分解青霉素产酸使牛奶pH值下降的原理,对人工添加了β-内酰胺酶的牛奶制品与青霉素反应后pH值的下降规律进行研究。得到牛奶中残留的β-内酰胺酶与青霉素反应的较适宜条件,从而获得快速检测牛奶制品中残留的β-内酰胺酶的方法。结果确定牛奶制品中残留的β-内酰胺酶与青霉素反应的适宜条件为温度33℃、底物质量浓度10mg/mL,检测时间仅为60min。此方法对液态纯牛奶中β-内酰胺酶的最低检出限为8.92U/mL。
p H值;β-内酰胺酶;牛奶;青霉素;检测
随着国家对食品安全问题的关注和部分乳制品企业无抗奶目标的提出,抗生素残留问题成为影响乳制品安全的重要因素之一[1]。目前,青霉素作为β-内酰胺类药物是治疗牛乳腺炎的首选药物,是牛奶中最常见的残留抗生素[2]。由于国内多数乳品企业对抗生素残留超标的牛乳采取降价收购的原则,出于经济利益的驱动,一些不法奶站为了谋求自己的经济利益,人为使用一些生物制剂降解牛乳中残留的抗生素,生产人造“无抗奶”。
经初步判断,市售解抗剂的主要成分是β-内酰胺酶,它是由革兰氏阳性细菌产生和分泌的,可选择性分解牛奶中残留的β-内酰胺类抗生素[3]。β-内酰胺酶为我国不允许使用的食品添加剂,该酶的使用掩盖了牛奶中实际含有的抗生素。β-内酰胺酶能够使青霉素内酰胺结构破坏而失去活性,导致青霉素、头孢菌素等抗生素类药物耐药性增高,从而大大降低了人们抵抗传染病的能力,给消费者的身体健康带来危害[4]。因此,确立针对这种人造“无抗奶”的相应检测方法、检测标准,从源头上监测、把控原奶质量具有十分重要的意义。目前,β-内酰胺酶的检测方法有间接高效液相色谱法、碘量法,微生物方法[5]和免疫学方法,这些方法存在处理过程相对复杂、费时,不同牛奶样品实验现象差别较大,检出限高等缺点。本研究拟建立采用酸度计检测牛奶制品中β-内酰胺酶残留量的便捷方法。
1 材料与方法
1.1 材料、试剂与仪器
青霉素对照品(92.7%)、β-内酰胺酶[446万U/(mL· h)] 中国药品生物制品检定所;无抗奶粉(oxid,按1: 7的质量配比还原成液态牛奶) 市购。
Senven-Multi型pH计 美国Mettler Toledo公司;恒温水浴锅 余姚市东方电工仪器厂;MS 3 Basic振荡器 德国IKA公司。
1.2 方法
本实验的原理是在β-内酰胺酶的作用下,青霉素被水解生成青霉噻唑酸。该酸是一种强酸,可电离产生H+,使牛奶的pH值下降。根据稳态处理米氏方程:v=K[E][S]/(Km+[S])[6],式中,v为反应速率、K为反应速率常数、[E]为酶浓度、[S]为底物质量浓度、Km为米氏常数。当酶促反应的底物质量浓度足够大,即[S]趋向于正无穷时,反应速率与酶的浓度成正比,此时米氏方程变为v=K[E][7],这样就可以利用酸度的变化确定酶催化过程中不同时间段的反应速率,得到酸度变化与酶浓度的关系,从而测定酶的残留量。
1.2.1 β-内酰胺酶与青霉素底物在牛奶中反应条件的确定
1.2.1.1 适宜的反应温度的确定
取10mL液态牛奶加入到离心管中,每管加入β-内酰胺酶贮备液使其在奶中的终浓度为100U/mL,振荡混合均匀,置于10~50℃恒温水浴锅中,每个温度设一个空白对照。将等量青霉素同时加入到空白管和试验管中,使其终质量浓度为5mg/mL,振荡混合均匀。使酶与青霉素充分反应,pH值不再发生变化后,计算出ΔpHr=ΔpHβ-ΔpH0,即相对pH变化值等于加入β-内酰胺酶后的pH值变化减去空白管的pH值变化。每个温度做3个重复,取ΔpHr的平均值,通过ΔpHr的大小筛选出适宜的反应温度。
1.2.1.2 适宜的反应底物质量浓度的确定
取10mL液态牛奶加入到离心管中,每管加入β-内酰胺酶贮备液使其在奶中的终浓度为100U/mL,振荡混合均匀,将奶样置于较适宜反应温度的恒温水浴锅中,分别加入不同量的青霉素储备液使其终质量浓度从1mg/mL到15mg/mL,使酶与青霉素充分反应,pH值不再发生变化后,测其ΔpHr。每个底物质量浓度重复3次,取ΔpHr的平均值,筛选出较适宜的反应底物质量浓度。
1.2.1.3 反应时间的确定
取10mL液态牛奶加入到离心管中,每管加入β-内酰胺酶贮备液使其在奶中的终质量浓度为100U/mL,振荡混合均匀,将奶样置于较适宜反应温度的恒温水浴锅中,每管加入适宜质量浓度的青霉素储备液,使酶与青霉素充分反应,pH值不再发生变化后,测其ΔpHr,重复3次,取平均值筛选出较适宜的反应时间。
1.2.2 绘制标准曲线,确定最低检出限
取10mL液态牛奶加入到离心管中,每管加入青霉素贮备液使其在奶中的终质量浓度为10mg/mL,振荡混合均匀,将奶样置于较适宜反应温度的恒温水浴锅中,分别加入不同量的β-内酰胺酶贮备液使其终浓度从5U/ mL到140U/mL,使酶与青霉素充分反应,pH值不再发生变化后,测其ΔpHr。每个酶浓度重复3次取ΔpHr的平均值。得到ΔpHr与β-内酰胺酶浓度的变化关系,绘制出标准曲线图,曲线最低点附近做重复实验,取平均值得到实验最低检出限。
2 结果与分析
2.1 牛奶中β-内酰胺酶催化青霉素水解反应条件的确定
2.1.1 反应温度的确定

图1 温度对酶促反应的影响Fig.1 Effect of temperature on β-lactamase decomposition of penicillin
按照1.2.1.1节的方法,得到ΔpHr随温度的变化曲线见图1。酶在33℃时催化青霉素的活性最高。在10~33℃范围内,随着温度的升高,牛奶中β-内酰胺酶与青霉素反应的速率逐渐增大,即β-内酰胺酶催化青霉素水解的能力逐渐增强。超过33℃后,由于β-内酰胺酶部分失活使其催化能力下降,以及青霉素在较高温度时自身水解产酸的影响,ΔpHr值减小。经过不同温度对β-内酰胺酶活力影响的比较,以33℃为适宜的反应温度。
2.1.2 反应底物青霉素质量浓度的确定
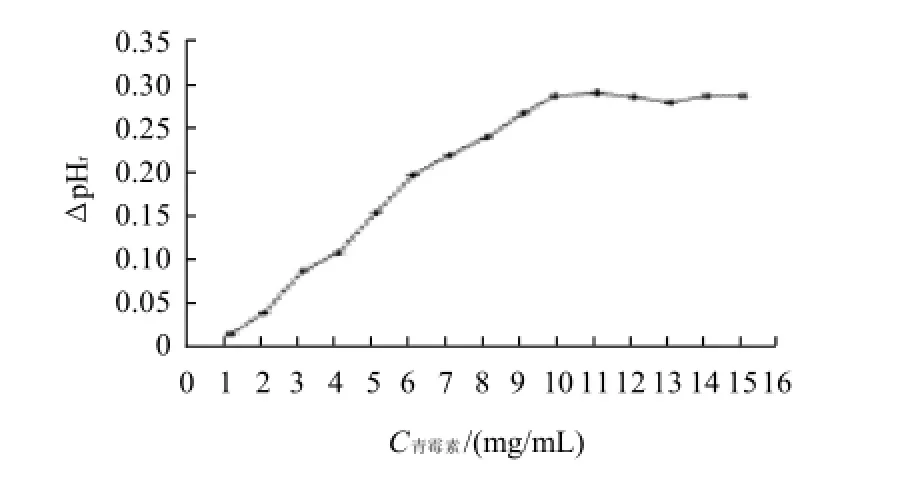
图2 底物青霉素质量浓度对酶促反应的影响Fig.2 Effect of penicillin final concentration on itsβ-lactamase decomposition
图2为β-内酰胺酶终浓度为100U/mL时,33℃条件下,ΔpHr值随底物青霉素质量浓度变化的曲线。由图2可知,ΔpHr值随着青霉素质量浓度的增大而增大,当青霉素质量浓度达到10mg/mL时,ΔpHr的值最大,即反应速率最大。继续增大青霉素质量浓度,ΔpHr值保持基本不变。根据Michaelis-Menten原理,当底物浓度足够大时,酶的催化速率与底物浓度无关。结果表明,当酶浓度在100U/mL以内,温度在33℃、底物青霉素质量浓度为10mg/mL时即为足够大。
2.1.3 反应时间的确定

图3 pH值随时间的变化Fig.3 pH change during β-lactamase decomposition of penicillin observed at 10 mg/mL penicillin final concentration and 33 ℃
图3 为33℃条件下,β-内酰胺酶终浓度为100U/mL,底物青霉素质量浓度为10mg/mL时,牛奶中β-内酰胺酶催化青霉素水解体系pH值变化与时间的关系图。由图3可知,当青霉素加入到含有β-内酰胺酶的牛奶中后,pH值随时间逐渐下降,表明青霉素被牛奶中的酶水解成青霉噻唑酸。当反应60min后,pH值不再下降,保持一个动态平衡,表明反应已经达到平衡。因此,选择实验反应时间为60min。
2.2 标准曲线的绘制和最低检出限的确定

图4 不同β-内酰胺酶浓度作用下ΔpHr的变化值Fig.4 Standard curve forβ-lactamase determination by the method
标准曲线如图4所示,方程式为Y=0.0021X-0.0174,R2=0.9856。式中:Y为ΔpHr;X为β-内酰胺酶浓度;R为相关系数。得到理论最低检出限为8.29U/mL。
理论检出限附近取点相同条件下测定体系的ΔpHr值,每点做3个平行取平均值,结果见表1。
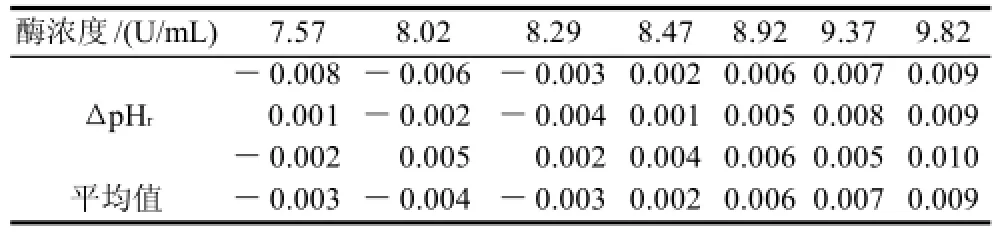
表1 理论检出限附近点酶浓度的ΔpHr值Table 1 Average values (3 replicates) of ΔpHrvalues corresponding to βlactamase concentrations close to the theoretical limit of detection
由于pH计本身校准后pH值有±0.005的误差,所以ΔpHr在±0.005范围内的检测值属于实验误差,则由表1可得此方法的实验实际检出限为8.92U/mL。
3 结 论
由于分解牛奶中抗生素的β-内酰胺酶是个复杂的酶系[8],难以用色谱法直接进行准确地检测分析,目前最多的用于牛奶中β-内酰胺酶的检测有微生物培养法和碘量法。其中微生物培养法检出限较低,但是培养时间较长,无法快速检测。碘量法则检出限相对较高,且易出现假阳性结果。免疫学方法特异性较强,检出结果相对准确,但只能定性确定样品中是否含有β-内酰胺酶而不能确定残留量。
马洁等[9]利用此原理研究牛奶中β-内酰胺酶的检测,用磷酸盐缓冲液代替牛奶进行酶促反应适宜条件的确定实验,得到检出限为15U/mL。本研究利用相同原理,但以市售纯牛奶为基本反应体系,酶促反应的较适宜条件,再利用得到的适宜条件绘制标准曲线,得到牛奶中β-内酰胺酶的理论最低检出限为8.29U/mL,实验实际检出限为8.92U/mL,不仅消除了体系不同产生的误差,更降低了检出限。由于pH计灵敏度较高,易受到声波、温度、水质、振动等外界环境的干扰,为了排除这些干扰因素,在实验过程中应把不加β-内酞胺酶的空白样与加了β-内酞胺酶的样品同时测量,本实验将pH计的两个电极接到同一个pH计的两个检测模块上进行测量,减少了系统误差。平行和重复实验时应尽量使外界环境因素相同,特别是温度,应保证每次pH计的显示温度与实验设定温度相同时再读数,以降低实验误差。
[1]ANONYMOUS. Pasteurized milk ordinance[EB/OL]. (2007-12-06)[2009-09-25]. http://www.cfsan.fda.gov/~ear/pmo03toc.html.
[2]李权超, 王晓光. 长春市生鲜牛乳中抗生素残留调查报告[J]. 肉品卫生, 1991, 29(3): 67-70.
[3]DAHLM K, RICHARDSONT, BRADLEY L, Jr. Use of microbial beta-lactamase to destroy penicillin added to milk[J]. Dairy Sci, 1985, 68(8): 1910-1916.
[4]郑颖. TEM-116型超广谱β-内酰胺酶对牛奶中抗生素的清除[J]. 中国抗生素杂志, 2008, 33(2): 122-124.
[5]崔生辉, 李景云, 马越. “生鲜牛乳抗生素分解剂”的鉴定与检测[J]. 中国食品卫生杂志, 2007, 19(2): 113-116.
[6]MICHAELIS L, MENTEN M. Die kinetik der invertinwirkung[J]. Biochem, 1913, 49: 333-369.
[7]BRIGGS G E, HALDANE J B. A note on the kinetics of enzyme action [J]. Biochem, 1925, 19: 339-339.
[8]吕媛, 李家泰, 单爱莲. β-内酰胺酶抑制剂与β-内酰胺酶类抗生素联合应用的抗菌作用评价[J]. 中国临床药理学杂志, 1998, 14(1): 53-57.
[9]马洁, 李孝君. 利用酸度计检测奶制品中残留的β-内酰胺酶[J]. 化学通报, 2009, 72(4): 370-373.
Use of An Acid Meter for the Rapid Determination of β-Lactamase Residue in Milk
LIU Shan-shan1,ZHOU Zheng2,ZHOU Wei2,ZHANG Zi-de1,MA Jun-lian1,*
(1. College of Food Science and Technology, Agricultural University of Hebei, Baoding 071001, China;2. Hebei Institute of Food Quality Supervision Inspection and Research, Shijiazhuang 050051, China)
The principle that β-lactamase selectively decomposes β-lactam antibiotics like penicillin into acids leading to pH decline was considered to present a rapid and accurate method for the determination of β-lactamase residue in milk. β-Lactamase at a constant final concentration of 100 U/mL and penicillin were artificially added to antibiotic free milk and left to react for a certain period of time at an appropriate temperature. The optimal penicillin final concentration and reaction time and temperature were determined to be 10 mg/mL, 60 min and 33 ℃, respectively. The developed method exhibited a limit of detection of 8.92 U/mL.
pH value;β-lactamase;milk;penicillin;determination
Q5;TS207.3
A
1002-6630(2010)10-0216-03
2009-10-26
河北省科学技术研究与发展计划项目(09227114D)
刘珊珊(1985—),女,硕士研究生,研究方向为农产品贮运原理与技术。E-mail:qhdlss1985@sina.com
*通信作者:马俊莲(1965—),女,教授,博士,研究方向为农产品采后生物技术。E-mail:zhangzde@heinfo.net
