充氮蒸馏-盐酸副玫瑰苯胺比色法测定水产品中亚硫酸盐
2010-03-24岑剑伟李来好杨贤庆郝淑贤辛少平吴燕燕陈胜军
岑剑伟,李来好*,杨贤庆,郝淑贤,辛少平,吴燕燕,陈胜军,黄 卉
(中国水产科学研究院南海水产研究所,广东 广州 510300)
充氮蒸馏-盐酸副玫瑰苯胺比色法测定水产品中亚硫酸盐
岑剑伟,李来好*,杨贤庆,郝淑贤,辛少平,吴燕燕,陈胜军,黄 卉
(中国水产科学研究院南海水产研究所,广东 广州 510300)
对水产品中亚硫酸盐含量的测定进行研究,通过比较不同提取和测定方法,改良盐酸副玫瑰苯胺比色法,建立以充氮蒸馏法提取、甲醛溶液吸收、盐酸副玫瑰苯胺比色测定水产品中亚硫酸盐的方法。该方法SO2含量在0.1~2.0μg/mL范围内与吸光度呈良好的线性关系(R2=0.9993),方法的检出限为0.30mg/kg。测定样品的相对标准偏差小于10%,平均回收率在80%~100%之间。该方法重现性良好、使用无毒试剂、回收率能达到检测要求,适用于水产品中亚硫酸盐的测定。
充氮蒸馏;盐酸副玫瑰苯胺;水产品;甲醛吸收;亚硫酸盐
亚硫酸盐在水产品的贮藏和加工过程中应用十分广泛,常应用于水产食品如烤鱼片、冷冻虾、鱼干、鱿鱼丝加工中,起到漂白、增色、防止冻虾褐变的作用[1]。但是人体长期摄入亚硫酸盐会破坏VB1,影响生长发育,易患多发性神经炎,出现骨髓萎缩等症状,产生慢性毒性[2];长期食用硫磺熏蒸过的食品,会造成肠道功能紊乱[3],损害肝脏,还会引发支气管痉挛、哮喘等疾病[4]。亚硫酸盐还是致病力很强的致癌物质,WHO规定每人每日允许摄入量0~0.7mg。因此世界各国对食品中亚硫酸(以总SO2计)规定了最大限量。国际食品法典委员会(CAC)规定冷冻虾中亚硫酸盐残留量生品可食性部分≤100mg/kg,熟品的可食性部分≤30mg/kg,日本对盐渍蔬菜、淀粉等食品中SO2限量为30mg/kg,韩国规定水产品生熟制品中亚硫酸盐限量均为30mg/kg,美国FDA和欧盟则将10mg/kg设定为界限值,超过此数值时必须在标签上加以标注[5]。食品中亚硫酸盐的检测通常是将它转化为SO2后用碘量法或碱滴定法或比色法测定,由于食品种类不同,不同检测方法也只适用于部分食品种类的测定,尚无完全通用的方法。传统的检测方法有滴定法、比色法和重量法,随着分析科学新方法和新技术的不断发展,新的检测方法如荧光法、化学发光法、电化学法和酶法,以及一些新的分离检测技术如气体扩散膜分离、流动注射、离子色谱、毛细管电泳和各类传感器被应用到亚硫酸盐的检测中[6]。由于使用新方法检测亚硫酸盐的成本普遍较高,且在灵敏度方面提升不大[7-8],目前较多采用传统方法。美国FDA采用Monier-Williams法即蒸馏-碱滴定法,日本采用通氮蒸馏-碘量法、盐酸副玫瑰苯胺比色法;国内则较多采用标准GB/T 5009.34—2003《食品中亚硫酸盐的测定》中规定的方法,即盐酸副玫瑰苯胺比色法和蒸馏-碘量法[9]。传统的滴定法检测灵敏度并不高,比色法如盐酸副玫瑰苯胺法,虽然灵敏度高稳定性也好,但是操作过程使用了剧毒的四氯汞钠溶液,危害实验人员的健康,对环境造成汞污染,有研究使用无汞盐作为吸收剂[10-13],但这些改进的方法不适用于色泽较深的样品。为消除这些不足,本研究比较样品提取方法的优缺点、深入研究影响盐酸副玫瑰苯胺比色的要素,探索使用充氮蒸馏提取-无毒试剂吸收-盐酸副玫瑰苯胺比色的方法测定水产品中的亚硫酸盐。
1 材料与方法
1.1 材料与试剂
新鲜对虾、干虾仁、鱿鱼丝。
浓盐酸(质量分数36%~38%);甲醛(质量分数35%~40%);磷酸(质量分数85%);氨基磺酸铵、氢氧化钠、邻苯二甲酸氢钾、乙二胺四乙酸二钠、盐酸副玫瑰苯胺、亚硫酸钠均为分析纯。
1.2 仪器与设备
GENESYSTM5紫外-可见分光光度计 美国Spectronic公司;充氮蒸馏装置,参考文献[14],并改进;玻璃转子流量计(0.15~1.5L/min) 浙江余姚工业自动化仪表厂;DK-98-Ⅱ型1000W万用电炉 天津市泰斯特仪器有限公司;MJ-400BP01C搅拌机 广东美的精品电器制造有限公司;高纯氮气(纯度≥99.9%)。
1.3 方法
1.3.1 试剂配制
盐酸溶液(1+1):等体积的浓盐酸与等体积的蒸馏水混合;2.00g/L氨基磺酸铵溶液;2.00mol/L氢氧化钠溶液;甲醛缓冲吸收液储备液:2.04g邻苯二甲酸氢钾(KHC8H4O4)、0.37g乙二胺四乙酸二钠(C10H14N2O8Na2· 2H2O),加入5.5mL甲醛,加水溶解定容至1L,在5℃条件下避光贮存,保存期不超过1年;甲醛缓冲吸收液:将甲醛缓冲吸收液储备液用水稀释10倍,现配现用;0.5g/100mL盐酸副玫瑰苯胺储备液:称取0.50g盐酸副玫瑰苯胺(C19H18ClN3,PRA),加水溶解定容到100mL;盐酸副玫瑰苯胺使用液:取10mL 0.5g/100mL盐酸副玫瑰苯胺储备液,加入30mL 磷酸和15mL浓盐酸,加水稀释到100mL(避光密封保存);乙二胺四乙酸二钠溶液:称取0.37g乙二胺四乙酸二钠,用新煮沸冷却水溶解稀释至1L,现配现用;亚硫酸盐标准储备液:称取1.26g亚硫酸钠(Na2SO3),溶于200mL乙二胺四乙酸二钠溶液中,放置2~3h后标定,根据标定的亚硫酸盐含量,立即用甲醛缓冲吸收液稀释为100.00mg/L(以SO2计),在5℃条件下避光保存;亚硫酸盐标准使用液(2.00mg/L):临用时将亚硫酸盐标准储备液,用甲醛缓冲吸收液准确稀释50倍。
以上配试剂用水应符合 GB/T 6682—2008《分析实验室用水规格和试验方法》二级水的标准。
1.3.2 样品处理
湿样用搅拌机捣碎,干样用剪刀剪碎,称取10.00g,移入蒸馏瓶中,立即加入100mL新煮沸冷却的蒸馏水,将蒸馏瓶与通气蒸馏装置连接(图1),以0.4~0.6L/min流速通入氮气2min后,接入吸收瓶(内装约20mL甲醛缓冲吸收液)。由分液漏斗加入约30mL盐酸溶液,煮沸蒸馏20min。停止加热,再通气2min。取下吸收瓶,用少量甲醛吸收液冲洗导管下端,并入吸收瓶中。将吸收瓶内液体转入25mL容量瓶,定容,待测。
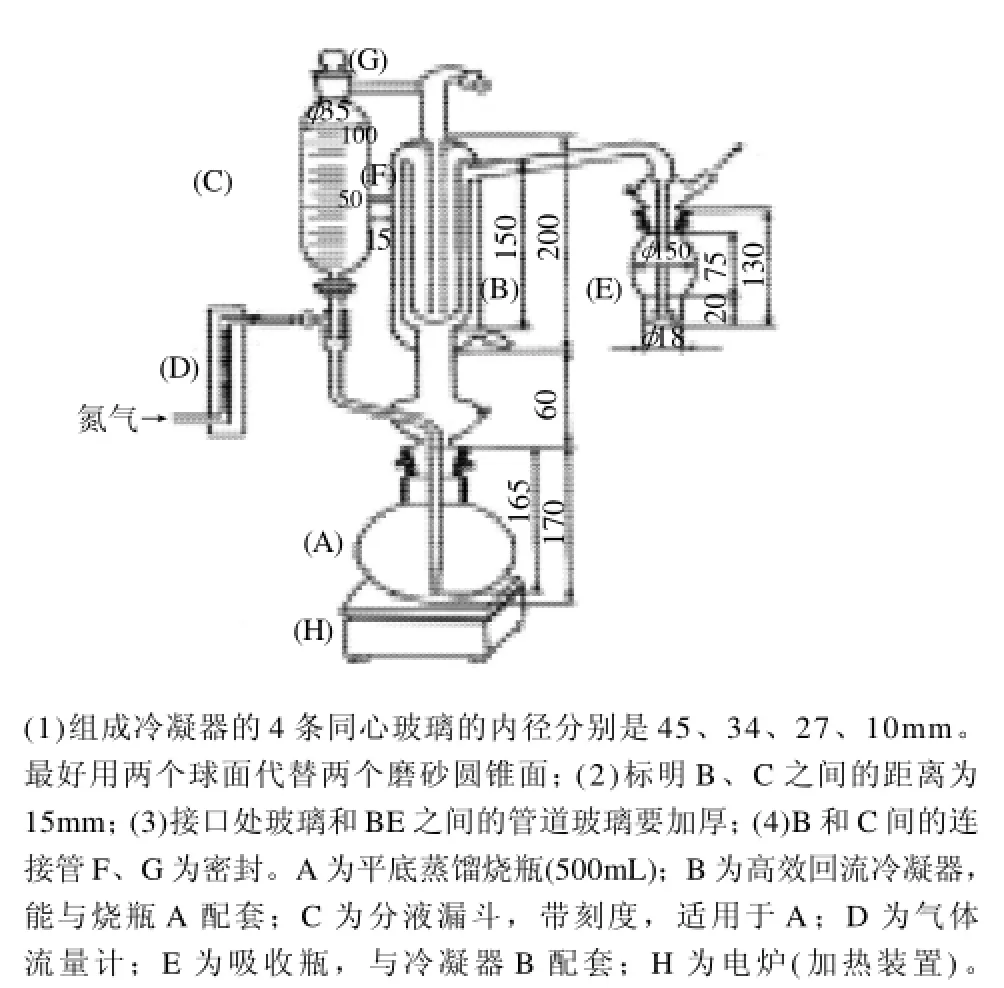
图1 充氮蒸馏装置Fig.1 Nitrogen distillation apparatus
1.3.3 测定
取6个10mL具塞刻度试管,分别准确加入0、0.5、1、2、5、8、10mL亚硫酸盐标准使用液(相当于0、1、2、4、10、16、20μg SO2),用甲醛缓冲吸收液补充总体积至10mL。同时,据试样亚硫酸盐含量高低,吸取上述蒸馏液0.5~10mL(不足10mL时,用甲醛缓冲吸收溶液定容至10mL),于10mL具塞刻度试管中。各管分别加入1mL氨基磺酸铵溶液、1mL氢氧化钠溶液,混匀后再加入1mL盐酸副玫瑰苯胺使用液。立即混匀显色。根据不同室温选择显色时间。显色后于570nm处比色。以含量为横坐标、A570nm为纵坐标制作标准曲线。
样品中亚硫酸盐含量(以SO2计)按计算下式计算:
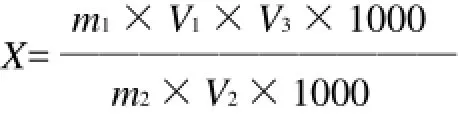
式中:X为样品中亚硫酸盐的含量/(mg/kg);m1为由标准曲线查得的测定用试液中亚硫酸盐的含量/(μg/mL);m2为样品的质量/g;V1为样品液定容体积/mL;V2为测定用样品液体积/mL;V3为反应体系定容体积/mL,本实验为10mL。
2 结果与分析
2.1 提取方法的确定
GB/T 5009.34—2003《食品中亚硫酸盐的测定》中分别使用浸泡法和蒸馏法对样品进行处理。浸泡法处理过程耗时较长(4h以上),使用超声波辅助浸提可以较大程度上缩短处理时间。对两法进行比较(表1),超声波辅助浸提,处理过程简单,但是样品液中存在较多干扰测定的因素,且不适合于用来处理色素含量高的样品;通气蒸馏法获得的提取液则较为干净,适用范围广,但一套装置只可实时处理一个样品,样品处理过程耗时(每个约为0.5h)。从准确性和适用性方面考虑,本方法拟采用通气蒸馏法。
2.2 蒸馏提取参数的确定
2.2.1 酸化剂的选择
加入酸化剂可以促使亚硫酸盐转化为SO2的形式蒸馏出来。通过加入等体积(30mL)的盐酸(1+1)、乙酸(1+1)、磷酸(1+1)3种不同酸化剂的效果可以知道,选取盐酸作为酸化剂能达到最好效果(图2)。使用不同浓度盐酸进行酸化,回收率随着盐酸浓度的增加而增加,当浓盐酸:水的比值大于1后,回收率不再提高(图3)。使用高浓度盐酸存在一定的危险性,因此选取盐酸(1+1)为酸化剂最理想。

图3 浓盐酸与水的体积比对提取效果的影响Fig.3 Effect of HCl-water ratio on extraction efficiency
2.2.2 蒸馏时间的确定
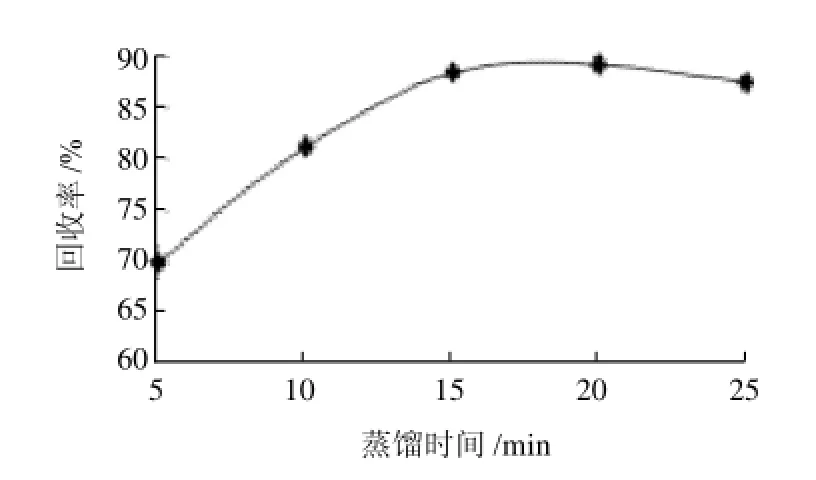
图4 蒸馏时间对提取效果的影响Fig.4 Effect of distillation time on recovery rate

表1 提取方法的比较Table 1 Comparison of extraction methods
在蒸馏烧瓶中加入20μg亚硫酸盐标准溶液(以SO2计)和100mL新煮沸冷却水,以盐酸(1+1)为酸化剂,25mL甲醛吸收液作为吸收剂,煮沸蒸馏不同时间,测定吸收液中SO2含量,做3个平行,比较回收率。当煮提时间大于15min时,回收率趋于稳定(图4)。选择煮提20min为宜。
2.2.3 吸收剂的选择
0.1mol/L NaOH溶液、甲醛吸收液、冷水(5℃)均可作为蒸馏吸收液,研究3种溶液作为吸收剂其用量对回收率的影响。在蒸馏烧瓶中加入相当于500μg亚硫酸盐标准溶液(以SO2计)和100mL煮沸冷却水,以盐酸(1+1)为酸化剂,使用不同体积溶液作为吸收剂,煮沸蒸馏20min,测定吸收液中SO2含量,做3个平行,比较回收率。结果如表2所示,3种吸收剂作为吸收剂均可得到较高回收率,但是由于SO2以亚硫酸根和亚硫酸的形式存在时容易被氧化,溶解在NaOH溶液、冷水中不稳定,放置一段时间含量便会下降。而溶解在甲醛吸收液中则较稳定,SO2与甲醛在弱酸性条件下发生加成反应生成稳定的羟基甲磺酸,同时EDTA消除了可能存在的金属离子的影响,很好地保护了SO2不被氧化。因此选择以甲醛吸收液作为吸收剂。甲醛吸收液用量为25mL时回收率为95%,增加用量回收率没有再提高。吸收剂用量太少时,对SO2的吸收不完全,从而导致回收率偏低。
岩样采用薄壁金刚石钻头沿垂直于岩层方向钻取岩芯,经过锯、磨加工成直径为50 mm,高为100 mm,试样两端面不平行度不大于0.05 mm,满足《规程》要求,60组共计180个试样,制备部分试样,如图2所示,其中顶板岩石用A编号,底板岩石用B编号。试验在RMT-150B型电液伺服岩石力学试验系统进行单轴压缩试验,如图3所示。轴向荷载采用1 000 kN力传感器测量,轴向压缩变形采用5.0 mm位移传感器测量,变形精度为1.0×10-3 mm,采用位移控制方式,加载速率为0.002 mm/s,每组岩性重复进行3次试验。煤层顶底板岩石单轴压缩试验结果见表1。

表2 吸收液用量与回收率之间的关系Table 2 Relationship between absorbent amount and recovery rate %
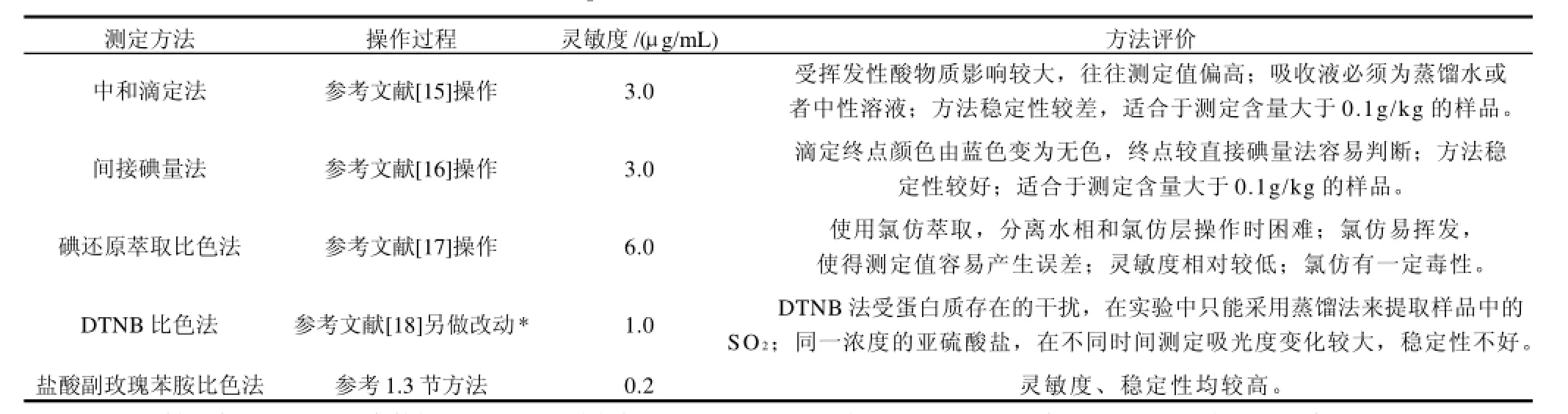
表3 测定方法的比较Table 3 Comparison of determination methods for sulfite content
2.2.4 氮气流速的确定
氮气流速对回收率有一定的影响,氮气流速过快时会导致吸收不完全造成回收率偏低,流速太慢则容易造成倒吸而使提取失败。由于流速是一个比较难以精确控制的因素,本实验以确保不会发生倒吸的流速为控制标准,加大吸收液用量的方式确保高回收率。流速维持在0.4~0.6L/min之间时,可保证提取过程中不会发生倒吸现象。
2.3 测定方法的确定
2.3.1 测定方法的选择
本研究在确定使用蒸馏法提取样品的前提下,选取中和滴定法等5个方法进行比较(表3)。中和滴定法原理是蒸馏出来的样液加过氧化氢氧化成硫酸后使用NaOH溶液滴定至中性,以消耗的NaOH的量来计算SO2,以最低消耗0.1mL 0.01mol/L NaOH计算,灵敏度为3.0μg/mL (以SO2计),此法受挥发性酸物质影响较大,往往出现测定值偏高;间接碘量法测定灵敏度为3.0μg/mL,此法滴定终点颜色变化虽较直接碘量法容易判断,但同样会造成一定程度的系统误差,适合于测定亚硫酸盐含量较高的样品;碘还原萃取比色法用氯仿作为萃取,操作时分离水相和氯仿层较困难,氯仿易挥发,使得测得的值容易产生误差,氯仿有一定毒性,此法灵敏度相对较低;DTNB比色法灵敏度为1.0μg/mL,但稳定性不好;盐酸副玫瑰苯胺比色法测定灵敏度及稳定性均较高,能够满足检测需要,因此本实验采用盐酸副玫瑰苯胺比色法作为检测方法。
2.3.2 盐酸副玫瑰苯胺法比色体系的改良
盐酸副玫瑰苯胺比色法原理是亚硫酸盐在碱性条件下,与甲醛及盐酸副玫瑰苯胺发生反应,生成紫红色络合物,此反应主要受到氮氧化合物的干扰,加入一定量的氨基磺酸铵可消除氮氧化合物对准确定量的影响[19]。本实验研究氢氧化钠、氨基磺酸铵的用量对反应体系的影响以及比色温度与时间的关系。
方法的灵敏度与反应体系pH值相关,如图5所示,随着NaOH用量的增加吸光度先升后降,2mol/L NaOH溶液用量为0.75mL吸光度达到最大,并于0.75~1.5mL区间稳定。同时随着NaOH用量的增加,最大吸收波长蓝移,用量为1mL时λmax=560nm。

图5 NaOH用量对于吸光度及最大吸收波长的影响Fig.5 Effect of NaOH amount on absorbance and maximum absorption wavelength
氨基磺酸铵的作用是消除氮氧化合物(如NO3-)的干扰,使定量趋于准确,与此同时过量的氨基磺酸铵会降低体系的吸光度,不利于提高方法的灵敏度。本研究以空白样品液中加亚硫酸钠标准溶液的形式探索氨基磺酸铵的合适用量,同时以等量的标准品溶液进行对照。研究结果如图6所示,在标准溶液体系中随着2g/L氨基磺酸铵用量的增加吸光度下降,在0.5~1mL区间下降趋势变缓;样品液体系中,吸光度下降趋势呈“陡-平-缓降”的趋势,也在0.5~1mL区间变化较小,在0.75~1.25mL区间,两个体系的吸光度几乎相等。因此确定2g/L氨基磺酸铵的用量选择为1mL为宜。

图6 氨基磺酸铵用量对反应体系的影响Fig.6 Effect of ammonium sulfamate on reaction system
反应体系为10mL样品液+1mL 2g/L氨基磺酸铵+1mL 2mol/L NaOH+1mL盐酸副玫瑰苯胺,显色后在400~700nm处扫描吸收光谱(图7),最大吸收光谱出现在560nm处,在550~580nm区间吸光度变化很小。经过比较,虽然λmax=560nm,但570nm处测量稳定性更好,定量更准确。
另外,关于盐酸副玫瑰苯胺溶液的配制,GB/T 5009.34—2003《食品中亚硫酸盐的测定》方法是在盐酸副玫瑰苯胺水溶液加入盐酸使其变黄色再加水定容即可,在使用时反应体系中加入碱后再往体系中加入盐酸副玫瑰苯胺溶液容易造成盐酸副玫瑰苯胺变回红色,使显色失效,使用稳定性较差。参照NY/T 1373—2007《食用菌中亚硫酸盐的测定充氮蒸馏:分光光度计法》中方法配制[19],发现当加入12mL浓盐酸时,盐酸副玫瑰苯胺由红色转变为黄色,需要放置一段时间才能够稳定;若浓盐酸量增加为15mL则立即转变为稳定的黄色,实验表明按这种方法配制的溶液刚配好就达到稳定,显色效果与放置24h后的效果完全一致,空白对照管不显色[21-22]。

图7 吸收光谱扫描图Fig.7 Absorption spectrum of the reaction product
2.3.2.2 比色温度与时间的关系
在不同温度条件下,体系显色反应时间和显色后稳定时间不同。不同温度下反应体系吸光度的变化情况如图8所示,随着反应的进行,吸光度先增大,然后在一段时间内稳定不变,最后逐渐下降。反应在各温度下进行所需时间及吸光度稳定时间不同,见图8。

图8 温度与显色反应和显色稳定性的关系Fig.8 Relationship between reaction temperature and color reaction and color stability
2.4 方法评价
2.4.1 线性关系和线性范围
标准曲线的制作:取6个10mL具塞试管,分别准确加入0、0.5、1、2、5、8、10mL SO2标准使用液,用甲醛缓冲吸收液补充总体积为10mL,配制成质量浓度为0、0.1、0.2、0.4、1.0、1.6、2.0μg/mL梯度系列。各管分别加入1mL氨基磺酸铵溶液、1mL氢氧化钠溶液,混匀后加入1mL盐酸副玫瑰苯胺使用液,立即混匀。室温显色15min,以0管作为空白调零,在570nm处测定吸光度。以SO2质量浓度为横坐标,吸光度为纵坐标,标准曲线为y=0.3161x-0.0019,R2= 0.9993。在0.1~2.0μg/mL范围内呈良好线性关系。
2.4.2 方法回收率
取湿样(新鲜对虾)用组织捣碎机搅碎,干样(干虾仁、鱿鱼丝)用剪刀剪碎,准确称取10.00g,移入蒸馏瓶中,加入100mL的新煮沸冷却的蒸馏水,再分别加入当量为3、10、20、40μg SO2标准溶液(加标量分别相当于0.3、1.0、2.0、4.0mg/kg,充分混匀,立即蒸馏,每个加标水平做6个平行,测定回收率,同时做空白。结果见表4,平均回收率在80%~100%之间,相对标准偏差小于10%。

表4 方法回收率测定结果Table 4 Recovery rate of standard sulfite in samples
2.4.3 本方法的检测限
根据一般性实验检测限的计算方法[24],当空白测定数n<20,置信水平为95%时,计算公式为
式中:Sb为空白平行测定正标准偏差;f为批内自由度;tf为显著性水平为0.05(单侧)自由度为f时的t值。
根据此式计算得本方法的检测限为0.11mg/kg,由于在加标实验中,当添加量小于0.30mg/kg时回收率下降明显且精密度不好,因此规定本方法的检测限为0.30mg/kg。
3 讨 论
3.1 由于亚硫酸盐暴露在空气中时极其不稳定,实验中将固体样品捣碎后,立即测定与放置30min后再加入100mL水浸没蒸馏测定,结果相差很大。因此,为保证测定的准确性,处理后的样品应立即进行蒸馏提取。对于未能立即测定的样品,可在4℃以下密封短暂保存。与浸泡提取法相比,充氮蒸馏法具有提取时间较短、样品干净背景影响小测定更准确等优点,但是由于加入强酸并加热,在如此剧烈条件下如何保护SO2使之不被氧化成为关键,因此本方法要求配制盐酸和加入蒸馏瓶中水均为新煮沸冷却水以排除试剂中溶解氧的影响,另外要求在装置连接后先通氮气2min后才加入酸再加热蒸馏,以排出系统中存在的氧气。
3.2 盐酸副玫瑰苯胺显色反应是在酸性条件下进行。与经典的盐酸副玫瑰苯胺法不同,本法使用甲醛作为吸收液,SO2在甲醛吸收液中与甲醛反应以羟甲基磺酸的形式存在,因此在反应中需要加入一定量的NaOH碱化。以往的研究中对碱的用量做了探索[10-11,13,20,23],但未对碱在反应中的作用进行深入的阐述。本实验对此进行了研究,发现若不加入碱则显色反应难以进行,将甲醛、亚硫酸根依次单独加入到盐酸副玫瑰苯胺反应体系当中则显色能顺利进行,说明碱的作用是将羟甲基磺酸分解为甲醛和亚硫酸根。另外,实验中将亚硫酸盐、甲醛分别单独与盐酸副玫瑰苯胺溶液混合,不发生颜色变化。这些现象表明显色反应只有在3种物质同时存在时才能发生的,而并非是先生成羟甲基磺酸后再与盐酸副玫瑰苯胺反应,这一结果与经典的盐酸副玫瑰苯胺法反应机理的表述不同。
4 结 论
本实验以充氮蒸馏提取、甲醛溶液吸收、盐酸副玫瑰苯胺比色测定水产品中亚硫酸盐的含量,湿样回收率在80%~100%之间,相对标准偏差小于10%,检出限为0.30mg/kg。方法稳定性好、使用无毒试剂、回收率能达到检测的要求,解决了水产品中亚硫酸盐的测定。
[1]党卫红, 徐启红. 亚硫酸盐在食品加工中的应用[J]. 食品工程, 2008 (3): 22-25.
[2]葛毅强, 张维一. 鲜食葡萄采后SO2熏蒸及检测方法的评述[J]. 食品科学, 1997, 18(4): 59-62.
[3]REIST M, JENNER P, HALLIWELL B. Sulphite enhances peroxynitrite-dependent alpha(1)-antiproteinase inactivation, A mechanism of lung injury by sulphur dioxide[J]. FEBS, 1998, 423(2): 231-234.
[4]王丽丽, 纪淑娟, 李顺, 等. 食品中二氧化硫及亚硫酸盐的作用与检测方法[J]. 食品与药品, 2007, 9(2): 64-66.
[5]高平, 黄国方, 胡琼予, 等. 浅议虾类产品标准中亚硫酸盐限量问题[J]. 内陆水产, 2009(11): 31-32.
[6]张双灵, 赵奎浩, 周德庆, 等. 水产品中亚硫酸盐的安全性及残留状况检测[J]. 现代食品科技, 2007, 23(3): 60-63.
[7]黎永杰, 赵美萍, 常文保. 食品中亚硫酸盐的检测方法研究进展[J].食品与发酵工业, 2004, 30(5): 99-105.
[8]YANG Xiaofeng, GUO Xiangqun, ZHAO Yibing. Novel spectrofluorimetric method for the determination of sulfite with rhodamine B hydrazide in a micellar medium[J]. Analytica Chimica Acta, 2002, 456: 121-128.
[9]GB/T 5009.34—2003 食品中亚硫酸盐的测定[S]. 北京: 中国标准出版社, 2004.
[10]余娟, 卢家炯, 莫海涛, 等. 甲醛溶液吸收-盐酸副玫瑰苯胺分光光度法测定白砂糖中的二氧化硫[J]. 甘蔗糖业, 2007(1): 41-46.
[11]郭振忠, 胡云峰, 李文生, 等. 乙二胺四乙酸二钠-盐酸副玫瑰苯胺检测干果中二氧化硫的方法研究[J]. 食品科学, 2009, 30(8): 247-250.
[12]陶文茹, 杨冰清. 三乙醇胺吸收盐酸副玫瑰苯胺光度法测定食品中二氧化硫[J]. 中国卫生检疫杂志, 1994, 4(2): 82-83.
[13]杨文英, 王芳. 甲醛吸收-盐酸副玫瑰苯胺法测定食品中的亚硫酸盐[J]. 中国卫生检疫杂志, 2006, 16(4): 400-402.
[14]NY/T 1435—2007 水果、蔬菜及其制品中二氧化硫总量的测定[S].北京: 中国农业出版社, 2007.
[15]HILLERY B R, ELKINS E R, WARNER C R, et al. Optimized Monier-Williams method for determination of sulfites in foods: collaborative study[J]. AOAC, 1989, 72(3): 470-475.
[16]刘明. 食品中二氧化硫残留量检测方法的改进[J]. 生命科学仪器, 2008(6): 42-43.
[17]张双灵, 赵奎浩, 王世清, 等. 水产品中亚硫酸盐检测方法的研究[J].西北农业学报, 2007, 16(5): 231-234.
[18]LI Yongjie, ZHAO Meiping. Simple methods for rapid determination of sulfite in food products[J]. Food Control, 2006, 17: 975-980.
[19]NY/T 1373—2007 食用菌中亚硫酸盐的测定: 充氮蒸馏: 分光光度计法[S]. 北京: 中国农业出版社, 2007.
[20]张文德, 郭忠, 孙仕萍. 食品中亚硫酸盐测定方法的改进[J]. 中国食品卫生杂志, 2004, 16(6): 504-508.
[21]苏少英. 测定食品中亚硫酸盐的盐酸副玫瑰苯胺配制方法的改进[J].冷饮与速冻食品工业, 2000(2): 20.
[22]郑惠萍. 二氧化硫测定中盐酸副玫瑰苯胺溶液中盐酸用量的确定[J].职业与健康, 1999, 15(7): 20.
[23]魏卓立, 曹威, 张驰. 甲醛缓冲溶液吸收: 盐酸副玫瑰苯胺分光光度法测定二氧化硫有关问题探讨[J]. 环境保护科学, 2003, 29(4): 32-33.
[24]王叔淳. 食品卫生检验技术手册[M]. 3版. 北京: 化学工业出版社, 2002: 94.
Determination of Sulfite in Aquatic Products by Nitrogen Distillation-Pararosaniline Hydrochloride Spectrophotometric Method
CEN Jian-wei,LI Lai-hao*,YANG Xian-qing,HAO Shu-xian,XIN Shao-ping,
WU Yan-yan,CHEN Sheng-jun,HUANG Hui
(South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China)
In this study, the determination of sulfite content in aquatic products was investigated. A nitrogen distillationformaldehyde solution absorption-pararosaniline hydrochloride spectrophotometric method was established through comparing different extraction and determination methods to determine sulfite content in aquatic products. The established method exhibited an excellent linear relationship with correlation coefficient of 0.9993 for sulfur dioxide at the concentration range of 0.1-2.0μg/mL. The recovery rate of this established method was 80%-100% with relative standard deviation of less than 10%. The detection limit of this method was 0.30 mg/kg. Therefore, this developed method is characteristics of good repeatability, less pollution and high recovery rate, which is suitable for the determination of sulfite in aquatic products.
nitrogen distillation;pararosaniline hydrochloride;aquatic products;formaldehyde solution absorption;sulfite
TS207.3
A
1002-6630(2010)24-0395-07
2010-09-01
农业部2008年“水产品中亚硫酸盐的检测”行业标准计划项目(10178);“十一五”国家科技支撑计划项目(2008BAD94B02);广东省海洋渔业科技推广专项(A2009001-011(b);A200901B02;A200901I03);农业部中央级公益性科研院所基本科研项目(2010YD08;2010TS09)
岑剑伟(1976—),男,助理研究员,硕士,主要从事水产品质量安全研究。E-mail:genvex@163.com
*通信作者:李来好(1963—),男,研究员,博士,主要从事水产品质量安全研究。E-mail:laihaoli@163.com
