液相色谱串联质谱法检测食品中的黄曲霉毒素
2010-03-24王远兴李瑾瑾
郑 燕,王远兴*,李瑾瑾
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
液相色谱串联质谱法检测食品中的黄曲霉毒素
郑 燕,王远兴*,李瑾瑾
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
为提高黄曲霉毒素的检测灵敏度,建立快速液相色谱串联质谱(LC-MS/MS)法对食品中的4种黄曲霉毒素B1、B2、G1、G2进行定性定量分析。样品粉碎后用体积比为84:16的乙腈-水混合液提取,过滤后通过真菌毒素净化柱进样,采用C18柱分离,0.1%甲酸溶液和甲醇做流动相,以60:40比例等度洗脱,质谱在多反应监测(MRM)的正离子模式下进行分析。4种组分在5min内完全分离,而且此方法线性关系良好,黄曲霉毒素B1、B2、G1、G2的检出限分别是0.012、0.009、0.013、0.007μg/kg,平均加标回收率在80%~95%之间,相对标准偏差小于5%。该方法快速灵敏、准确可靠,其检出限可满足欧盟地区严格的黄曲霉毒素限量标准。
液相色谱串联质谱;黄曲霉毒素;食品
黄曲霉毒素(aflatoxins,AFT)是由黄曲霉和寄生曲霉等真菌代谢产生的一类有毒的真菌毒素[1-2],广泛存在于各种食品、农产品和饲料中,严重污染着花生、玉米、大米、小麦等粮油产品,甚至坚果、乳制品、酒类和调味品等一些常见食品中也能经常发现有黄曲霉毒素[3-4]。
黄曲霉毒素及其衍生物有20多种,在自然界分布最广的是B1、B2、G1、G2这4种,它们的基本结构是由一个双呋喃环和一个氧杂萘邻酮(香豆素)组成,前者为基本的毒素结构,后者与致癌性有关,并加强了前者的毒性[5-7]。
黄曲霉毒素是一种毒性极强的剧毒物质,在所有的真菌毒素中,其毒性、致癌性、致突变性、致畸性均居首位,是目前已知致癌物中致癌力最强的一种[8-9]。黄曲霉毒素不仅毒性大、分布广,而且结构也比较稳定,一般在食物的热加工过程中都不易被破坏[10-11],因此给消费者的饮食安全埋下了巨大隐患。
鉴于黄曲霉毒素对人体健康危害巨大,世界各国政府及相关组织纷纷制定了食品中黄曲霉毒素的限量标准和相应的检测方法。目前检测黄曲霉毒素的常规方法主要有薄层色谱法、高效液相法、酶联免疫吸附法[12-13]。但薄层色谱法操作步骤繁琐、灵敏度低,而且有机试剂用量大、污染严重;高效液相色谱法通常使用荧光检测器,需要将样品在柱前或柱后进行衍生,分析时间较长;酶联免疫吸附法虽然前处理过程简单,但有时易出现假阳性,造成定性结果有一定偏差[14-16]。
近年来,液质联用技术在食品安全领域得到广泛应用,它将色谱的高效分离能力和质谱的高灵敏度这两种优势结合在一起,可以对很多种类的化合物进行定性定量分析。林建忠[17]和杨静[18]等分别采用了LC-MS/MS测定食品中的AFB1,张浩等[19]用LC-MS测定了花生中的4种AFT,但却鲜见用二级质谱对黄曲霉毒素B1、B2、G1、G2同时检测的报道。所以液质联用法在分析黄曲霉毒素方面还有较大的提升空间。本研究拟采用先进的快速液相色谱串联三重四极杆质谱系统,使4种目标化合物高效分离后,能够准确的定性定量,建立一种能够同时分析黄曲霉毒素B1、B2、G1、G2的新方法。
1 材料与方法
1.1 材料与试剂
花生、玉米、芝麻、花生核桃乳饮品、燕麦片市购。黄曲霉毒素B1、B2、G1、G2混合标准溶液(B1、G1质量浓度均为1μg/mL,B2、G2质量浓度均为0.3μg/mL) 美国Sigma公司;乙腈(色谱纯)、甲醇(色谱纯);甲酸(分析纯);超纯水 实验室制备。
1.2 仪器与设备
6430三重四极杆液质谱联用系统[配有1200高效液相色谱系统、电喷雾离子源(ESI)及MassHunter数据处理软件] 美国Agilent公司;Mycosep 226真菌毒素净化柱 美国Romer公司;FA1104电子天平 上海精天电子仪器厂;KQ2200E超声波清洗器 昆山市超声仪器有限公司;Milli-Q超纯水仪 Millipore公司。
1.3 仪器参数
1.3.1 色谱条件
色谱柱:Agilent ZORBAX Eclipse XDB-C18柱(4.6mm× 50mm,1.8μm);流动相:0.1%甲酸溶液-甲醇(60:40);流速:0.4mL/min;柱温:35℃;进样量:5μL。
1.3.2 质谱条件

表1 各种黄曲霉毒素的MRM扫描参数Table 1 Parameters for four kinds of aflatoxins in MRM
离子源:电喷雾离子源(ESI);干燥气流速:12mL/ min;干燥气温度:350℃;雾化气压力:50psi;毛细管电压:4000V;质量扫描范围(m/z):100~500;扫描模式:正离子模式;4种黄曲霉毒素的MRM扫描参数见表1。
1.4 样品处理
称取25g粉碎好的样品置于250mL锥形瓶中,加入100mL乙腈-水溶液(84:16,V/V),高速搅拌3min,用定性滤纸过滤,将滤液通过Mycosep 226真菌毒素净化柱,收集净化液。取1.5mL净化液,过0.22μm滤膜,放入进样瓶中,待进样。
1.5 标准曲线及检测限
将标准品溶液稀释成几个不同浓度,按浓度由低到高的顺序进样,在选定的色谱条件和质谱条件下测定,以进样浓度为横坐标,以峰面积为纵坐标,进行线性回归计算,得到4种黄曲霉毒素的线性方程和相关系数。计算3倍信噪比和10倍信噪比时所对应的样品浓度,分别作为方法的检出限和定量限。
1.6 精密度和回收率实验
将每种样品连续重复进样5次,测得各组分的峰面积,计算其相对标准偏差(RSD),来衡量方法的精密度。为考察该方法的准确性,将每种样品取3份,分别添加不同体积的标准溶液,按照1.4节进行样品前处理,在1.3.1节的色谱条件和1.3.2节的质谱条件下测定,计算样品加标回收率。
2 结果与分析
2.1 流动相的选择
由于黄曲霉毒素易溶于甲醇和乙腈,因此先后选用了甲醇、乙腈与水混合做流动相。对于液质联用系统来说,流动相的选择不仅要考虑对组分的洗脱能力,而且还需考虑在质谱中是否能促使样品达到较高的离子化效率[18]。从实验结果来看,虽然乙腈在液相中的洗脱效果稍强于甲醇,但是用乙腈做流动相时的离子丰度明显降低,说明乙腈的离子化效率低,所以采用了甲醇作为流动相。为了促进样品的离子化,本实验先后在流动相中分别加入了0.1%甲酸、0.1%乙酸和10mmol/L乙酸铵,结果表明加入甲酸时的离子丰度最强,因此最终确定在纯水中添加0.1%甲酸以增强离子化效果。
此外还考察了甲醇与水的比例对分析结果的影响。当甲醇与水的比例大于40:60时,4种黄曲霉毒素不能完全分离,这样会导致不同离子的离子化相互抑制,降低了灵敏度,影响结果的准确性;而水的比例较大时,出峰时间就会延长。结果表明,当甲醇与水相的比例为40:60时,4种黄曲霉素G2、G1、B2、B1在5min内先后出峰,并得到了最佳的分离效果,其MRM模式的总离子流图见图1(图中1、2、3、4分别表示黄曲霉毒素G2、G1、B2、B1)。

图1 标准品的MRM总离子流图Fig.1 Total ion chromatograph of AFT in the standard solution by MRM
2.2 质谱条件的选择
黄曲霉毒素是中等极性的物质,所以适合用电喷雾离子源进行离子化。实验中尝试了分别采用正、负两种离子模式,发现正离子模式下的离子化效率明显高于负离子模式。在全扫描模式下,确定了M+H作为4种黄曲霉毒素的母离子。子离子扫描时,选择丰度高而且稳定的离子做定量离子,最终确定了质荷比(m/z)为241、259、243、245的这4个离子分别做B1、B2、G1、G2的定量离子,然后在选择性离子扫描(SIM)和MRM模式下分别优化裂解电压和碰撞能,结果见表1。
2.3 标准曲线及检出限
取不同浓度的标准溶液,按照1.3节中的色谱条件和质谱条件进样,以峰面积(y)对含量(x)做标准曲线,得到线性方程和相关系数,并根据3倍和10倍信噪比计算检出限和定量限,结果见表2。
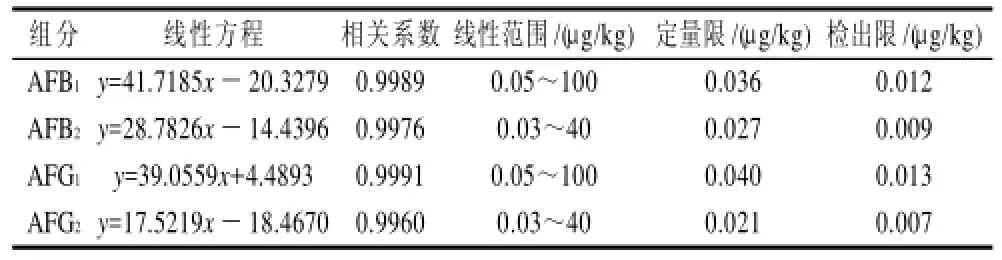
表2 线性方程、线性范围及检出限Table 2 Linear regression equations, linear ranges and detection limits of aflatoxins
2.4 精密度和回收率
按照1.6节方法进行精密度和回收率实验,计算相对标准偏差和加标回收率。精密度实验结果见表3,RSD值均小于5%;表4是花生样品的回收率实验结果,其他几种样品的回收率也都在80%~95%,各项数据表明该方法的精密度和回收率都比较良好。
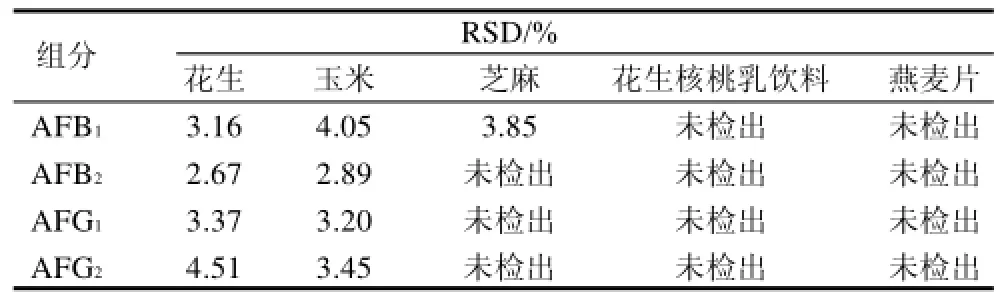
表3 精密度实验结果Table 3 Precision test of this analytical method for detecting AFT B1, B2, G1and G2
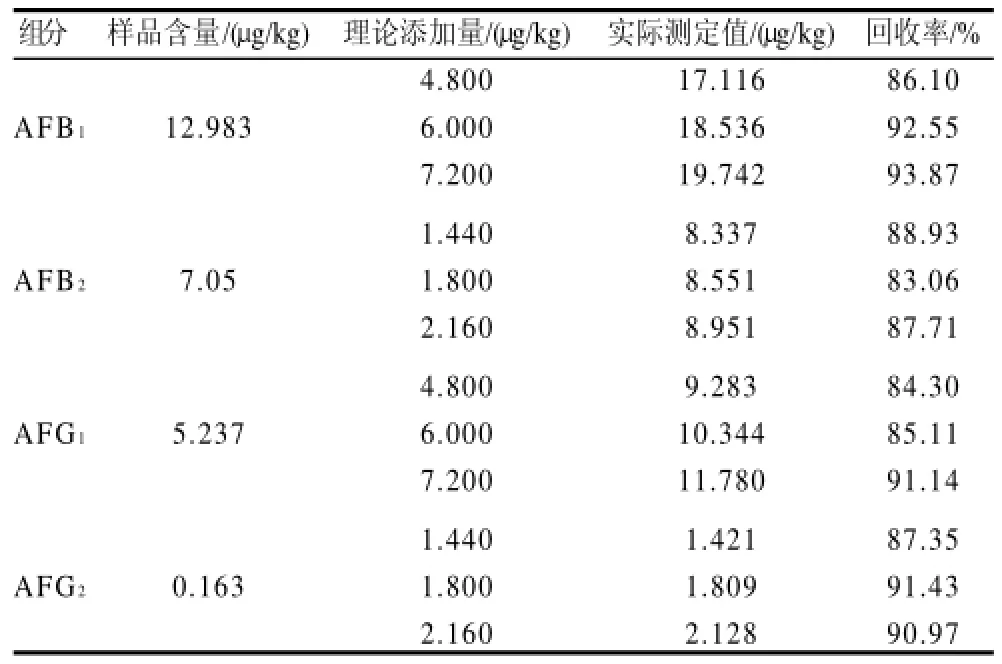
表4 花生样品的加标回收率Table 4 Recovery rates of AFT B1, B2, G1 and G2 in peanut samples
2.5 实际样品的检测
从市场采购了花生、玉米、芝麻、花生核桃乳饮料、燕麦片这5种食品,每种采购3批,然后按照1.4节方法进行样品前处理,在1.3节仪器条件下测定样品中黄曲霉毒素的含量。分析结果显示,花生和玉米中的黄曲霉毒素含量最高,其中一批玉米样品的黄曲霉毒素总量(黄曲霉毒素B1、B2、G1、G2含量之和)高达30μg/kg,而且AFB1占有很高的比例;芝麻中有两批样品含1μg/kg的AFB1;而花生核桃乳饮料和燕麦片中未检出黄曲霉毒素。同时采用国标中的高效液相色谱法进行对比,发现用液质方法检测出含有黄曲霉毒素的样品在高效液相色谱这种传统方法中却未能检出,说明新方法的灵敏度明显优于高效液相色谱法。
3 结 论
本实验建立了快速液相色谱串联质谱(LC-MS/MS)法检测多种食品中的4种黄曲霉毒素,用甲醇与水等度洗脱,在质谱的正离子模式下监测,5min内4个组分完全分离,黄曲霉毒素B1、B2、G1、G2的检出限可分别达到0.012、0.009、0.013、0.007μg/kg,不仅能满足我国国标GB 2761—2005《食品中真菌毒素限量》中黄曲霉毒素的限量要求(规定花生、玉米及其制品中的AFB1不得超过20μg/kg),而且还能达到欧盟的严格限量标准(规定直接供人食用的花生、坚果及其制品中AFB1含量不超过2μg/kg,AFT总量不超过4μg/kg)。该方法灵敏度高、准确性好,而且简单快速、能在短时间内检测大量样品,具有较高的实用价值。
[1]鲍蕾, 刘心同, 张艺兵, 等. 多功能净化柱高效液相色谱法检测花生中的黄曲霉毒素[J]. 检验检疫科学, 2005, 15(5): 23-25.
[2]魏丽莉. 黄曲霉毒素对食品的污染及防治措施[J]. 粮油加工, 2008 (9): 86-89.
[3]吴丹. 黄曲霉毒素在粮食和食品中的危害及防治[J]. 粮食加工, 2007, 32(3): 91-94.
[4]CHIARA C, PATRIZIA F, CHIARA G, et al. Determination of aflatoxins in olive oil by liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2007, 596(1): 141-148.
[5]CHO S H, LEE C H, JANG M R, et al. Aflatoixns contamination in spices and processed spice products commercialized in Korea[J]. Food Chemistry, 2008, 107(3): 1283-1288.
[6]朱新贵, 林捷. 几种食品微生物降解黄曲霉毒素作用的研究[J]. 食品科学, 2001, 22(10): 65-68.
[7]段淑芬, 胡文广, 戴良香. 花生黄曲霉毒素国家标准与绿色贸易壁垒[J]. 中国农学通报, 2006, 22(6): 95-98.
[8]GORYACHEVA I Y, SAEGER S D, DELMULLE B, et al. Simultaneous non-instrumental detection of aflatoxin B1 and ochratoxin A using a clean-up tandem immunoassay column[J]. Analytica Chimica Acta, 2007, 590(1): 118-124.
[9]AYDIN A, ERKAN E M, BASKAYA R, et al. Determination of aflatoxin B1 levels in powdered red pepper[J]. Food Control, 2007, 18(9): 1015-1019.
[10]郑荣, 毛丹, 王柯, 等. 基质固相分散色谱法检测辣椒产品中的黄曲霉毒素[J]. 色谱, 2005, 25(6): 610-613.
[11]MICHEAL J, RIORDAN O, MARTIN G, et al. Comparison of analytical methods for aflatoxin determination in commercial chilli spice preparations and subsequent development of an improved method[J]. Food Control, 2009, 20(8): 700-705.
[12]BRADBURN N, CROKER P, BLUNDEN G. A comparative study of solvent extraction efficiency and the performance of immunoaffinity and solid phase columns on the determination of aflatoxin B1[J]. Food Chemistry, 1995, 529(16): 179-185.
[13]马良. 黄曲霉毒素B1高灵敏度检测技术研究[D]. 北京: 中国农业科学院油料作物研究所, 2007.
[14]陈建民, 张雪辉, 杨美华, 等. 黄曲霉毒素检测方法研究进展[J]. 中国中药杂志, 2005, 30(24): 1890-1894.
[15]NONAKA Y, SAITO K, HANIOKA N, et al. Determination of aflatoxin in food samples by automated on-line in-tube solid-phase microextration coupled with liquid chromatography-mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(20): 4416-4422.
[16]ROMAGNOLI B, MENNA V, GRUPPIONI N, et al. Aflatoxins in spices, aromatic herbs, herb-teas and medicinal plants marketed in Italy [J]. Food Control, 2007, 18(6): 697-701.
[17]林建忠, 邹伟, 张志刚, 等. LC/MS/MS测定食品中黄曲霉毒素B1的研究[J]. 检验检疫科学, 2004, 14(增刊1): 31-33.
[18]杨静, 哈益明, 王锋. 高效液相色谱串联质谱法检测花生中的黄曲霉毒素B1[J]. 分析实验室, 2009, 28(6): 35-38.
[19]张浩, 杨毅, 潘见. LC-MS法测定花生中黄曲霉毒素的研究[J]. 安徽化工, 2007, 33(4): 68-70.
Determination of Aflatoxins in Food by Liquid Chromatography-Tandem Mass Spectrometry
ZHENG Yan,WANG Yuan-xing*,LI Jin-jin
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
In order to improve detection sensitivity of aflatoxions, a liquid chromatography-tandem mass spectrometry method was established for the simultaneously qualitative and quantitative analysis of aflatoxins B1, B2, G1and G2. Samples were sequentially extracted by acetonitrile-water at a ratio of 84:16 (V/V), cleaned up with multifunctional cleaning column. After injection, the chromatographic separation was achieved on a C18 column using a mobile phase composed of a mixture of 0.1% formic acid and methanol through gradient elution. The analysis was realized by multiple reaction-monitoring modes. Under above conditions, aflatoxins B1, B2, G1and G2could be completely separated in 5 min with an excellent linear relationship. The determination limits for 4 kinds of aflatoxins were 0.012, 0.009, 0.013μg/kg and 0.007μg/kg, respectively. The recovery rate of spiked samples was in the range of 80%-95% with a relative standard deviation less than 5%. This method can provide a rapid, sensitive, accurate and reproducible detection for aflatoxins and its detection limit is sensitive enough to meet the European regulation for aflatoxins.
liquid chromatography-tandem mass spectrometry;aflatoxins;food
TS207.3
A
1002-6630(2010)24-0385-04
2010-06-30
食品科学与技术国家重点实验室自由探索资助课题(SKLF-TS-200915);国家自然科学基金项目(21045006)
郑燕(1984—),女,硕士研究生,研究方向为食品营养学。E-mail:fairy0003@163.com
*通信作者:王远兴(1964—),男,教授,博士,研究方向为食品质量与安全、食品化学。E-mail:yuanxingwang@ncu.edu.cn
