动态超高压微射流技术提取甘薯叶黄酮
2010-03-24涂宗财毛沅文罗晓慧
李 志,涂宗财*,毛沅文,姜 颖,罗晓慧,张 露
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
动态超高压微射流技术提取甘薯叶黄酮
李 志,涂宗财*,毛沅文,姜 颖,罗晓慧,张 露
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
研究动态超高压微射流处理热醇提取甘薯叶黄酮的最佳工艺。以黄酮得率为考察对象,在单因素试验基础上,通过正交试验研究动态超高压微射流处理压力、乙醇体积分数、提取温度、提取时间对甘薯叶黄酮得率的影响。结果表明:提取温度和动态超高压微射流处理压力对甘薯叶黄酮的得率影响显著;最佳工提取艺条件为动态超高压微射流处理压力100MPa、乙醇体积分数70%、提取温度75℃、提取时间120min,在此工艺条件下黄酮得率为5.75%。
甘薯叶;黄酮;动态超高压微射流
甘薯(Ipomoea batatas Lam.)又名红薯、白薯、番薯、地瓜等,为旋花科甘薯属一年生草本植物[1]。研究表明,甘薯叶中黄酮含量高于普通蔬菜,具有抗氧化、降血脂、调节免疫、抗肿瘤等功效[2-5]。我国是世界上甘薯栽培面积最大的国家,甘薯茎叶资源丰富,但未得到充分利用,除少部分用作饲料外,大部分被丢弃,造成了资源的极大浪费[6]。动态超高压微射流(简称微射流)是一种新兴的超微细化技术,它能对物料产生强烈剪切、高速撞击、高频振荡、压力瞬间释放等一系列的综合作用,从而导致细胞破碎,而对活性成分几乎无破坏,并且能起到很好的超细化和均一化效果[7]。目前,已有动态超高压微射流技术应用于灭菌[8]、多糖提取[9]、蛋白质改性[10-11]以及淀粉的改性[12-13]的报道。对于应用动态超高压微射流提取黄酮的研究尚未见报道。本实验以秋季甘薯收获后的甘薯叶为原料,研究动态超高压提取处理提取甘薯叶中的黄酮得率的影响,为微射流技术在天然产物提取领域的应用提供参考。
1 材料与方法
1.1 材料与试剂
甘薯叶采自南昌市郊区,50℃干燥,粉碎过200目筛备用;芦丁标准品(纯度≥95%) 中药固体制剂制造技术国家工程研究中心;乙醇、亚硝酸钠、硝酸铝、氢氧化钠均为国产分析纯。
1.2 仪器与设备
M-700微射流均质机 美国Microfluidics公司;GYB60-6S高压均质机 上海华东高压均质机厂;DFY-500型摇摆式高速万能粉碎机 温岭市林大机械有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;JD200-3B电子分析天平 沈阳龙腾电子有限公司。
1.3 方法
1.3.1 芦丁标准曲线的制作[14]
精确称取经120℃干燥至质量恒定的芦丁9.1mg,用70%乙醇溶解后,移入50mL容量瓶中,用乙醇定容至刻度,配制成标准溶液质量浓度为0.182mg/mL。分别吸取标准液0.00、0.20、0.40、0.80、1.20、1.60、2.00、3.00mL于10mL容量瓶中,分别加入质量分数5% NaNO2溶液0.4mL,摇匀,放置6min,加入质量分数10% Al(NO3)3溶液0.4mL,摇匀,放置6min,再加入质量分数4% NaOH溶液4mL,加70%乙醇至刻度,摇匀,静置15min,于波长510nm处测定吸光度,以芦丁质量浓度(C)为横坐标、吸光度(A)为纵坐标绘制标准曲线。
1.3.2 总黄酮提取的工艺流程
甘薯叶粉→乙醚脱脂、脱色(6h)→50℃烘干(2h)→乙醇浸润(12h)→均质(30MPa,均质2次)→动态超高压微射流处理→热醇回流提取→离心→抽滤→定容→测定吸光度→计算得率
1.3.3 甘薯叶黄酮得率的计算
取0.3mL提取液,同标准曲线操作,比色测定,求得黄酮质量,并计算黄酮的得率。

1.3.4 甘薯叶黄酮提取的单因素试验
影响甘薯叶黄酮提取的主要因素有微射流处理压力、微射流处理次数、乙醇体积分数、提取温度、提取时间、料液比、提取次数等。由于设备条件所限,并结合前期实验研究,选用料液比为1:40(g/mL),提取次数为两次。因此,本实验主要考察微射流处理压力、微射流处理次数、乙醇体积分数、提取温度、提取时间对甘薯叶黄酮提取得率的影响。
1.3.5 黄酮提取的正交试验设计
在单因素试验基础上,选取对甘薯叶黄酮得率影响较大的4个因素,进行四因素三水平正交试验设计L9(34),试验重复两次。对结果进行分析,确定甘薯叶黄酮提取的最佳工艺条件。
2 结果与分析
2.1 芦丁标准曲线
芦丁标准曲线回归方程:A=8.9168C-0.0006, R2=0.9998,线性范围:0~0.06mg/mL。
2.2 微射流处理压力对甘薯叶黄酮提取的影响
分别称取10.00g脱色后的甘薯叶粉,按1:40(g/mL)固液比加入体积分数70%乙醇,浸泡12h,经30MPa均质后,分别在微射流压力60、80、100、120、140MPa下处理2次,70℃水浴提取90min,提取两次,并与相同条件下常规提取以及30MPa均质后提取对比。

图1 不同处理压力对黄酮得率的影响Fig.1 Effect of microfluidization pretreatment pressure on extraction rate of flavonoids
由图1可见,同常规提取和30MPa均质后提取相比,微射流可以显著提高甘薯叶黄酮的得率,并且随着微射流压力的增加黄酮得率呈上升趋势,当微射流处理压力在100MPa时,得率最高;当压力大于100MPa时,黄酮得率有所降低,这可能是由于过高的压力引起高频振荡类似于超声波使少量溶出的黄酮结构破坏。因此,选择微射流压力100MPa。
2.3 微射流处理次数对甘薯叶黄酮得率的影响

图2 微射流处理次数对黄酮得率的影响Fig.2 Effect of microfluidization pretreatment number on extraction rate of flavonoids
分别称取10.00g脱色后的甘薯叶粉,按1:40(g/mL)固液比加入体积分数70%乙醇,浸泡12h,经30MPa均质后,在微射流压力100MPa下处理1、2、3、4、5次,再经70℃水浴提取90min,提取两次。由图2可见,在微射流100MPa下,随着微射流处理次数的增加,甘薯叶黄酮得率逐渐升高,但经微射流2次处理提取后,黄酮得率上升趋势趋于平缓,对黄酮得率影响较小,而且随着处理次数的增加,成本增加。因此,选择微射流处理次数2次。
2.4 乙醇体积分数对甘薯叶黄酮得率的影响
分别称取10.00g脱色后的甘薯叶粉,按1:40(g/mL)固液比加入体积分数分别为50%、60%、70%、80%、90%乙醇,浸泡12h,经30MPa均质后,在微射流压力100MPa下处理2次,再经70℃水浴提取90min,提取两次。

图3 乙醇体积分数对甘薯叶黄酮得率的影响Fig.3 Effect of ethanol concentration on extraction rate of flavonoids
由图3可见,随着乙醇体积分数的增加,甘薯叶黄酮得率增加,在体积分数70%时达到最高值;当体积分数继续增加时黄酮得率下降,并且脂溶性物质溶出增多,增加了纯化除杂的难度。因此从提取效率和提取纯度综合考虑选择乙醇体积分数为70%。
2.5 提取温度对甘薯叶黄酮提取得率的影响
分别称取10.00g脱色后的甘薯叶粉,按1:40(g/mL)固液比加入体积分数70%乙醇,浸泡12h,经30MPa均质后,在微射流压力100MPa下处理2次,分别用50、60、70、80、90℃水浴提取90min,提取两次。
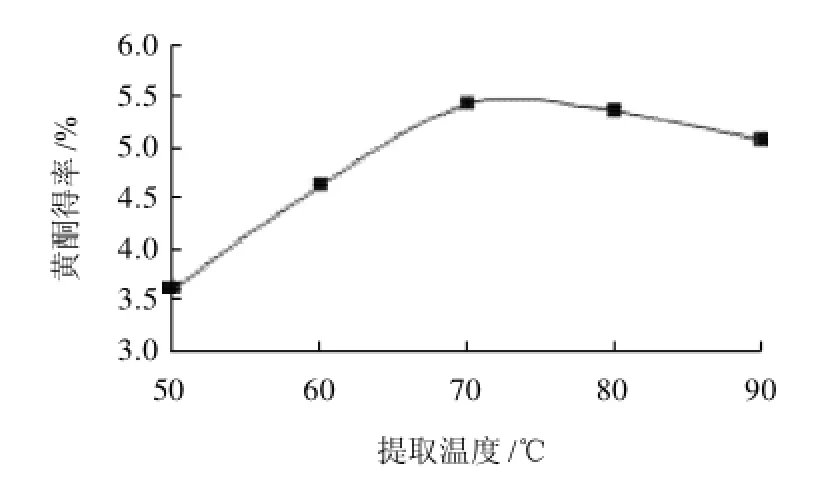
图4 提取温度对甘薯叶黄酮的影响Fig.4 Effect of extraction temperature on extraction rate of flavonoids
由图4可见,温度对甘薯叶黄酮得率的影响较大,随着温度的增加,甘薯叶黄酮得率增加,当温度达到70℃时,黄酮得率最高;随着温度的进一步升高,黄酮得率有所下降,其原因可能是过高的温度导致可溶性蛋白变性,使溶液黏度增加,阻碍了黄酮类物质的溶出,同时加速了活性成分的分解[15],从而降低了黄酮的得率。因此,选择最佳提取温度70℃。
2.6 提取时间对甘薯叶黄酮得率的影响
分别称取10.00g脱色后的甘薯叶粉,按1:40(g/mL)固液比加入体积分数70%乙醇,浸泡12h,经30MPa均质后,在微射流压力100MPa下处理2次,再经70℃水浴分别提取30、60、90、120、150、180min,提取两次。
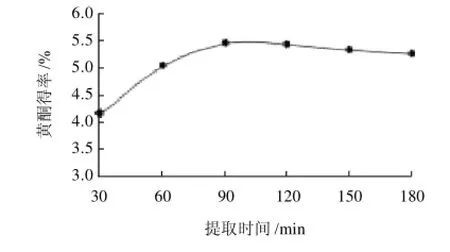
图5 提取时间对黄酮得率的影响Fig.5 Effect of extraction time on extraction rate of flavonoids
由图5可见,随着提取时间的延长,甘薯叶黄酮得率先增加逐渐趋于稳定,在90~120min时,黄酮得率趋于稳定,在120min以后黄酮得率略有下降。因此,从节约能耗和缩短生产周期方面考虑,选择甘薯叶黄酮提取的最佳时间为90~120min。
2.7 正交试验确定甘薯叶黄酮提取的最佳工艺条件

表1 正交试验因素水平表Table 1 Factors and levels of orthogonal experiments

表2 正交试验结果及极差分析Table 2 Results and range analysis of orthogonal experiments

表3 正交试验方差分析Table 3 Variance analysis of orthogonal experiments
通过单因素试验分析,选择微射流处理压力、乙醇体积分数、提取温度、提取时间4个因素,每个因素选择3个水平,以黄酮得率为考察指标,选用L9(34)表设计正交试验确定最佳提取工艺,见表1。
由正交试验数据表2分析可知,试验因素中对甘薯叶黄酮得率影响的顺序为:C(提取温度)>A(微射流处理压力)>B(乙醇体积分数)>D(提取时间)。提取条件的最优组合为A2B2C3D3,即微射流处理压力为100MPa、乙醇体积分数70%、提取温度75℃、提取时间120min。表3方差分析结果表明,提取温度是影响甘薯叶黄酮得率的最主要因素,其次是微射流处理压力,两者对甘薯叶黄酮得率影响达到显著水平(P<0.05)。
以微射流处理压力100MPa、乙醇体积分数70%、提取温度75℃、提取时间120min为条件进行实验验证,对样品平行提取5次,黄酮得率分别为5.74%、5.69%、5.76%、5.77%、5.81%,平均得率为5.75%,RSD为0.76%。结果表明本实验最佳工艺条件合理,同时也表明此工艺条件具有较好的重复性。
3 结 论
选取微射流处理压力、微射流处理次数、乙醇体积分数、提取温度和提取时间为单因素,以黄酮得率为考察指标,对黄酮的提取条件进行研究,确定微射流处理压力、乙醇体积分数、提取温度和提取时间为影响黄酮得率的主要因素。
通过正交试验确定了甘薯叶黄酮的最佳提取工艺:微射流处理压力100MPa、乙醇体积分数70%、提取温度75℃、提取时间120min,其中提取温度和微射流处理压力对黄酮的得率影响显著(P<0.05),在最佳提取条件下甘薯叶黄酮得率为5.75%。
[1]朱丽娜, 吴朝比, 陆英. 红薯叶黄酮类化合物提取工艺研究[J]. 现代农业科学, 2009, 16(7): 36-37.
[2]CARVALHO I S, CAVACO T, CARVALHO L M, et al. Effect of photoperiod on flavonoid pathway activity in sweet potato (Ipomoea batatas (L.) Lam.) leaves[J]. Food Chemistry, 2010, 118(2): 384-390.
[3]陆英, 吴朝比, 蒋华军, 等. 红薯叶黄酮分离纯化工艺及抗氧化性研究[J]. 食品科学, 2009, 30(14): 114-118.
[4]罗丽萍, 高荫榆, 洪雪娥, 等. 甘薯叶柄藤类黄酮的抗肿瘤作用的研究[J]. 食品科学, 2006, 27(8): 248-250.
[5]罗丽萍. 甘薯叶柄藤中试综合提取的活性多糖、类黄酮构成及生理活性研究[D]. 南昌: 南昌大学, 2006: 57-61.
[6]李文芳, 黄美娥, 唐纯翼, 等. 甘薯地上部分黄酮类化合物含量变化[J]. 天然产物研究与开发, 2006(18): 304-307.
[7]LIU Wei, LIU Jianhua, LIU Chengmei, et al. Activation and conformational changes of mushroom polyphenoloxidase by high pressure microfluidization treatment[J]. Innovative Food Science and Emerging Technologies, 2009, 10(2): 142-147.
[8]刘成梅, 钟业俊, 刘伟, 等. 瞬时高压作用对谷草杆菌的杀灭模型[J].食品科学, 2006, 27(6): 96-99.
[9]涂宗财, 王艳敏, 刘成梅, 等. 动态超高压微射流技术在玉米花粉多糖提取中的应用[J]. 食品工业科技, 2010, 31(6): 212-214.
[10]涂宗财, 王辉, 刘成梅, 等. 动态超高压微射流对蛋清蛋白溶液的粒度和流变性影响[J]. 食品科学, 2007, 28(6): 27-29.
[11]涂宗财, 张雪春, 刘成梅, 等. 超高压微射流对花生蛋白结构的影响[J]. 农业工程学报, 2008, 24(9): 306-308.
[12]涂宗财, 张博, 任维, 等. 超高压微射流对玉米淀粉机械力化学效应的研究[J]. 食品工业科技, 2008(2): 172-174.
[13]涂宗财, 朱秀梅, 陈钢, 等. 动态超高压微射流对糯米淀粉结构的影响[J]. 光谱学与光谱分析, 2010, 30(3): 834-837.
[14]高丽威, 李向荣. 微波萃取法提取紫心甘薯总黄酮即其抗氧化活性研究[J]. 浙江大学学报, 2009, 36(5): 571-574.
[15]唐浩国. 黄酮类化合物的研究[M]. 北京: 科学出版社, 2009: 39.
Extraction of Flavonoids from Sweet Potato Leaves by Dynamic High-pressure Microfluidization Technology
LI Zhi,TU Zong-cai*,MAO Yuan-wen,JIANG Ying,LUO Xiao-hui,ZHANG Lu
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
In order to optimize the extraction processing parameters of flavonoids from sweet potato leaves, single-factor and orthogonal experiments were used to investigate the effects of dynamic high-pressure microfluidization pretreatment pressure, ethanol concentration, extraction temperature and extraction time on extraction rate of flavonoids. Results indicated that the optimal extraction processing parameters microfluidization pressure of 100 MPa, aqueous ethanol concentration of 70%, extraction temperature of 75 ℃ and extraction time of 120 min. Under these optimal extraction conditions, the yield of flavonoids was 5.75%.
sweet potato leaves;flavonoids;dynamic high-pressure microfluidization
TS201.1
A
1002-6630(2010)24-0083-04
2010-09-21
国家科技型中小企业技术创新基金项目(09C26213604437)
李志(1984—),男,硕士研究生,研究方向为植物活性成分的提取与纯化。E-mail:tclizhi@163.com
*通信作者:涂宗财(1965—),男,教授,博士,研究方向为天然产物开发与利用。E-mail:tuzc_mail@yahoo.com.cn
