甜菜单胚雄性不育系与保持系花药及小孢子发生的超微结构观察
2010-03-24王华忠吴则东韩英
王华忠,吴则东,韩英
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.中国农业科学院北方糖料作物资源与利用重点开放实验室,哈尔滨150080;3.中国农业科学院甜菜研究所/黑龙江大学农作物研究院,哈尔滨150080)
甜菜单胚雄性不育系与保持系花药及小孢子发生的超微结构观察
王华忠1,2,3,吴则东1,2,3,韩英1,2,3
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.中国农业科学院北方糖料作物资源与利用重点开放实验室,哈尔滨150080;3.中国农业科学院甜菜研究所/黑龙江大学农作物研究院,哈尔滨150080)
为阐明甜菜单胚雄性不育系和保持系花药及小孢子发育的超微结构差异,以自育的甜菜单胚细胞质雄性不育系(CMS系)TB9-CMS和保持系(O型系)TB9-O为试验材料,在甜菜花芽分化、现蕾初期、开花初期分别进行4次花蕾取样,电子显微镜观察花药及小孢子发育过程的超微结构差异。结果表明,甜菜单胚CMS系与O型系花药和小孢子发育过程的超微结构存在明显差异。甜菜单胚CMS系花药壁产生初始期与O型系相似,但小孢子母细胞的数量较少,液泡化明显;绒毡层发育初期也形成乌氏体原始颗粒,但仅维持初始状态而停止发育;绒毡层在四分体期收缩离位,瓦解内移;小孢子母细胞形成四分体后,胼胝质壁较厚,小孢子逐渐变异开始退化。观察还发现,甜菜绒毡层细胞间以及形成四分体的胼胝质壁间有胞间连丝结构。
单胚甜菜;雄性不育;花药;小孢子发生;超微结构
我国对甜菜细胞质雄性不育的研究和利用起步较晚,20世纪70年代初期才开始进行。特别是对于单胚甜菜雄性不育的细胞学以及超微结构的研究尤为偏少。因此,本研究对单胚甜菜雄性不育机制的基础研究和杂种优势利用具有重要意义。甜菜细胞质雄性不育于1942年由F.Owen发现[1,2],Savitsky发现单胚种以后,单胚与雄性不育相结合的品种选育开始盛行[1,2]。对甜菜雄性不育花药的研究,我国桂明珠等[3-5]对甜菜多胚及单胚雄性不育系与保持系雄性器官进行了形态学观察,申家恒[6]观察了甜菜正常发育的大小孢子发生和雌雄配子体发育。Bedinger[7]对甜菜雄性不育花药的解剖学观察发现,甜菜不同来源不同类型的雄性不育系,在小孢子单核期小孢子发育受到限制,表现为细胞肥大或绒毡层由细胞型转化为原生质型。Hallden C[8,9]用光学和透射电子显微镜观察发现,CMS较雄性可育的花药发育模式存在更大的变异力。在CMS花药减数分裂早前期观察到绒毡层细胞降解或不规则增生,其它早期异常现象为小孢子母细胞出现大量小囊泡和混乱的染色质凝聚。Jossem B[10]利用扫描电子显微镜观察,直到四分体期,雄性不育系小孢子发生均正常,小孢子从胼胝质壁释放后发育受阻。中岛博、细川定治[11,12]进行电子显微镜观察认为,绒毡层产生乌氏体(Ubisch body)减少是导致雄性不育发生的原因。Majewska-Sawka A[13]利用电子显微镜观察发现雄性不育株花药发育异常表现为线粒体缩小,核糖体数减少,绒毡层不能形成乌氏体,乌氏体的缺乏导致小孢子外壁发育不完全等等。Hornsey K G[14]以及Powling A[15]从分子水平上发现甜菜O型系与CMS系线粒体DNA存在明显差异。由于国外的报道对影响甜菜雄性不育的看法不甚一致,特别对绒毡层产生乌氏体的有无或多少还存在疑问,并且,国内对于单胚甜菜雄性不育花药的超微结构观察尚无报道。因此,本研究重点对甜菜雄性不育系和保持系发育过程中花药及小孢子的超微结构进行比较研究。通过电子显微镜观察,阐明甜菜单胚雄性不育系和保持系花药及小孢子发育的细胞学以及超微结构的差异,明确绒毡层产生乌氏体的有无或多少,为甜菜单胚雄性不育的机制研究和利用提供理论依据。
1 材料与方法
1.1 材料
试验于2005~2006年进行,试验材料为中国农科院甜菜研究所自育的单胚甜菜细胞质雄性不育系(CMS系)TB9-CMS和保持系(O型系)TB9-O。CMS系及其O型系的单胚率均在98%以上,CMS系的不育率均达100%。
1.2 试验方法
1.2.1 母根栽植取样2005年培育母根,窖藏越冬春化后,2006年春季4月25日成对栽植CMS系及其O型系母根各100株。当甜菜花芽分化、现蕾初期、开花初期期间,分别于6月5日、6月8日、6月11日、6月14日对花穗进行4次取样,每次取样分别按照透射和扫描电镜观察的要求进行。
1.2.2 透射电镜样品的制备(1)固定:每次取花蕾40枚立即将材料置于2.5%戊二醛固定液中,在0~4℃条件下固定2~3 h后,用与配制固定液相应的缓冲液冲洗3次,再用2%四氧化锇固定1~2 h,再用相应的缓冲液冲洗3次。(2)脱水:固定材料经系列乙醇进行脱水,即30%乙醇10 min→50%乙醇10 min→70%乙醇10 min→90%乙醇15 min→100%乙醇冲洗3次,每次15 min。(3)浸透、包埋与聚合:①浸透:经过脱水材料进行逐级渗透,即100%丙酮∶包埋剂=1∶1,室温1 h;100%丙酮∶包埋剂=1∶2,室温2 h;100%丙酮∶包埋剂=1∶3,室温下过夜。②包埋:将包埋块放入浅槽的前后两端,写好标签入浅槽中,注入包埋剂。③聚合:将包埋好的胶囊,置于包埋膜上,放恒温箱中,梯度聚合,温度分别为37℃、45℃、60℃,时间分别为17 h、24 h、17 h。(4)切片,观察:用超薄切片机切成薄片,将所有超薄切片经醋酸双氧铀-柠檬酸铅双重染色,将切片用JEM-1200EX透射电镜观察,并拍片纪录。
1.2.3 扫描电镜样品制备材料用戊二醛固定后,用pH 6.8的磷酸缓冲液冲洗,用乙醇系列脱水,至100%乙醇后,用叔丁醇置换,再用冷冻干燥仪干燥;离子溅射镀膜仪喷金,其厚度为最后制备的样品用日立S-3400N扫描电镜观察。
2 观察结果
甜菜CMS系及O型系小孢子发育的超微结构可人为划分4个时期,观察结果如下。
2.1 小孢子母细胞时期
2.1.1 O型系花药横切面观察,O型系的花粉母细胞的数量较多,发育正常,花粉母细胞的细胞核大,核中的染色质分散,核仁明显。细胞质浓厚,其中分布丰富的细胞器,主要是线粒体和质体,核糖体也很丰富。有时在小孢子母细胞的外壁上已有胼胝质物质沉积。在小孢子母细胞时期,绒毡层细胞比表皮、药室内壁、中层细胞明显增大,原生质浓厚,细胞器也较丰富,而其他各层细胞产生大液泡,将原生质挤至细胞周边,并有较多的淀粉粒(图1、2)。

1.O型系花药横切,示花药壁与花粉母细胞

2.O型系花药横切,示花粉母细胞、花药壁各层细胞清晰

3.CMS系花药横切,示各部细胞液泡化明显
2.1.2 CMS系观察表明,CMS系小孢子母细胞与O型系相比,花药发育过程、结构大体相似。但CMS系花药小孢子母细胞的数量较少,而另一个特点是液泡化程度明显超过O型系。花药的表皮、药室内壁、中层液泡化,各层细胞中均有大的液泡产生。而绒毡层和花粉母细胞也产生数量较多的小液泡,花粉母细胞开始有退化现象(图3、4)。
2.2 四分体时期
2.2.1 O型系小孢子母细胞经过减数分裂产生四分体。甜菜小孢子母细胞减数分裂属于同时型,四分体的排列方式属四面体型。四分体被胼胝质壁包围,初期四分体之间可见到胞间连丝,每个细胞核大,核膜清晰,核仁明显,细胞质和细胞器数量较多,此时小孢子的原外壁开始产生。绒毡层细胞内切向壁已开始降解,但仍含丰富的细胞器(图5、6)。

4.CMS系花药横切,示各部细胞液泡化
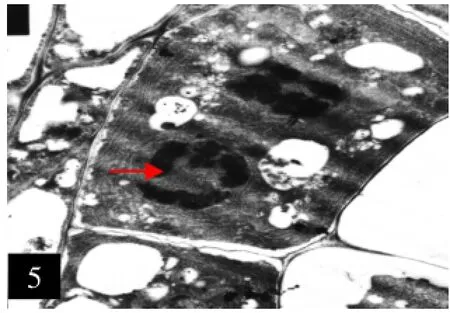
5.O型系绒毡层细胞核分裂

6.O型系四分体,示胞间连丝
2.2.2 CMS系CMS系的四分体形成过程与O型系一致,即小孢子母细胞经过减数分裂产生的四分体,为同时型和四面体型。但是,四分体被厚厚一层胼胝质壁所包围,小孢子之间也发现胞间连丝结构。四分孢子大小不甚整齐,有个别的小孢子开始退化,细胞质中产生多数小型液泡。小孢子外壁开始形成,此时绒毡层细胞变化明显,绒毡层整体开始脱离中层,向内移动(图7、8)。
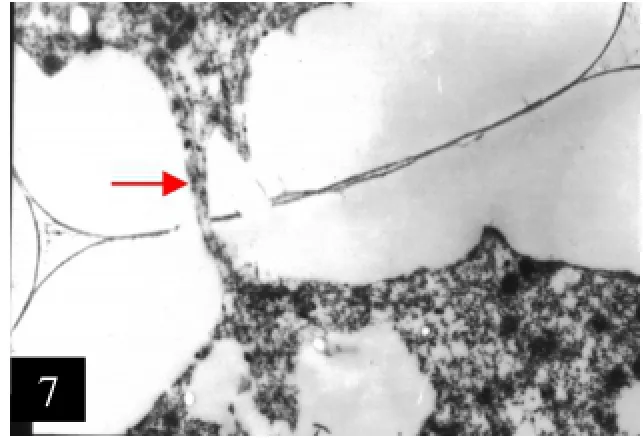
7.CMS系绒毡层细胞径向壁胞间连丝

8.CMS系四分体,示胼胝质壁较厚

9.O型系小孢子和绒毡层
2.3 单核小孢子时期
2.3.1 O型系在绒毡层细胞分泌β-1,3葡萄糖酶及胼胝质酶的作用下,使胼胝质壁融解消失,四分小孢子彼此散开。游离的小孢子含有一个大的细胞核,位于中央,核质、细胞质稠密,其内含有线粒体、质体、高尔基体及内质网等多种细胞器等。随着小孢子继续发育,细胞内逐渐出现液泡,内质网的数量也有所增加,小孢子的外壁基本形成(图9、10)。与此同时,绒毡层细胞内含有大液泡,进一步发育,细胞质内的质体开始向造油体转化,使内部结构模糊不清,出现一些颗粒状物质,靠近内切向壁的一侧出现乌氏体颗粒结构(图11、12)。

10.O型系小孢子

11.O型系绒毡层与乌氏体

12.O型系乌氏体与花粉壁
2.3.2 CMS系随着四分体胼胝质壁消失,小孢子散开后,小孢子发育迟缓,并且大部分小孢子明显退化、瓦解。细胞质和细胞器逐渐减少、萎缩,液泡化明显,进而细胞核逐渐破坏,轮廓不清,停止发育(图13、14)。在小孢子停止发育,退化瓦解进程中,绒毡层细胞也开始退化瓦解。观察发现小孢子发育不久,偶尔见到少量绒毡层在细胞核变形的同时,位于近切向壁一侧出现明显的线粒体质体,绒毡层发育初期也产生乌氏体原始颗粒,但仅维持初始状态而停止发育(图15)。且大部分绒毡层细胞逐渐退化,液泡化使细胞质不规整,细胞质细胞器破坏,径向壁首先破坏,以后整个细胞瓦解,残留的无壁结构的物质脱离中层,绒毡层整体向内移动(图13)。

13.CMS系小孢子和绒毡层

14.CMS系小孢子核消失

15.CMS系绒毡层乌氏体颗粒
2.4 花粉的发育与败育时期
2.4.1 O型系的花粉发育当小孢子产生以后,其内产生大的液泡,将细胞质挤到了细胞的一侧,使小孢子处于不对称的极性状态,即核和细胞质、细胞器发生不均匀分布,常称为小孢子单核靠边期,为进行不等分裂作准备。此时细胞质内的细胞器比较丰富,主要有线粒体、质体及少量内质网等(图16)。进而进行一次不均等的有丝分裂,产生2细胞型花粉,最后花粉内的生殖细胞又进行一次分裂,产生两个精子,甜菜花粉属3-C型花粉。在发达的外壁形成之后,又产生较薄的内壁;甜菜花粉为圆球状,直径10~15nm,多萌发孔30~48个,平均38.2个(图17)。甜菜O型系花粉形成过程中,绒毡层属腺质绒毡层,在原位耗尽瓦解。
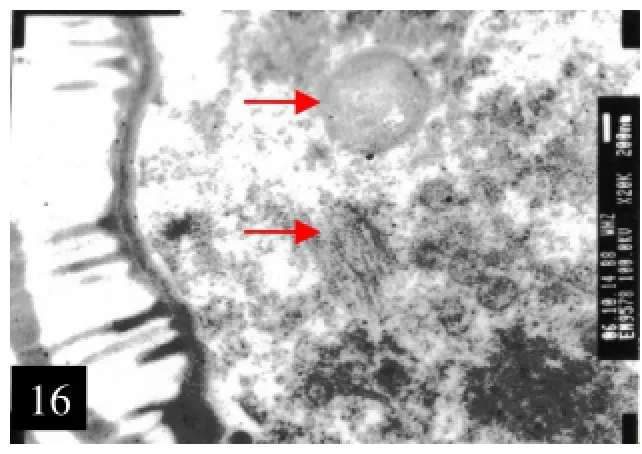
16.O型系花粉内细胞器,示线粒体、淀粉

17.O型系成熟花粉
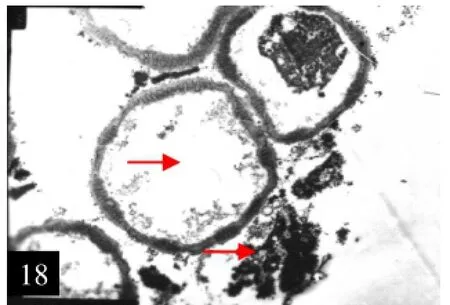
18.CMS系败育花粉与绒毡层细胞残体
2.4.2 CMS系花粉败育CMS系小孢子分离后,细胞停止正常发育,处于不断瓦解的过程,细胞质、细胞核不断萎缩,液泡化极为明显,小孢子外壁也不再增厚,败育的花粉往往是空瘪的。在小孢子败育过程中,绒毡层呈无定形的颗粒状,残余物质进入花粉囊内,混入败育花粉其间而枯萎(图18、19)。

19.CMS系绒毡层残余物质
3 讨论
3.1 关于乌氏体的发育
在甜菜O型系花药发育过程中,在小孢子四分体分离以后,花药壁内绒毡层细胞的内切向壁附近,产生大量的近等直径的颗粒即乌氏体;而在CMS系的发育过程中,绒毡层开始也形成乌氏体原始颗粒,但在其后发生内移和细胞瓦解等过程中乌氏体不发育,最后随绒毡层细胞一起粘连而枯萎。观察发现,甜菜的乌氏体的形状不甚规则,而中央透明的部分常常偏向一侧,这与已报道的小麦乌氏体的形态有所区别[16,17],小麦乌氏体超微结构是中央部分透明,周围是一层厚的由孢粉素组成的壁。甜菜O型系的乌氏体成熟后似乎还要喷射或释放什么颗粒状物质,有待继续研究。这是本研究的又一发现。
3.2 关于四分体时期胼胝质壁间的胞间连丝
据研究表明[18-20],在绝大多数植物中,从四分体时期开始,到小孢子形成,由于胼胝质壁的分组,细胞之间无联系,而且继续发育,甚至花粉成熟和萌发都是以四分体为单位进行。但在兰科及少数其它植物中在小孢子之间存在着细胞质通道。除了复合花粉植物外,其它胼胝质壁以后无胞间连丝,失去小孢子之间的联系。但本研究观察意外发现,甜菜形成四分体的胼胝质壁中有胞间连丝的结构。此现象有待深入研究。
4 结论
甜菜CMS系花药壁产生始期与O型系相似,在CMS系的发育过程中,绒毡层开始也形成乌氏体原始颗粒,但仅维持初始状态不能发育而枯萎;甜菜单胚CMS花药和花粉败育的主要表现是绒毡层细胞和小孢子母细胞液泡化明显;绒毡层发育过程,收缩离位,瓦解内移;小孢子母细胞形成四分体后,胼胝质壁发达,小孢子逐渐变异开始退化,细胞质与细胞核逐渐收缩,直至空虚无物。甜菜形成四分体的胼胝质壁中有胞间连丝结构。
[1]董一忱.甜菜农业生物学[M].北京:农业出版社,1984:25-56.
[2]聂绪昌,田凤雨.甜菜育种与良种繁育[M].哈尔滨:黑龙江省科学技术出版社,1982:36-68.
[3]桂明珠,王慧生,王馥兰,等.甜菜雄不育系与保持系雄性器官的形态学观察[J].中国甜菜,1985(3):10-14.
[4]桂明珠,王承林,王馥兰,等.甜菜花器解剖结构初报[J].中国甜菜,1982(3):1-9.
[5]王华忠,吴则东,韩英,等.甜菜单胚雄性不育系及其保持系的生殖期形态学与细胞学研究[J].中国农业科学,2007,40(7): 1550-1558.
[6]申家恒.甜菜大小孢子与雌雄配子体发育[J].作物学报,1986,12(3):21-24.
[7]Bedinger R.The remarkable biology of pollen[J].Plant Cell,1992,4:879-887.
[8]Hallden C.Bryngelsson T.Bosemark two new types of cytoplasmic male sterillty found in wild beta beets[J].Theor Appl.Genet,1988,75:561-568.
[9]Hallden C,C Lind and I M Moller.Variation in mitochondrial translation products in fertile and cytoplasmic male-sterile sugar beets[J].Theor.Appl.Gebet,1992,85:139-145.
[10]Jossem B.Anther fertile and cytoplasmic male sterile line in sugar beet by scanning electron microscope[J].Genetiea Polonlca,1989,30:139-144.
[11]中岛博.てん菜雄性不稔について花药の电子显微镜观察.第13回甜菜技术协作研究会论文集[C].1973:21-25.
[12]细川定治.テンサイ雄性不稔に関する组织化学的研究[J].育种学杂志,1963,13(2):28-38.
[13]Majewska-Sawka A,M I Rodriguez-Garcia,H Nakashima and B Jassen.Ultrastructure expression of cytoplasmic male sterile sugar beet(Beta vulgaris L.).Plant Breeding Abstract,1993,11:1578.
[14]Hornsey K G.Attempted pollen-transmission of cytoplasmic male sterility and the spontaneous occurrence of male sterility in O-type lines of sugar beet(Beta vulgaris L.)[J].Theoretical and Applied Genetics,1973,43:31-34.
[15]Powling A,Ellis T H N.Studies on the organelle genomes of sugar beet with male-fertile and male-sterile cytoplasms[J]. Theoretical and Applies Genetics,1983,65:323-328.
[16]胡适宜.小麦雄性不育系和保持系的小孢子发育的电子显微镜研究[J].植物学报,1977,19(13):167-171.
[17]胡适宜.被子植物胚胎学[M].北京:人民教育出版社,1982.
[18]陈机.植物发育解剖学(上册)[M].济南:山东大学出版社,1992.
[19]孙日飞.萝卜胞质大白菜雄性不育性的研究[D].北京:中国农业科学院,1999.
[20]吉成均,杨雄,李正理.银杏大孢子形成的超微结构研究[J].植物学报,1999,41(12):1323-1326.
Ultrastructural Observations on the Anther and Microsporogenesis in Monogerm CMS Lines and Its O-type Lines of Sugarbeet
WANG Hua-zhong1,2,3,WU Ze-dong1,2,3,HAN Ying1,2,3
(1.The Key Laboratory of Sugarbeet Genetic Breeding,Heilongjiang University,Harbin 150080,China;2.The Key Laboratory of North Sugar Crop Resource and Utilization,Chinese Academy of Agricultural Sciences,Harbin 150080,China;3.Sugarbeet Research Institute of Chinese Academy of Agricultural Sciences/Institute for Crop Research,Heilongjiang University,Harbin 150080,China)
Ultrastructural differences were observed on the anther and microspore genesis in monogerm cytoplamsic male sterile(CMS)lines and its O-type lines of sugarbeet.Ultrastructural characteristics of anther and microsporogenesis at flower bud differentiation,early budding stage and early flower stage of CMS lines and O-type lines in sugarbeet were described in detail under electron microscope.Though monogerm CMS lines and its O-type lines ofsugarbeethad a similar structure in initial period of anther wall,microspore mother cells were clearly vacuolized and fewer in numbers.The early development of tapetum,original particles of ubisch bodies were formed,which maintain their initial state.Morever,tapetum was contracted into dislocation and collapsed at tetrad stage.Callose wall was thick after microspore mother cells formed into tetrad.Meanwhile,microspores were varied gradually and degraded.Plasmodesmi were detected among the tapetum cells and callose wallofthe tetrad.
Monogerm sugarbeet;Male sterility;Anther;Microsporogenesis;Ultrastructure
S566.301
A
1007-2624(2010)01-0005-05
2009-10-16
国家“863”计划项目(2001AA241192)“糖料新品种选育”课题;国家科技支撑计划项目(2006BAD01A06)“高产优质专用甜菜育种技术研究及新品种选育”。
王华忠(1957-),男,辽宁省西丰县人,研究员,博士,从事甜菜遗传育种研究。E-mail:wwhhzz0451@sohu.com。
