邻二氮菲-Fe2+法测定保健食品的抗氧化能力
2010-03-23王宏君
刘 薇,王宏君,赵 建,文 悦,文 镜*
(生物活性物质与功能食品北京市重点实验室,北京联合大学应用文理学院,北京 100191)
邻二氮菲-Fe2+法测定保健食品的抗氧化能力
刘 薇,王宏君,赵 建,文 悦,文 镜*
(生物活性物质与功能食品北京市重点实验室,北京联合大学应用文理学院,北京 100191)
目的:用邻二氮菲-Fe2+法测定保健食品抗氧化能力。方法:以Trolox为标准参照物,通过单因素分析,确定试剂用量及反应时间对线性关系、最低检测限、平行性精密度、重复性精密度、加标回收率等指标进行测定。结果:Trolox在质量浓度0.01~0.15g/L范围内线性关系良好;最低检测下限为0.0050g/L;平行性精密度为(375±12)μmol/g,变异系数3.2%;重复性精密度为(365±16)μmol/g,变异系数4.4%;5次重复加标回收率为(98.0±2.4)%。结论:改良的邻二氮菲-Fe2+法适用于保健食品抗氧化能力的检测。
保健食品;抗氧化能力;邻二氮菲-Fe2+法
多项研究证明衰老以及多种疾病的发生过程都与活性氧有关。因此,与健康关系密切的食品,特别是功能性食品抗氧化能力的测定,以及对生物体内抗氧化水平的分析引起了人们的广泛关注[1-5]。功能性食品抗氧化能力的体外测定方法相对于体内测定方法简便、快捷、成本低、人员不需特别训练,适用于对大批量材料的筛选、抗氧化保健食品市场监督以及在保健食品抗氧化功能评价中作为体内评价结果的旁证[6-7]。体外测定抗氧化物质清除自由基的方法主要包括化学发光法、分光光度法、电子自旋共振法、电化学检测法、气相色谱法和荧光法等[8-13]。邻二氮菲-Fe2+法属于分光光度法,最初是利用邻二氮菲可与Fe2+生成橙红色有色物而用于检测样品中Fe2+的方法[14-15]。由于Fenton反应[16]产生的羟自由基能够氧化反应体系中的Fe2+,由此出现了用于检测Fenton反应产生羟自由基的邻二氮菲-Fe2+氧化法,虽然此方法对反应条件的要求较高,影响因素较复杂,但由于所需设备简单、试剂便宜、操作简便,此方法还是得到了较为广泛的应用[17]。但由于原方法是针对Fenton反应产生羟自由基的检测方法,如果将其应用于对保健食品的检测就会出现方法线性范围窄、最低检测限高、稳定性差、结果表达方式缺乏可比性等不足。目前,对于样品抗氧化值的表示方法上不同文献有着各自的表示方法,如:抗氧化剂对羟自由基的清除率表示法[18]、酶活力值表示法[19],虽然这些也能准确的反应抗氧化剂的能力强弱,但如若不同方法有着各自不同的表示抗氧化强弱的表示,那最终检测出的数据也就没有了
可比性。本实验主要研究邻二氮菲-Fe2+法的反应条件及反应体系,通过对反应条件及反应体系的改良来弥补原方法的不足,在方法改良过程中将对影响检测的各种因素进行实验分析,确定最佳实验条件,对方法的可行性进行实验确定。最终达到提高方法稳定性、扩大线性范围、降低最低检测限、使测定结果具有可比性、适用于保健食品抗氧化能力体外检测的目的。
1 材料与方法
1.1 材料与试剂
山竹粉、捯捻子素、红曲粉 义乌章舸生物工程有限公司;葡萄籽胶囊 艾申特生物科技有限公司;保健食品(品名:健康启程) 北京北卫药业有限责任公司。
六水合硫酸亚铁(Ⅱ)铵(硫酸亚铁铵)、1,10-邻二氮菲、柠檬酸、柠檬酸钠、磷酸、丙酮、环己烷、乙醇、30%双氧水(均为国产分析纯);抗坏血酸、水溶性VE(Trolox) Sigma公司。
1.2 仪器与设备
HH-4型数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;PP-15专业型pH计、P211D 分析天平 北京赛多利斯有限公司;涡旋混匀器 德国IKA公司;KQ-100B台式超声波清洗器 昆山市超声仪器有限公司;旋转蒸发装置(EYELA N-1001旋转蒸发仪,EYELA SB-2000水浴锅,SHB-ⅢA型循环水式多用真空泵) 上海爱明仪器有限公司;UV-2450 紫外-可见分光光度计 日本Shimadzu公司;METTLER AE100电子天平 梅特勒-托利多仪器(上海)有限公司;HS-4IKA WERKE C-MAG加热磁力搅拌器 广州仪科实验室技术有限公司;TDL-5CENTRIFUGE离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 实验原理
Fe2+与邻二氮菲能够生成稳定的橙红色络合物在536nm波长有最大吸收峰。反应体系中定量加入的Fe2+和H2O2通过Fenton反应产生羟自由基。自由基和氧化剂将一部分Fe2+氧化为Fe3+,使橙红色络合物减少。体系中加入抗氧化剂与体系中自由基和氧化剂反应,使Fe2+的减少受到抑制。用分光光度计测定橙红色络合物吸光度的变化即可知道抗氧化剂抗氧化能力的高低。以水溶性VE在反应体系中的抗氧化能力作为标准,以单位质量样品的抗氧化能力相当于多少水溶性VE来反映被测样品的抗氧化能力。
1.3.2 试剂配制
按常规方法配制:柠檬酸缓冲液(0.1mol/L、pH4.4)、六水合硫酸亚铁胺溶液(6mmol/L)、邻二氮菲溶液(6mmol/L)、双氧水(0.1%)、Trolox标准储备液(0.2g/L Trolox)。
1.3.3 样品的提取
精确称取样品(山竹粉0.01g、捯捻子素0.05g、葡萄籽胶囊0.1g、健康启程0.3g、红曲粉0.5g等)用30mL去离子水溶解后,超声提取30min,3000r/min离心10min,将上清液移入100mL容量瓶内,沉淀用50mL去离子水溶解后再提取一次,合并两次提取液,用去离子水定容至100mL摇匀,即为待测样品。
1.3.4 测定方法
1.3.4.1 实验条件的选择
根据反应机理调整反应体系中主要试剂用量及反应时间,采用单因素分析进行实验,探索最佳实验条件。
1.3.4.2 样品及Trolox的测定方法
按照表1所列顺序依次向试管中加入试剂并按表中规定的条件操作。
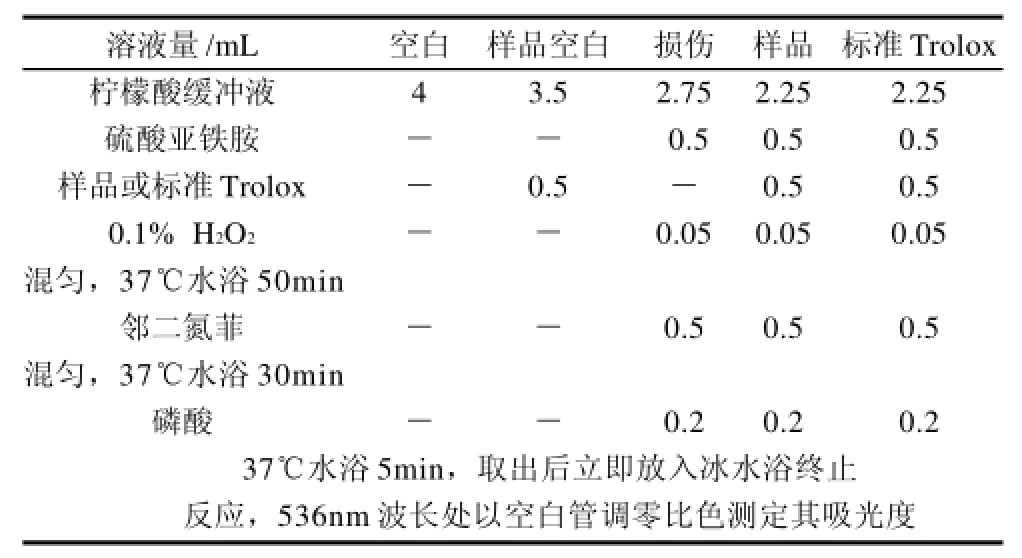
表1 样品及Trolox的测定方法Table 1 Reagent composition for antioxidant capacity assessment by phenanthroline- Fe2+method using trolox as the reference substance
每管加入邻二氮菲后应立即混匀,否则会影响重复性。
1.3.4.3 抗氧化能力值的计算
抗氧化能力值=[(A样品-A样品空白-A损伤)/(ATrolox-A损伤)]× [mTrolox/m样品] (1)
抗氧化能力值以Trolox当量(μmol Trolox当量/g)表示,即1g样品相当于Trolox的μmol数。式中:A样品为样品管吸光度;A样品空白为样品空白管吸光度;ATrolox为标准管吸光度;A损伤为损伤管吸光度。mTrolox为标准管所含Trolox的μmol数;m样品为标准管所含样品的质量。
1.3.4.4 标准曲线的绘制
将0.2g/L Trolox标准储备液分别取0.1、0.25、0.5、1.0、1.5mL于试管中,再分别加入1.9、1.75、1.5、1、0.5mL的去离子水,配成质量浓度为0.01、0.025、
0.05、0.1、0.15g/L的Trolox标准品溶液。按表1测定。
1.3.4.5 最低检测下限
连续测定损伤管吸光度10次,按式(2)计算结果。

式中:D.L为最低检测限;s为标准偏差;K为斜率。
1.3.4.6 平行性精密度实验
精确称取山竹粉0.01g五份,平行操作,用1.3.3节的方法提取后,按表1方法测定。按式(1)计算。
1.3.4.7 重复性精密度实验
取山竹粉前处理方法同上,每天测定1次,连续测定5d。按式(1)计算。
1.3.4.8 加标回收率实验
精确称取0.1000g葡萄籽提取物2份,其中一份定量加入0.0050g标准Trolox,样品处理及测定方法同上。重复测定5次。按式(1)、(3)计算。

2 结果与分析
2.1 实验条件的选择
2.1.1 H2O2用量的选择

表2 H2O2用量选择实验Table 2 Effect of hydrogen peroxide concentration
经过反复实验发现,H2O2加量为0.05mL时,最低检测限最小,检测范围最宽。H2O2加量过少,自由基产生的不够,检测范围较窄;H2O2加量过多,过量的H2O2与样品中还原性物质反应,还原性物质对Fe2+保护的灵敏性下降,使得检测下限偏高。
2.1.2 显色时间的选择
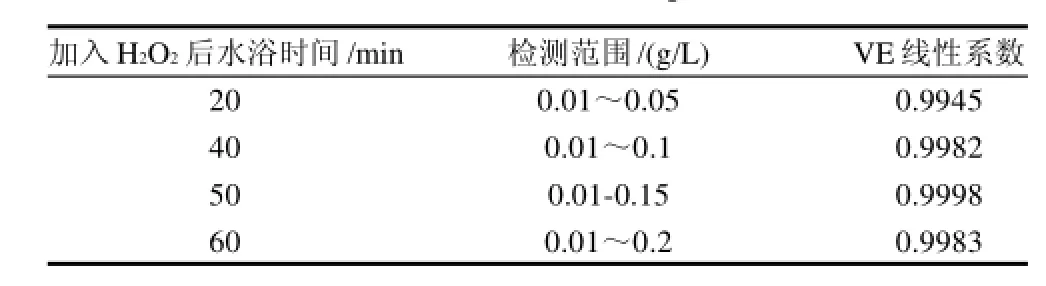
表3 显色时间选择实验Table 3 Effect of color development time
经过反复实验发现,水浴50min为H2O2产生自由基的最佳反应时间。水浴时间不足,自由基产生的不够,会使得线性范围较窄;水浴时间过长,会使得更多的Fe2+被H2O2氧化成Fe3+,Fe3+过多会干扰到Fe2+的颜色,因此线性关系不好。改变显色时间主要是为了扩大线性范围。如果损伤时间过长,低浓度的抗氧化成分不足以产生作用,造成最低检测下限有所升高。由此可见反应时间对线性范围和最低检测下限都有影响。为了达到扩大线性范围和降低检测下限的目的,就要衡量二者,使结果达到最佳。
2.1.3 溶剂的选择
由于此反应是离子间的氧化还原反应,离子越多实验的干扰因素也会随之增多,因此溶剂应选择去离子水。
2.1.4pH值的选择
在碱性条件下Fe2+容易和体系中的氢氧根离子形成絮状沉淀,影响比色,所以选择了pH4.4的酸性体系,消除了沉淀干扰。
2.1.5 二价铁试剂的选择
由于Fe2+不稳定,因此选用和铵根离子结合的硫酸亚铁铵,稳定性相对有所提高。但使用时最好现用现配。
2.1.6 反应温度的选择
为了使反应充分迅速,选用了37℃的水浴条件,但测定时为了减少各管之间存在的反应时间差,各平行管应同时进出水浴锅,取出时应立即将试管放入冰水浴中,让37℃反应立刻终止,然后再拿去比色。
2.2Trolox标准曲线的绘制
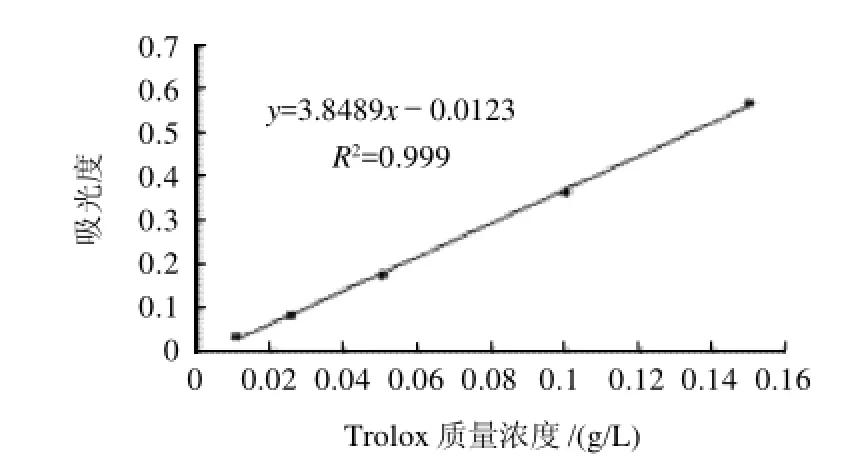
图1 Trolox标准曲线Fig.1 Trolox standard curve
应用改良后的方法经过反复实验发现:Trolox在质量浓度0.01~0.15g/L范围内有较好的线性关系和较低的检测下限。
2.3 最低检测下限实验
平行测定10次损伤值,结果见表4。

表4 最低检测下限实验结果Table 4 Determination of limit of detection
由式(2)计算可得,D.L=3s/K=3×0.006346/3.849= 0.0050g/L。
改良方法测得的结果显示,最低检测下限为0.0050g/L。虽然实验测得的值为0.0050g/L,但在实际样品测定时,样品浓度要稍高一些,否则测定结果不明显。
2.4 平行性精密度实验
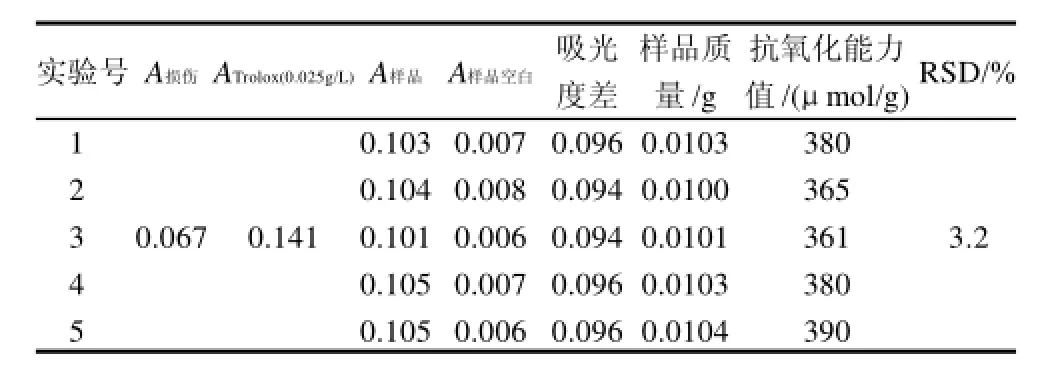
表5 平行性精密度实验结果Table 5 Relative standard deviation of the method in 5 parallel determinations
用山竹粉进行平行性精密度实验,其结果为(375± 12)μmol/g,变异系数为3.2%,表明方法的平行性精密度良好。
2.5 重复性精密度实验

表6 重复性精密度实验结果Table 6 Relative standard deviation of the method in 5 repeated determinations
用山竹粉进行重复性精密度实验,结果为(365±16) μmol/g,变异系数为4.4%,表明方法的重复性精密度良好。
2.6 加标回收率实验
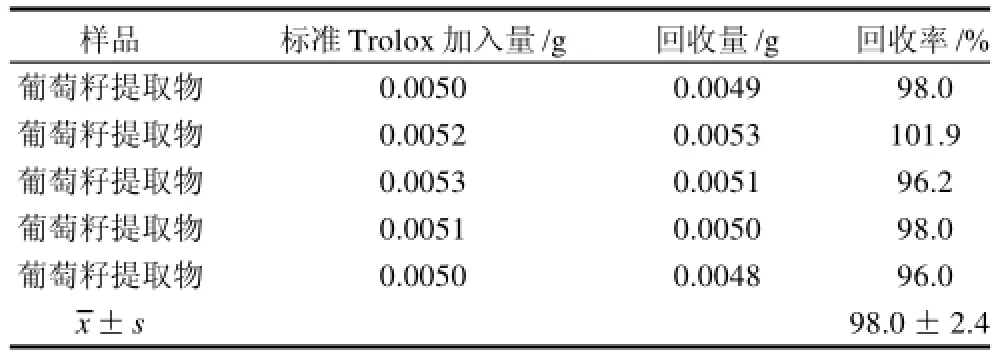
表7 加标回收率实验结果Table 7 Spike recoveries of the method
用葡萄籽提取物进行加标回收率实验,5次重复结果为(98.0±2.4)%,表明方法具有较好的准确度。2.75种样品抗氧化能力的测定
用改良方法顺利测定了山竹粉等5种样品的抗氧化能力,结果见表8。

表8 样品抗氧化能力测定结果(n=5)Table 8 Antioxidant capacity of some samples using the method
3 讨 论
3.1 方法的稳定性
用邻二氮菲-Fe2+法测定保健食品抗氧化能力,由于自由基是通过Fenton反应产生的,自由基产生量与H2O2有密切关系,反应体系中除了自由基和样品反应外,氧化剂也会直接参与反应。所以影响体系最终显色反应的因素较为复杂。只有控制好体系自由基的产生量才能使反应在检测样品抗氧化能力过程中稳定、灵敏并且有较宽的检测范围。因此需要对影响显色反应的主要因素进行实验分析。通过对主要影响因素的选择实验,改良后方法的稳定性、灵敏度和检测范围都得到了提高。
3.2 掩蔽干扰显色的离子
反应中Fe2+会被H2O2氧化为Fe3+,当Fe2+和Fe3+共存情况下,Fe3+的干扰是客观存在且不可忽视的。在酸性条件下Fe3+与H3PO4形成稳定的无色Fe(HPO4)+配离子,从而有效地排除了Fe3+对Fe2+离子测定的干扰。H3PO4不具有氧化性,测定时不参与对Fe2+离子的氧化作用。
3.3 标准样品的处理
Trolox虽然可以溶于缓冲液中,但溶解困难。因此用磁力搅拌器50℃混匀搅拌溶解不会对Trolox的还原性造成伤害。如果用二甲基亚砜溶解Trolox,虽然溶解效果更好,但二甲基亚砜自身有很强的还原性,对反应体系影响较大,所以选用50℃磁力搅拌溶解的方法。体系中不要加入二甲基亚砜。
3.4 标准物质的选择
在制作标准曲线时,同时以VC为标准品绘制标准曲线,也同样做平行性、重复性及稳定性实验,将其结果与Trolox对比发现VC的稳定性较低。所以选用更稳定的Trolox做标准品,这也相应地提高了标准曲线的线性关系。
3.5 试剂的存放时间
通过实验发现,试剂放置的时间不同会对实验结果造成较大的影响。由于反应试剂多是氧化或还原试剂,所以放置时间不宜过长,基本上要现用现配,这样可以减小误差。
3.6 检测样品的浓度
样品管的吸光度应在标准曲线的线性范围之内。若不在此范围,应采用稀释或浓缩的方法处理后再测定。但需注意用公式计算结果的时候应将稀释或浓缩倍数计算进去。
4 结 论
改良后的邻二氮菲-Fe2+法具有良好的准确度(RSD为3.2%)和精密度(RSD为4.4%);在0.01~0.15g/L Trolox质量浓度范围内具有较好的线性关系;以Trolox为标准参照物的结果表达方式使实验结果更具可比性。改良后的邻二氮菲-Fe2+法适用于保健食品抗氧化能力的检测。
[1]CHANG C Y, WU K C, CHIANG S H. Antioxidant properties and protein compositions of porcine haemoglobin hydrolysates[J]. Food Chemistry, 2007, 100: 1537-1543.
[2]续洁琨, 姚新生, 栗原博. 抗氧化能力指数(ORAC)测定原理及应用[J]. 中国药理学通报, 2006, 22(8): 1015-1021.
[3]ARUOMA O I. Methodological considerations for characterizing potential antioxidant actions of bioactive components in plant foods[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2003, 523/524: 9-20.
[4]ARUOMA O I. Nutrition and health aspects of free radicals and antioxidants [J]. Food Chem Toxicol, 1994, 32: 671-683.
[5]朱玉强. 天然抗氧化剂研究进展[J]. 甘肃石油和化工, 2008(2): 15-19.
[6]MAGALHAES L M, SEGUNDO M A, REIS S. Methodological aspects about in vitro evaluation of Antioxidant properties[J]. Analytica Chimic Aacta, 2008, 613: 1-19.
[7]施跃坚, 陈海云. 绞股蓝体外抗活性氧自由基的研究[J]. 云南民族大学学报: 自然科学版, 2008, 17(3): 241-249.
[8]文镜, 刘璇, 赵建. 荧光法及化学发光法在保健食品抗氧化体外实验中的应用[J]. 中国酿造, 2009(11): 130-133.
[9]杨芬, 张瑞萍, 贺玖明, 等. 羟自由基的产生、捕集及检测方法[J].药学学报, 2007, 42(7): 692-697.
[10]陈培榕, 李景虹, 邓勃. 现代仪器分析试验与技术[M ]. 北京: 清华大学出版社, 2006.
[11]丛建波, 孙存普, 莫简. 自旋捕集短寿命自由基的低温保存[J]. 生物化学与生物物理进展, 1993, 20(4): 326-327.
[12]程宏英, 曹玉华. 毛细管电泳-电化学检测法测定硫酸铜-维生素C反应体系中的羟基自由基和菊花的抗氧化活性[J]. 2007, 25(5): 681-685.
[13]ONO R, ODA T. Measurement of hydroxyl radicals in pulsed corona discharge[J]. Journal of Electrostatics, 2002, 55: 333-342.
[14]SAYWELL L G, CUNNINGHAM B B. Determination of iron: Colorimetric o-phenanthroline method[J]. Analytical chemistry, 1937, 9(2): 67-69.
[15]TAMURA H, GOTO K, YOTSUYANAGI T, et al. Spectrophotometric determination of iron(II) with 1,10-phenanthroline in the presence of large amounts of iron(III)[J]. Talanta, 1974, 21(4): 314-318.
[16]金鸣, 菜亚欣, 李金容, 等. 邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的自由基[J]. 生物化学与生物物理进展, 1996, 23(6): 553-555.
[17]贾之慎, 部建敏, 唐孟成. 比色法测定Fenon反应产生的经自由基[J].生物化学与生物物理进展, 1996, 23(2): 184-186.
[18]蒋企洲, 赵文锋, 张远荣. 分光光度法检测马齿苋多糖的抗氧化活性[J]. 淮海医药, 2009, 27(4): 335-336.
[19]李益新, 方允中. 超氧化物歧化酶活力测定的新方法: 化学发光法[J]. 生物化学与生物物理进展, 1983, 28(3): 59-62.
Determination of Antioxidant Capacity of Healthcare Foods by Phenanthroline-Fe2+Method
LIU Wei,WANG Hong-jun,ZHAO Jian,WEN Yue,WEN Jing*
(Beijing Key Laboratory of Bioactive Substances and Functional Foods, College of Arts and Science, Beijing Union University, Beijing 100191, China)
Purpose: To develop a phenanthroline-Fe2+method for determining the antioxidant capacity of healthcare foods. Methods: Trolox was used as the
ubstance for antioxidant capacity assessment. Some key determination conditions such as hydrogen peroxide amount, color development time, solvent type, etc were optimized. Method figures of merits including linearity, limit of detection, precision, repeatability and spike recovery were investigated. Results: The developed method presented good linearity when trolox concentration varied from 0.01 to 0.15g/L, with a limit of detection of 0.0050 g/L, a parallel precision (375 ± 12) μmol/g (3.2% variation coefficient), a repeated precision of (365 ± 16) μmol/g (4.4% variation coefficient), and an average spike recovery of (98.0 ± 2.4)% (n = 5). Conclusions: This method is applicable to the determination of antioxidant capacity of healthcare foods.
healthcare foods;antioxidant capacity;phenanthroline- Fe2+method
TS207.3
A
1002-6630(2010)18-0333-05
2010-05-24
北京市教委科技发展计划项目(KM201011417006);北京市教委重点实验室引导基金项目(21202543503)
刘薇(1986—),女,助理工程师,学士,主要从事保健食品功能评价研究。E-mial:liuwei4465@sina.com
*通信作者:文镜(1952—),男,教授,学士,主要从事保健食品功能学评价机理和方法学研究。E-mail:wenjing@ygi.edu.cn
