白芨多糖BSPI-A的分离纯化及结构研究
2010-03-23黄琳娟王仲孚
王 博,徐 莎,黄琳娟,王仲孚*
(西北大学生命科学学院,西部资源生物与现代生物技术省部共建教育部重点实验室,陕西省生物技术重点实验室,陕西 西安 710069)
白芨多糖BSPI-A的分离纯化及结构研究
王 博,徐 莎,黄琳娟,王仲孚*
(西北大学生命科学学院,西部资源生物与现代生物技术省部共建教育部重点实验室,陕西省生物技术重点实验室,陕西 西安 710069)
从白芨[Bletilla striata (Thunb.) Reichb.f.]块茎中提取出粗多糖(crude Bletilla striata polysaccharide,CBSP),然后经DEAE-cellulose柱层析分离得到BSPI、BSPII两个多糖组分。BSPI过Bio-Gel P-300柱层析纯化后得到组分BSPI-A。高效凝胶渗透色谱法(HPGPC)测得BSPI-A的分子质量大于4.0×105D。经IR、GC、GC-MS、甲基化等方法对该多糖的结构进行表征。结果表明:BSPI-A为直链多糖,主要由β(1,4)甘露糖和β(1,4)葡萄糖组成,其物质的量比为8.09:1。
白芨;多糖;分离纯化;结构解析
白芨[1][Bletilla striata (Thunb.) Reichb. f .]是兰科白芨属,多年生草本植物,有收敛止血、清热利湿、消肿生肌之功效。其药用成分为富含的白芨胶质, 主要由大分子多糖组成。白芨多糖胶具有特殊的黏度特性,其理化性质与阿拉伯胶、西黄耆胶类似,可广泛应用于食品[2]、医药[3-4]、化妆[5]等各领域。据文献[6]报道,白芨多糖的化学组成为葡萄甘露聚糖,但目前对其精确结构尚未阐明。因此,本实验以白芨块茎为研究对象,提取其中的多糖成分,利用离子交换柱层析及凝胶柱层析进行分离纯化,得到了多糖组分BSPI-A,并对其理化性质及结构进行较为系统的研究,旨在为白芨胶多糖的进一步开发与利用提供依据。
1 材料与方法
1.1 材料与试剂
白芨[Bletilla striata (Thunb.) Reichb. f .]购于西安市万寿路中药材批发市场,经鉴定为兰科白芨属白芨的块茎。
鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖(分析纯) 上海国药集团;葡萄糖醛酸、半乳糖醛酸、蓝色葡聚糖、鸡蛋白蛋白、二甲基亚砜(DMSO)(分析纯) Sigma公司;碘甲烷(分析纯)北京化学试剂公司;DOWEX 50WX8-200离子交换树脂
Aldrich公司;DEAE-纤维素 上海恒信化学试剂有限公司;Bio-Gel P-300 Bio-Rad公司;葡聚糖分子质量标准品(优级纯) Fluka公司;其余试剂均为国产分析纯。
1.2 仪器与设备
Waters 2695型高效液相色谱仪(配置2414示差折光检测器) 美国Waters公司;Shimadzu GC2010型气相色谱仪(采用FID检测器)、Shimadzu GC-MS-QP2010型气质联用仪(采用电子轰击(EI)离子源) 日本Shimadzu公司;Perkin Elmer Lambda 25 UV-VIS型紫外分光光度计美国Perkin Elmer公司;Bruker EQUINOX 55型傅里叶红外光谱仪 德国Bruker公司。
1.3 方法
1.3.1 BSPI-A的分离与纯化[7]
白芨块茎烘干(50℃),粉碎后过筛,70℃热水提取4h,提取过程中以1mol/L NaOH溶液调节pH值至中性。将提取液10000r/min离心10min,残渣用70℃热水重复提取4h,合并两次提取液,浓缩,乙醇沉淀,加Sevag试剂(二氯甲烷与正丁醇的体积比为4:1)除去游离蛋白质,透析,冷冻干燥,得到棕色白芨粗多糖CBSP。
CBSP过DEAE-Cellulose柱(HCO3-型),依次用蒸馏水和0.05、0.10、0.25、0.50mol/L NaHCO3溶液梯度洗脱,隔管检测A490nm(苯酚-硫酸法),合并单一峰,由蒸馏水和0.05mol/L NaHCO3溶液洗脱得到BSPI、BSPII两个多糖组分。BSPI经Bio-Gel P-300凝胶柱色谱纯化,以0.1mol/L NaCl溶液等度洗脱,得到纯化的白色絮状多糖BSPI-A。
1.3.2 糖含量与蛋白质含量测定
糖含量和蛋白质含量的测定依据苯酚-硫酸法[8-9]和Bradford法[10]进行。分别以葡萄糖和鸡蛋白蛋白为标准品,绘制标准曲线,计算样品糖与蛋白质含量。
1.3.3 BSPI-A的纯度与分子质量测定
采用高效凝胶渗透色谱法[11-13](HPGPC)对BSPI-A进行纯度及分子质量测定。色谱条件为:TSK-Gel G4000SW色谱柱(7.5mm×300mm),流动相为磷酸盐缓冲液(0.02mol/L,pH6.0),标准品及样品质量浓度均为2mg/mL),进样量20μL,流速0.5mL/min,柱箱温度和检测器温度均为30℃。
先将Dextran标准品5.2、11.6、25、48.6、80kD和164kD按分子质量由小到大顺序依次进样,然后对样品进样,测定保留时间。以lgMw(分子质量对数)对tR(保留时间)绘制标准曲线,根据线性回归方程计算样品的相对分子质量。
1.3.4 BSPI-A的单糖组成分析
取2mg样品,加入2mL 2mol/L TFA,密闭,121℃水解2h,减压抽干。按照Lehrfeld[14]的方法通过气相色谱同时检测中性糖和糖醛酸[12]。色谱柱为rtx-50柱(30.0m× 0.25mm,0.25μm)。程序升温条件为:180℃(2min)→6℃/min,210℃→0.3℃/min,215℃→6℃/min,240℃(30min)。
1.3.5 BSPI-A的紫外(UV)光谱和红外(IR) 光谱分析
将样品溶于水,质量浓度为10mg/mL,于波长200~400nm之间进行紫外扫描。红外光谱检测时,样品用KBr压片,于4000~400cm-1范围内进行扫描。
1.3.6 BSPI-A的甲基化分析[15]
由于BSPI-A难溶于DMSO,故先将其乙酰化(吡啶-乙酸酐)[16],然后甲基化采用Needs等[17]的方法。甲基化样品经水解、还原、乙酰化,制备部分甲基化的糖醇乙酰酯衍生物,进行GC与GC-MS分析。GC-MS色谱柱为rtx-5ms柱(30.0m×0.25mm,0.25μm),程序升温条件:140℃(2min)→150℃(0.2℃/min)→240℃(12℃/ min,10min)。
2 结果与分析
2.1 BSPI-A的分离纯化

图1 CBSP经DEAE-纤维素柱(30cm×5cm)色谱的分离图Fig.1 Elution profile of CBSP on DEAE-cellulose column (30 cm×5 cm)
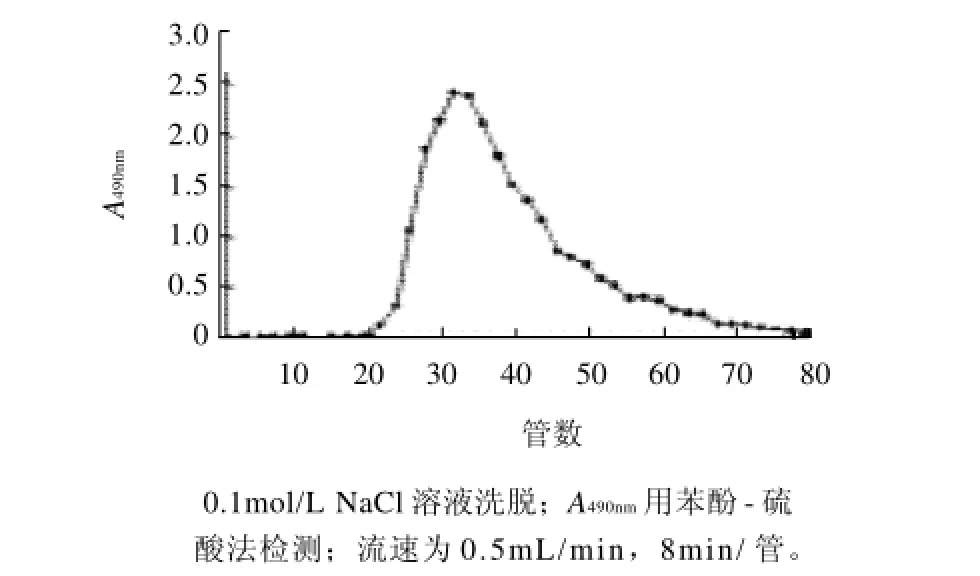
图2 BSPI经Bio-Gel P-300柱(110cm×1.7cm)色谱的分离图Fig.2 Elution profile of BSPI on Bio-Gel P-300 column (110 cm× 1.7 cm)
经热水提取、醇沉、Sevag法脱蛋白、透析得白
芨粗多糖(CBSP),得率为16.20%。粗多糖呈棕色蓬松状,水溶液黏度较大。CBSP经DEAE-cellulose柱层析分离得到BSPI、BSPII两个组分,结果如图1所示。BSPI经Bio-Gel P-300柱纯化,收集20~48管,结果如图2所示,然后再经Bio-Gel P-300进一步纯化,得到组分BSPI-A,结果如图3所示。
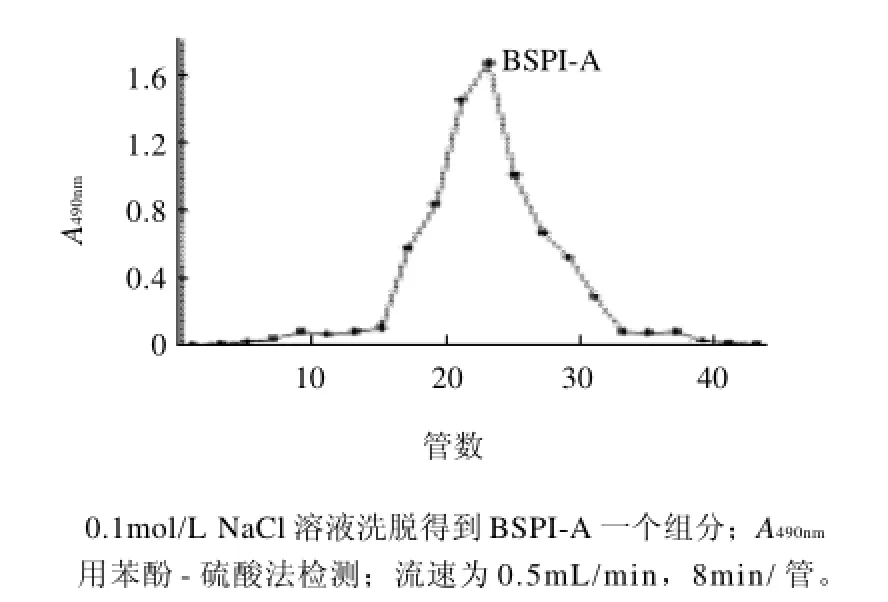
图3 22~48管经Bio-Gel P-300柱(110cm×1.7cm)色谱的分离图Fig.3 Elution profile of pooled fractions 22 through 48 (shown in Fig. 2) on Bio-Gel P-300 column (110 cm×1.7 cm)
2.2 糖含量与蛋白含量测定
苯酚-硫酸法测得CBSP、BSPI-A的糖含量分别为76.52%、92.31%。依据Bradford法测得CBSP的蛋白含量为0.11%。
2.3 BSPI-A纯度及分子质量测定

图4 BSPI-A的HPGPC图Fig.4 HPGPC profile of BSPI-A on TSK-Gel G4000SW column
均一性及分子质量测定采用高效凝胶渗透色谱法(HPGCP)进行分析,色谱柱为TSK-Gel G4000SW柱。将系列葡聚糖标准品 5.2、11.6、25、48.6、80kD和164kD分别用磷酸盐缓冲液(0.02mol/L,pH6.0)配成质量浓度为2mg/mL的溶液,测定保留时间。根据保留时间及分子质量对数,得到线性回归方程:lgMw=7.12996-0.11596tR,R=0.9996。
BSPI-A在HPLC上的保留时间为13.1220min(图4),已超过线性范围,其被凝胶柱排阻,故其分子质量大于4.0×105D。
2.4 BSPI-A单糖组成分析
样品经2mol/L TFA水解后,按1.3.4节的方法进行衍生,然后进行气相色谱分析。标准单糖混合物按同样的方法进行衍生并进行GC分析。将样品的图谱与标准图谱进行对照,根据保留时间推断其衍生物类型。标准单糖混合物的气相色谱图如图5A所示。
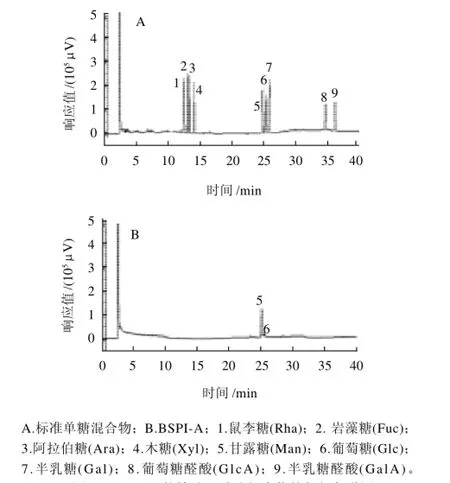
图5 BSPI-A的糖醇乙酸酯衍生物的气相色谱图Fig.5 Gas chromatograms of alditol acetate derivatives of BSPI-A (A, mixed monosaccharide standards; B, BSPI-A)
样品按1.3.4节方法衍生后,进行气相色谱(GC)分析,结果如图5B所示。BSPI-A由甘露糖和葡萄糖组成,其物质的量比为8.09:1。
2.5 BSPI-A的紫外(UV)光谱和红外(IR)光谱检测
紫外分析结果表明:BSPI-A在波长260nm和280nm处均无明显吸收,说明该多糖不含糖蛋白、多肽和核酸。这与比色法测定蛋白含量的结果一致。
红外光谱中,BSPI-A有多糖特征吸收峰,3600~3200cm-1处的吸收峰为O-H的伸缩振动;2925cm-1处有中强吸收,表示有糖类-CH2或-CH3的C-H伸缩振动;877cm-1处有弱吸收,表明有β-D-型葡萄吡喃糖与β-D-型甘露吡喃糖存在;未显示有羧基的存在,这与气相色谱的结果一致。
2.6 BSPI-A甲基化分析
BSPI-A经乙酰化处理,然后甲基化3次,得到完全甲基化的多糖。经酸水解、还原及乙酰化,生成部分甲基化的糖醇乙酸酯衍生物,对其进行GC与GC-MS
分析,总离子流图(TIC)如图6所示, 色谱分析柱为rtx-50ms,质谱电离方式为EI源。
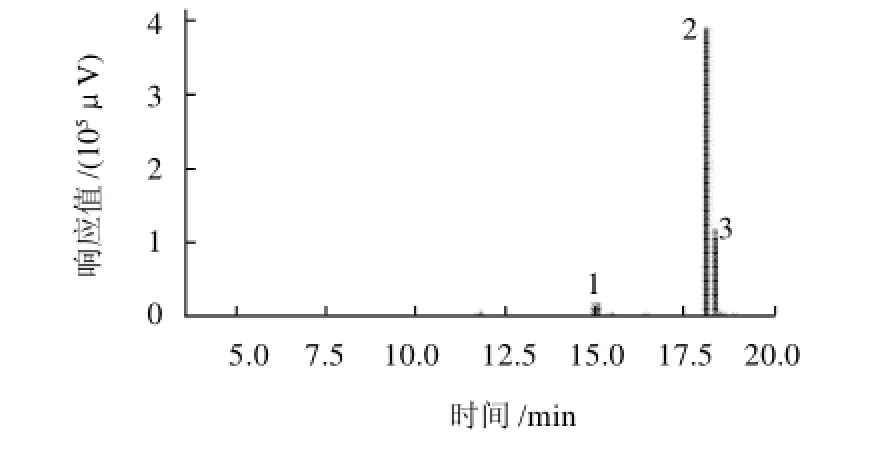
图6 BSPI-A部分甲基化糖醇乙酸酯的TIC图Fig.6 TIC chromatogram of partially methylated alditol acetates of BSPI-A
图6 中1~3号峰相应的质谱图如图7A~C所示。
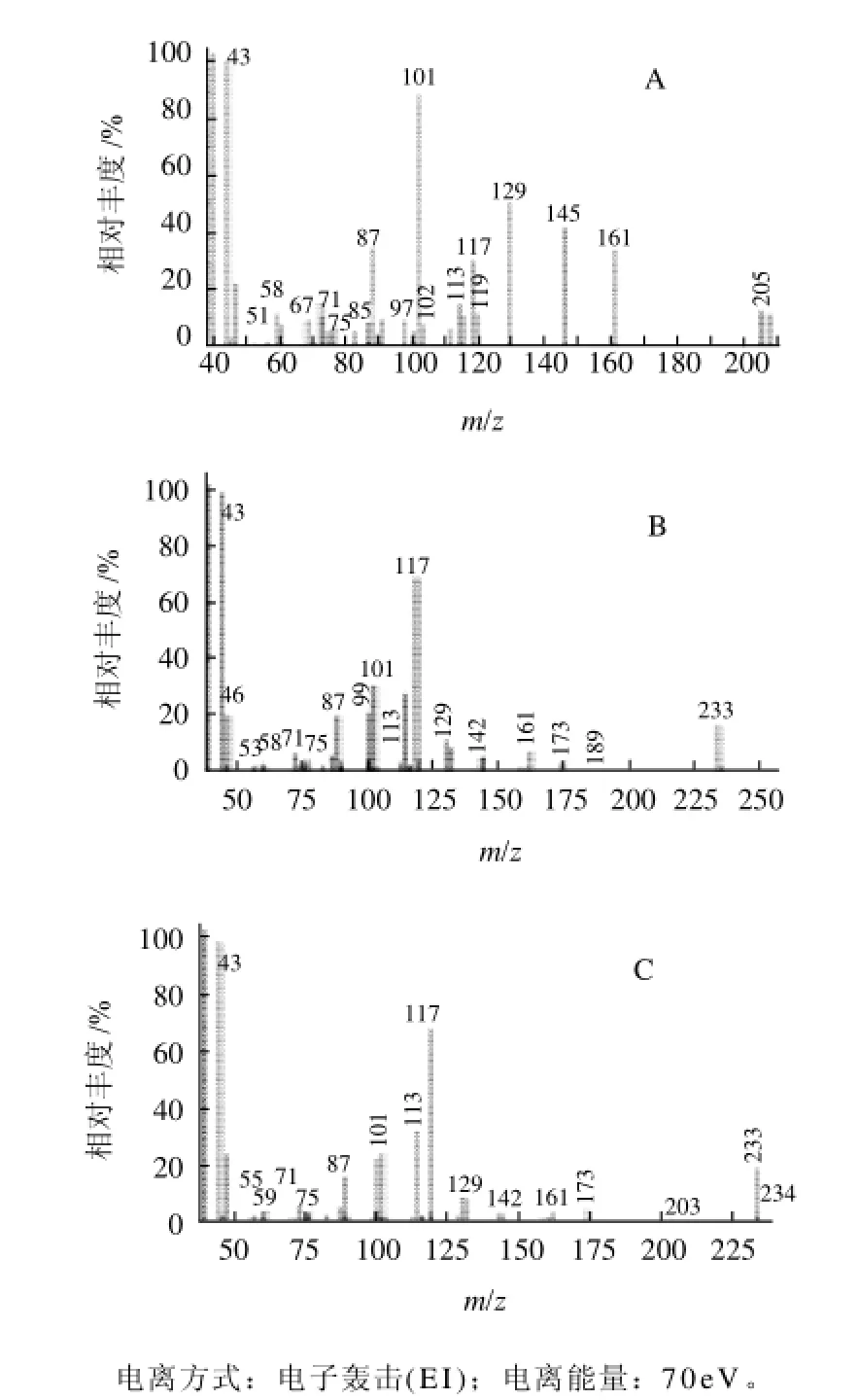
图7 BSPI-A部分甲基化糖醇乙酸酯的质谱图Fig.7 Mass spectra of partially methylated alditol acetates of BSPI-A

表1 BSPI-A的甲基化分析结果Table 1 Methylation analysis of BSPI-A
结合标准图谱及GC分析结果对图6中各峰分别进行归属,并计算该连接方式占总连接方式的相对物质的量比[18-19],如表1所示。
由表1可见,BSPI-A为直链多糖,甲基化的BSPI-A中-4)Man(1-含量很高,占总糖量的89.2%,Man与Glc相对物质的量比约为8.09:1,这与糖组成分析结果一致。Man的糖环构型为吡喃型,这与红外光谱所得结果一致。糖链的非还原末端由Glc构成,占总糖量的2.43%。
3 结 论
本研究通过一系列的分离纯化方法从白芨块茎中提取到一种多糖BSPI-A,并对其理化性质及结构进行了较为系统的研究。BSPI-A是一种直链多糖,分子质量大于4.0× 105D,主要由甘露糖和葡萄糖组成,其物质的量比为8.09:1,连接方式为1,4-连接。由于BSPI-A中含有丰富的邻位顺式羟基,如甘露糖中的C2、C3羟基,这些羟基可与络合剂中的过渡金属离子交联形成高黏弹性冻胶[20],具有特殊的物理、化学性能,从而具有广泛的应用前景。
[1] 雷载权. 中药学[M]. 上海: 上海科学技术出版社, 1995: 78-92.
[2] 何海领, 顾龚平, 张卫明. 白芨多糖胶涂膜保鲜樱桃番茄的研究[J].食品科学, 2004, 25(4): 336-339.
[3] 徐花荣. 白芨多糖的提取分离及其在中药水凝胶巴布剂型中的应用[D]. 西安: 西北大学, 2006.
[4] DONG Lei, XIA Suhua, LUO Yi, et al. Targeting delivery oligonucleotide into macrophages by cationic polysaccharide from Bletilla striata successfully inhibited the expression of TNF-α[J]. Journal of Controlled Release, 2009, 134(3): 214-220.
[5] 马世宏, 金玲, 王守香, 等. 中药白芨在牙膏中的应用[J]. 中国野生植物资源, 2009, 28(3): 33-35.
[6] 芮海云, 吴国荣, 陈景耀, 等. 白芨中性杂多糖的分离纯化与结构解析[J]. 安徽农业大学学报, 2004, 31(1): 30-33.
[7] 方积年, 丁侃. 天然药物: 多糖的主要生物活性及分离纯化方法[J].中国天然药物, 2007, 5(5): 340-344.
[8] 林颖, 吴毓敏, 吴雯, 等. 天然产物中的糖含量测定方法正确性的研究[J]. 天然产物研究与开发, 1996, 8(3): 5-9.
[9] 董群, 郑伊丽, 方积年. 改良的苯酚-硫酸法测定多糖和寡糖含量的研究[J]. 中国药学杂志, 1996, 31(9): 551-552.
[10] BRADFORD M M. A rapid and sensitive method for the quantification of protein using the principle of protein-dye binding[J]. Anal Biochem, 1976, 72: 48-54.
[11] ZHU Hongwei, ZHANG Yunyi, ZHANG Jianwen, et al. Isolation and characterization of an anti-complementary protein-bound polysaccharide from the stem barks of Eucommia ulmoides[J]. International Immunopharmacology, 2008, 8(9): 1222-1230.
[12] 张惟杰. 糖复合物生化研究技术[M]. 2版. 杭州: 浙江大学出版社, 1994: 63-65.
[13] 魏远安, 方积年. 高效凝胶渗透色谱法测定多糖纯度及分子量[J]. 药学学报, 1989, 24(7): 532-536.
[14] LEHRFELD J. Simultaneous gas-liquid chromatographic determination of aldonic acids and aldoses[J]. Anal Chem, 1985, 57: 346-347.
[15] WANG Zhongfu, HE Yuan, HUANG Linjuan. An alternative method for the rapid synthesis of partially O-methylated alditol acetate standards for GC-MS analysis of carbohydrates[J]. Carbohydrate Research, 2007, 342: 2149-2151.
[16] ADAMS G A. Complete acid hydrolysis[J]. Methods Carbohyd Chem, 1965, 5: 269-280.
[17] NEEDS P W, SWLVENDRAN R R. Avoiding oxidative degradation during sodium hydroxide/methyl iodide-mediated carbohydrate methylation in dimethyl sulfoxide[J]. Carbohydr Res, 1993, 245: 1-10.
[18] JASSON P E, KENNE L, LIEDGREN H, et al. A practical guide to the methylation analysis of carbohydrates[J]. Chem Commun Univ Stockholm, 1976, 8: 1-75.
[19] BIERMANN C J, MCGINNIS G D. Analysis of carbohydrates by GLC and MS[M]. Boca Raton: CRC Press Inc, 1989: 210.
[20] 张洁, 费砚良, 刘金鉴, 等. 新经济作物: 瓜尔豆[M]. 北京: 科学出版社, 1987: 53-64.
Isolation, Purification and Structural Characterization of a Polysaccharide Fraction from Stem Tuber of Bletilla striata, Named BSPI-A
WANG Bo,XU Sha,HUANG Lin-juan,WANG Zhong-fu*
(Key Laboratory of Resource Biology and Biotechnology in Western China, Ministry of Ed,ucation, Shaanxi Provincial Key Laboratory of Biotechnology, College of Life Science, Northwest University, Xi an 710069, China)
The crude polysaccharide extract, named CBSP, from the stem tubers of Bletilla striata was purified/fractionated by DEAE-cellulose column chromatography, and two fractions were obtained and they were named BSPI and BSPII. BSPI was further purified by Bio-Gel P-300 column chromatography, and a sub-fraction was obtained and it was named BSPI-A. HPGPC analysis showed that the molecular weigh of BSPI-A was more than 4.0 × 105D. By means of IR spectroscopy, gas chromatography (GC), GC coupled to mass spectrometry (GC-MS) and methylation analysis, the polysaccharide fraction was characterized structurally, and the results indicated that BSPI-A was a linear polysaccharide and that the backbone was composed of 1,4-linked mannose (Man) and 1,4-linked glucose (Glc), with a molar ratio of 8.09:1.
Bletilla striata;polysaccharide;isolation and purification;structural characterization
O629.12
A
1002-6630(2010)17-0120-04
2009-12-25
“十一五”国家科技支撑计划项目(2006BAD06B00);教育部新世纪优秀人才支持计划项目(NCET-08-0893);陕西省科技研究发展计划项目 [2007K16-06(3)]
王博(1986—),男,硕士研究生,研究方向为植物多糖的分离提取与结构解析。E-mail:wangbo12399@126.com
*通信作者:王仲孚(1971—),男,教授,博士,研究方向为糖生物学与糖工程学。E-mail:wangzhf@nwu.edu.cn
