一株黄色短杆菌基因工程菌株的构建及其L-缬氨酸积累
2010-03-23徐大庆谭延振王小元
徐大庆,谭延振,缪 铭,王小元,*
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2. 河北农业大学生命科学学院,河北 保定 071001)
一株黄色短杆菌基因工程菌株的构建及其L-缬氨酸积累
徐大庆1,2,谭延振1,缪 铭1,王小元1,*
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2. 河北农业大学生命科学学院,河北 保定 071001)
从谷氨酸棒杆菌模式菌株C. glutamicum ATCC13032中克隆出L-缬氨酸合成途径上的限速酶——乙酰羟酸合酶编码基因ilvBN。对ilvBN进行定点突变,获得其抗反馈抑制突变型ilvBNr。以大肠杆菌-黄色短杆菌穿梭表达载体pDXW-10为基础,构建重组质粒pDXW-10-ilvBNr,并转化野生型黄色短杆菌B. flavum ATCC14067,获得工程菌株ATCC14067/pDXW-10-ilvBNr。3L罐发酵实验结果显示:在野生型菌株发酵液中检测不到L-缬氨酸积累,而工程菌株发酵液中L-缬氨酸积累达5.0g/L。
乙酰羟酸合酶;抗反馈抑制;黄色短杆菌;发酵;L-缬氨酸
L-缬氨酸属于中性氨基酸,与L-异亮氨酸、L-亮氨酸一起称为支链氨基酸,是人体必需的氨基酸之一。L-缬氨酸广泛应用于医药、食品、饲料、化妆品等领域。工业上主要是通过应用棒状杆菌发酵来生产L-缬氨酸,而选育优良的生产菌株是实现L-缬氨酸高效生产的关键。自Nakayama等[1]首先于1961年选育了氨基酸缺陷型的L-缬氨酸生产菌以来,人们在棒状杆菌产L-缬氨酸诱变育种方面进行了大量的研究并取得了显著的成绩[2]。但传统的诱变育种方式工作量大、周期长,且引起的遗传变异在染色体上是随机分配的,一些与氨基酸生物合成无直接关联的区域也会被突变,因此可能会对细胞生理产生不可预知的负面效应。代谢工程是在对代谢网络系统分析的基础上采用基因工程技术定向改造细胞代谢系统以提高产物得率或改进细胞性能[3]。由于关于谷氨酸棒状杆菌生理学、生物化学和遗传学知识的大量累积[4-5],基于理性设计的代谢工程育种正在成为氨基酸高产菌株选育的主要方式[6]。
虽然国内选育的L-缬氨酸生产菌种较多,但它们均是通过随机诱变和定向筛选的方法获得的[2],其产酸水平有待于进一步提高。另外,传统诱变育种获得的L-缬氨酸高产菌株副生杂酸比较多,尤其是副生L-Leu、L-Ileu、L-Met等,这对后提取高纯度L-Val
造成很大的困难。过表达生物合成或降解途径的限速酶是对菌株进行代谢工程改造的主要策略之一。而由ilvBN基因编码的乙酰羟酸合酶(AHAS)是棒状杆菌L-缬氨酸合成途径上的限速酶。本实验通过定点突变技术获得AHAS抗反馈抑制突变型编码基因ilvBNr,然后通过在黄色短杆菌中过表达ilvBNr基因,初步构建过量积累L-缬氨酸的基因工程菌株,并在3L罐发酵水平上对其产L-缬氨酸能力进行检测。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和表达载体
大肠杆菌E. coli JM109、谷氨酸棒杆菌模式菌株C. glutamicum ATCC13032、黄色短杆菌野生型菌株B. flavum ATCC14067以及质粒pUC57由本实验室保藏;E.coli-B. flavum穿梭表达载体pDXW-10,大小为8351bp,是由本实验室构建的适合于棒状杆菌代谢工程研究的组成型表达载体[7]。
1.1.2 试剂
限制性内切酶、T4 DNA 连接酶、DNA Marker、ATP、质粒小量制备试剂盒 上海生工生物工程服务有限公司; PrimeSTAR HS DNA聚合酶 大连宝生物公司;引物合成及测序由上海生工生物工程服务有限公司完成;琼脂糖凝胶DNA回收试剂盒、基因组提取试剂盒 北京天根生化科技有限公司;酵母粉、胰蛋白胨Oxoid公司;其他生化试剂均为国产或进口分析纯。
1.1.3 培养基
大肠杆菌LB培养基参照文献[8]配制;黄色短杆菌斜面培养基:LB培养基+0.5%葡萄糖;黄色短杆菌种子培养基(g/L):葡萄糖 25、尿素 1.25、玉米浆 20、KH2PO41、MgSO45,pH 7.0;黄色短杆菌发酵培养基(g/L):葡萄糖150、(NH4)2SO435、玉米浆20、KH2PO41、MgSO41。
1.2 方法
1.2.1 DNA的提取和纯化
DNA的提取和纯化均按相应试剂盒说明书进行。DNA片段的酶切和连接以及大肠杆菌感受态细胞的制备及转化等操作均按文献[8]方法进行;黄色短杆菌感受态的制备和转化按文献[9]方法进行。
1.2.2 PCR扩增野生型ilvBN基因
依据谷氨酸棒杆菌C. glutamicum ATCC13032 ilvBN基因序列[10],设计正向引物ilvBN-F(5'- actagaattcgaaagg acatgaacgatgaatgtggcagcttctcaac-3',下划线部分为引入EcoRI位点)和反向引物ilvBN-R(5'- actaaagcttttagatc ttggccggagccatggtcttcg-3',下划线部分为引入HindIII位点)。以C. glutamicum ATCC13032基因组DNA为模板,ilvBN-F和ilvBN-R 为引物扩增ilvBN。反应体系为50μL,包括10μL 5×Primer STAR buffer (Mg2+plus),4μL dNTP 混合物(各2.5mmol/L),1μL基因组模板,1μL正向引物ilvBN-F(20μmol/L),1μL反向引物ilvBN-R(20 μmol/L),0.5μL Prime STAR HS DNA Polymerase。 PCR反应条件为:94℃预变性5min;然后在以下条件下进行35 轮循环:94℃变性30s,60℃退火15s,72℃延伸2.5min;最后一个循环完成后72℃再延伸10min;4℃保存。扩增产物为2428bp。
1.2.3 ilvBN基因的定点突变
将野生型基因ilvBN的 PCR产物用EcoRI和HindIII双酶切,连接到同样用EcoRI和HindIII双酶切的克隆载体pUC-57上,构建成重组质粒pUC57-ilvBN。以pUC57-ilvBN为模板,使用携带突变位点的一对完全互补的引物p-F(5'-g t t c a g g a c g t a g a c g A T G A c Ttttcccgcgtatcagg-3')和p-R(5'-cctgatacgcgggaaa AgTCATcgtctacgtcctgaac-3'),其中大写碱基为引入的突变位点,将ilvN上编码别构中心上3个氨基酸Gly-Ile-Ile的核苷酸ggaatcatt定点突变成gatgacttt(编码Asp-Asp-Phe)。对质粒进行PCR扩增。反应体系为50μL,包括10μL 5×Primer STAR buffer (Mg2+plus),4μL dNTP混合物(各2.5mmol/L),4μL质粒pUC57-ilvBN(100ng/μL)模板,1μL正向引物p-F(20μmol/L),1μL反向引物p-R (20μmol/L),0.5μL Prime STAR HS DNA Polymerase。反应程序:94℃预变性5min;然后在以下条件下进行30 轮循环:94℃变性30s,60℃退火15s,72℃延伸5.5min;72℃再延伸10min;10℃保存。扩增产物直接用1μL DpnI内切酶37℃消化1h。取20μL消化产物转化大肠杆菌感受态细胞。挑选转化子,扩繁培养,提取质粒,测序,突变的重组质粒命名为pUC57-ilvBNr。
1.2.4 重组质粒pDXW-10-ilvBNr的构建及转化
以质粒pUC57-ilvBNrDNA为模板,扩增突变型基因ilvBNr,扩增引物及条件同1.2.2节。将ilvBNr和ilvBN PCR产物分别用EcoRI和HindIII双酶切,分别连接到同样用EcoRI和HindIII双酶切的E. coli-B. flavum穿梭表达载体pDXW-10上,构建的重组质粒大小都为10717 bp,分别命名为pDXW-10-ilvBNr和pDXW-10-ilvBN。重组质粒分别转化黄色短杆菌B. flavum ATCC14067,构建成工程菌株ATCC14067/pDXW-10-ilvBNr和ATCC14067/pDXW-10-ilvBN。
1.2.5 工程菌株ATCC14067/pDXW-10-ilvBNr的3L罐发酵
种子液培养:挑一满环新鲜斜面上的菌体接种至种子培养基,在30℃、250r/min条件下培养至对数生长中后期。
上罐发酵:按10%接种量将种子液0.12L接入3L发酵罐中,初始装液量1.2L。通风量200L/h,搅拌转速控制范围为200~950r/min,培养温度30℃。溶氧通过搅拌自动控制在设定值。菌体生长初期及对数生长期溶氧控制在50%,稳定期溶氧控制在30%。流加25% 氨水和2mol/L HCl 以控制pH7.0。每隔2h取样测菌浓度及残糖,根据耗糖速率确定补料量,通过流加质量浓度为80g/100mL的葡萄糖使菌体在进入衰亡期之前糖质量浓度维持在10~15g/L。以ATCC14067/pDXW-10-ilvBN和B.flavum ATCC14067为对照菌株。
1.2.6 菌浓度测定
吸取0.1mL的发酵液,用蒸馏水适当稀释,采用紫外分光光度计测定562nm 波长处的吸光度。
1.2.7 残糖测定
采用DNS法[11]。
1.2.8 氨基酸含量测定
采用高效液相色谱系统(HPLC)自动柱前衍生化法测定。采用Agilent公司1200 series色谱仪。色谱柱:Agilent Eclipse-AAA 柱。流动相水相(1L):4.52g 无水乙酸钠、200μL 三乙胺、5mL 四氢呋喃、pH7.2;有机相(1L):4.52g 无水乙酸钠、400mL 甲醇、400mL 乙腈。色谱条件:柱温40℃,流速1.0mL/min,DAD 检测器。
2 结果与分析
2.1 ilvBN基因的PCR扩增及定点突变
为了获得解除反馈抑制的AHAS[12],实验从谷氨酸棒杆菌模式菌株C. glutamicum ATCC13032基因组上成功地扩增出野生型ilvBN,然后通过定点突变技术将ilvN上编码别构中心上3个氨基酸Gly-Ile-Ile的核苷酸ggaatcatt定点突变成gatgacttt(编码Asp-Asp-Phe)(图1),成功获得了抗反馈抑制的突变型基因ilvBNr。
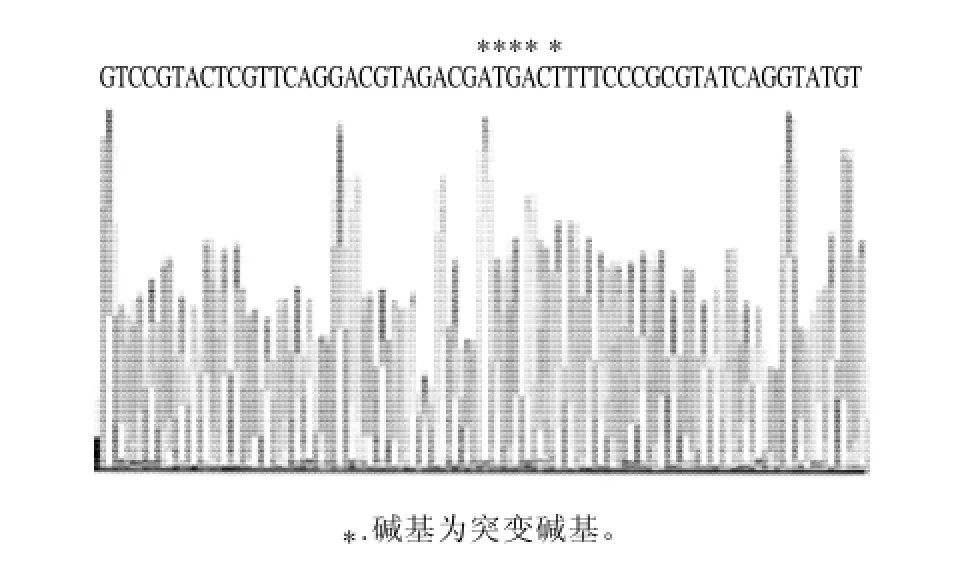
图1 ilvBNr基因定点突变位点及其上下游序列测序图谱Fig.1 Sequencing map showing the site-directed mutagenesis ofilvBNr
2.2 重组质粒ATCC14067/pDXW-10-ilvBN和pDXW-10-ilvBNr的构建及转化黄色短杆菌
黄色短杆菌是工业上用来发酵生产L-缬氨酸的主要菌种之一。通过16S rDNA杂交分析,发现土壤棒杆菌的两个代表种C. glutamicum与B. flavum亲缘关系非常近[13]。笔者将解除反馈抑制的突变型基因ilvBNr异源转化黄色短杆菌B. flavum ATCC14067。ilvBNr的PCR产物用EcoRI和HindIII 双酶切,并连接到同样用EcoRI和HindIII 双酶切的E. coli-B. flavum穿梭表达载体pDXW-10上,连接产物转化大肠杆菌JM109,挑选卡那霉素抗性转化子,提取重组质粒。以重组质粒为模板,ilvBN-F和ilvBN-R 为引物扩增ilvBNr,扩增产物大小为2.4kb,与理论值一致(图2,泳道2);用EcoRI单酶切重组质粒,获得大小为10.7kb片段,与理论值一致(图2,泳道3)。通过单酶切及PCR验证,说明重组质粒构建成功。重组质粒pDXW-10-ilvBNr电转化黄色短杆菌,对得到的转化子中的质粒进行酶切鉴定,片段大小为10.7 kb,说明重组质粒转化成功,获得工程菌株ATCC14067/ pDXW-10-ilvBNr。同样方法,成功获得对照工程菌株ATCC14067/pDXW-10-ilvBN。
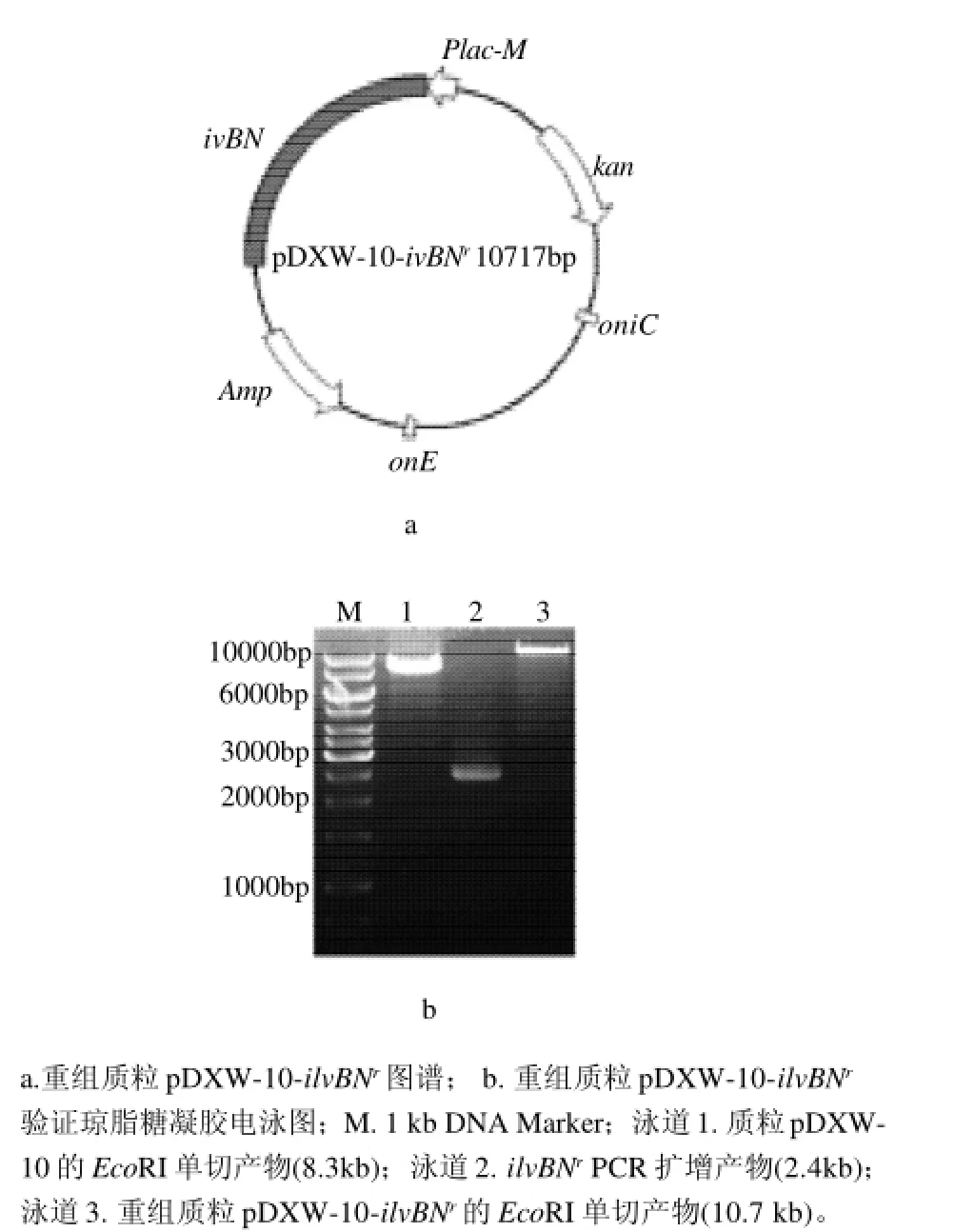
图2 重组质粒pDXW-10-ilvBNr构建结果及其验证Fig.2 Physical map and single enzymatic digestion based identification of recombinant plasmid pDXW-10-ilvBNr
2.3 工程菌ATCC14067/pDXW-10-ilvBNr3L罐发酵水平的L-缬氨酸积累
为了检测工程菌ATCC14067/pDXW-10-ilvBNr产L-缬氨酸的情况,进行了3L罐发酵实验。当发酵时间到达68h后,菌体进入衰亡期。选取72h停止发酵,通过HPLC方法检测发酵液中各种氨基酸的含量。结果显示:在野生型菌株B. flavum ATCC14067发酵液中未检测到L-缬氨酸,工程菌株ATCC14067/pDXW-10-ilvBN发酵液中L-缬氨酸产量为2.85g/L,而工程菌株ATCC14067/ pDXW-10-ilvBNr发酵液中目的产物L-缬氨酸产量达到5.0g/L;另外,相比野生型菌株,工程菌株ATCC14067/ pDXW-10-ilvBN和ATCC14067/pDXW-10-ilvBNr发酵液中L-丙氨酸含量都显著降低,L-异亮氨酸和L-亮氨酸含量显著提高(表1);其他氨基酸含量无显著变化(数据未显示)。
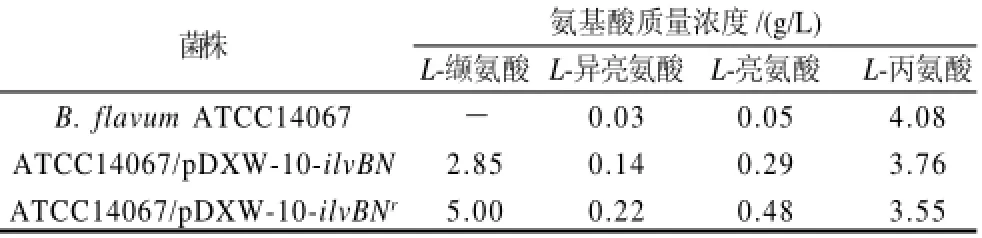
表1 发酵液中L-缬氨酸及其代谢相关氨基酸含量Table 1 Concentrations ofL-valine and its metabolism-related amino acids in fermentation broth of differentB. flavumstrains
3 讨 论
3种支链氨基酸:L-缬氨酸、L-异亮氨酸和L-亮氨酸的生物合成途径是紧密联系的,在棒状杆菌中它们都以图3的方式进行生物合成。异亮氨酸和缬氨酸是由相同酶催化的两条平行的合成途径合成的,而亮氨酸和缬氨酸共用同一前体,是由缬氨酸合成途径中的一条分支反应所合成。 L-缬氨酸是以丙酮酸为底物,通过四步反应转化而成。四步反应依次分别由ilvBN基因编码的乙酰羟酸合酶、ilvC基因编码的乙酰羟酸异构还原酶、ilvD基因编码的二羟酸脱氢酶和ilvE基因编码的转氨酶催化[14]。而由ilvBN基因编码的AHAS是L-缬氨酸合成途径上的第一个酶,是限速酶。C. glutamicum的AHAS全酶由两个ilvB基因编码的大亚基(催化亚基)和两个ilvN基因编码的小亚基(调节亚基)构成。Eggeling等[15]研究发现:3种支链氨基酸都存在的情况下,对AHAS的最大抑制率约为50%。Elisakova等[12]研究结果表明:L-缬氨酸、L-异亮氨酸、L-亮氨酸在AHAS上的结合位点为同一位点,位于小亚基N上。3种支链氨基都可以对AHAS进行单独的反馈抑制作用。将AHAS小亚基别构中心的3个氨基酸Gly-Ile-Ile(20~22位)定点突变成相应的Asp-Asp-Phe,能够完全解除3种支链氨基酸对AHAS的反馈抑制作用。本实验获得了一株过量积累L-缬氨酸的黄色短杆菌基因工程菌株ATCC14067/ pDXW-10-ilvBNr,其产量的提高是通过异源过表达谷氨酸棒杆菌ilvBN基因的抗反馈突变型实现的。在野生型菌株中,AHAS除在活性水平上受反馈抑制外,在合成水平还受到其3个末端产物:L-缬氨酸、L-异亮氨酸和L-亮氨酸的多价阻遏[16],使其不能有效积累L-缬氨酸。在工程菌株ATCC14067/pDXW-10-ilvBN中,使用组成型表达载体pDXW-10表达野生型ilvBN,解除了AHAS合成水平的多价阻遏作用,使其能大量积累L-缬氨酸。而在工程菌株ATCC14067/pDXW-10-ilvBNr中,同时解除了AHAS合成水平的多价阻遏作用及活性水平的反馈抑制作用,使其L-缬氨酸的积累能力进一步大幅度提高。
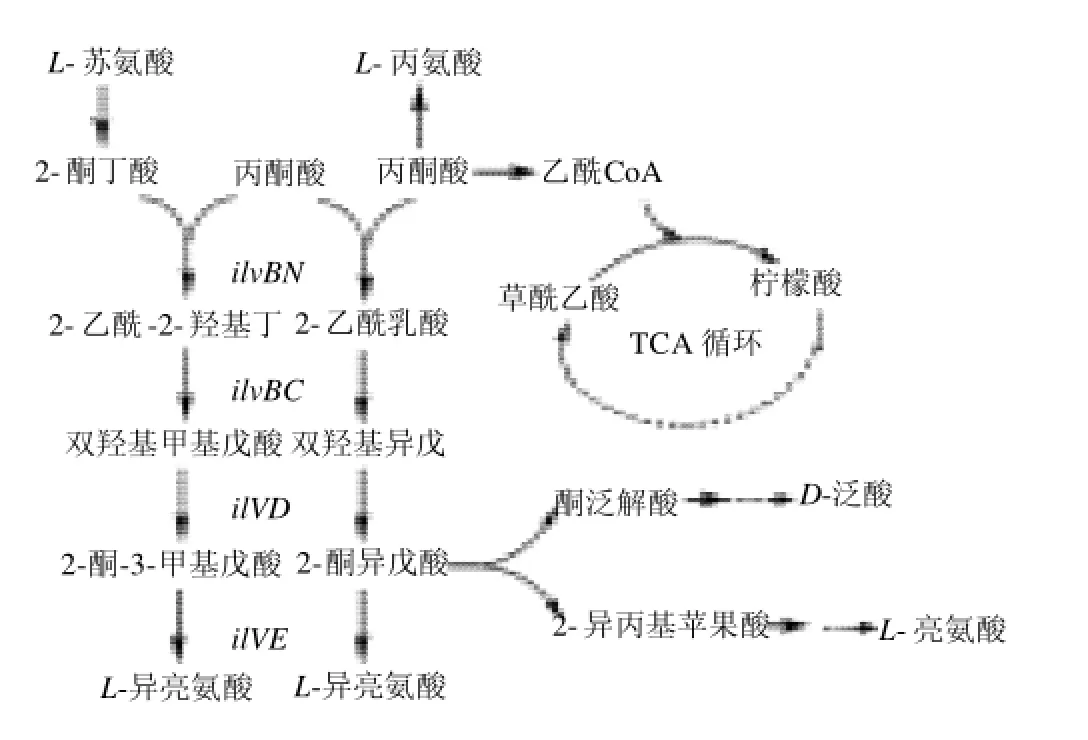
图3 谷氨酸棒杆菌中与L-缬氨酸生物合成相关的代谢途径Fig.3 Metabolic pathways related toL-valine biosynthesis inC. glutamicum
在本实验中发现,工程菌株发酵液中除了L-缬氨酸产量大幅度提高外,L-丙氨酸含量显著降低,这可能是由于过表达抗反馈抑制的AHAS使更多的丙酮酸用于L-缬氨酸的生物合成,进而减少了用于L-丙氨酸转化的丙酮酸的量造成的。可见,在工程菌株中,丙酮酸的供给是相对不足的,增加前体物质丙酮酸供给是提高L-缬氨酸产量的另一关键。另外,工程菌发酵液中L-异亮氨酸和L-亮氨酸含量也都有显著提高,这表明由过表达AHAS而增加的碳流一部分被用于L-异亮氨酸和L-亮氨酸的过量合成。因此,在本实验的基础上,为了最终获得高产L-缬氨酸的基因工程菌株,后期的代谢工程改造工作可以从如下两个大的方面开展研究: 1)通过基因工程技术降低丙酮酸到乙酰CoA的代谢流,使糖酵解的终产物丙酮酸大量积累,为L-缬氨酸的生物合成提供充足的底物。乙酰CoA合成量的减少而影响到菌体生长,可以通过在培养基中添加乙酸钠来解决[17];2)降
低苏氨酸到2-酮丁酸的代谢流以减少L-异亮氨酸的合成,降低2-酮异戊酸到2-异丙基苹果酸及酮泛解酸的代谢流以减少L-亮氨酸及D-泛酸的合成,降低丙酮酸到L-丙氨酸的代谢流以减少L-丙氨酸的合成,这些都能使更多的碳流用于L-缬氨酸的生物合成。
[1]NAKAYAMA K, KITADA S, KINOSHITA S. L-valine production using microbial auxotroph[J]. J Gen Appl Microbiol, 1961(7): 52-69.
[2]张伟国, 钱和. L-缬氨酸发酵条件的研究[J]. 氨基酸和生物资源, 2001, 23(3): 28-31.
[3]STEPHANOPULOS G N, ARISTIDOU A A, NIELSEN J. Metabolic engineering: Principle and methodologies[M]. San Diego: Academic Press, 1998.
[4]EGGELING L, BOTT M. Handbook of Corynebacterim glutamicum [M]. Boca Raton: CRC Press, 2005.
[5]BURKOVSKI A. Corynebacteria: Genomics and molecular biology[M]. Norfolk: Caister Academic Press, 2008.
[6]PARK J H, LEE S Y. Fermentative production of branched chain amino acids: a focus on metabolic engineering[J]. Appl Microbiol Biotechnol, 2010, 85: 491-506.
[7]XU Daqing, TAN Yanzhen, SHI Feng, et al. An improved shuttle vector constructed for metabolic engineering research in Corynebacterium glutamicum[J]. Plasmid, 2010, 64(2): 85-91.
[8]萨姆布鲁克J, 弗里奇E F, 曼尼阿蒂斯T. 分子克隆实验指南[M].金冬雁, 黎孟枫, 译. 2版. 北京: 科学出版社, 1998.
[9]XU Daqing, TAN Yanzhen, HUAN Xiaojing, et al. Construction of a novel shuttle vector for use in Brevibacterium flavum, an industrial amino acid producer[J]. J Microbiol Methods, 2010, 80(1): 86-92.
[10]KALINOWSKI J, BATHE B, BARTELS D, et al. The complete Corynebacterium glutamicum ATCC 13032 genome sequence and its impact on the production of L-aspartate-derived amino acids and vitamins[J]. J Biotechnol, 2003, 104: 5-25.
[11]蔡武城, 袁厚积. 生物物质常用化学分析法[M]. 北京: 科学出版社, 1982.
[12]ELISAKOVA V, PATEK M, HOLATKO J, et al. Feedback-resistant acetohydroxy acid synthase increases valine production in Corynebacterium glutamicum[J]. Appl Environ Microbiol, 2005, 71: 207-213.
[13]LIEBL W, EHRMANN M, LUDWIG W, et al. Transfer of Brevibacterium divaricatum DSM 20297T, Brevibacterium flavum DSM 20411, Brevibacterium lactofermenturn DSM 20412 and DSM 1412, and Corynebacterium lilium DSM 20137T to Corynebacteriurn glutamicum and their distinction by rRNA gene restricti on patterns[J]. Int J Syst Bacteriol, 1991, 41: 255-260.
[14]WENDISCH V F. Amino acid biosynthesis: Pathways, regulation and metabolic engineering[M]. Berlin Heidelberg: Springer-Verlag, 2007.
[15]EGGELING I, CORDES C, EGGELING L, et al. Regulation of acetohydroxy acid synthase in Corynebacterium glutamicum during fermentation of alfa-ketobutyrate to L-isoleucine[J]. Appl Microbiol Biotechnol, 1987, 25: 346-351.
[16]MORBACH S, JUNGER C, SAHM H, et al. Attenuation control of ilvBNC in Corynebacterium glutamicum: evidence of leader peptide formation without the presence of a ribosome binding site[J]. J Biosci Bioeng, 2000, 90: 501-507.
[17]SCHREINER M E, FIUR D, HOLTKO J, et al. E1 enzyme of the pyruvate dehydrogenase complex in Corynebacterium glutamicum: molecular analysis of the gene and phylogenetic aspects[J]. J Bacteriol, 2005, 187: 6005-6018.
Construction and L-valine Accumulation of a Genetic Engineering Brevibacterium flavum Strain
XU Da-qing1,2, TAN Yan-zhen1, MIAO Ming1, WANG Xiao-yuan1,*
(1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. College of Life Sciences, Agricultural University of Hebei, Baoding 071001, China)
As a rate-limiting enzyme for L-valine biosynthesis, the ilvBN gene encoding acetyl-carboxylic acid synthase (AHAS) from Corynebacterium glutamicum ATCC13032 was amplified by PCR, followed by site-direct mutagenesis to obtain an ilvBNrgene, the anti-feedback inhibition gene of ilvBN. The ilvBNrgene inserted into E. coli-Brevibacterium flavum shuttle expression vector pDXW-10 to construct a recombinant plasmid pDXW-10-ilvBNr, which was subsequently transformed into B. flavum ATCC14067, producing a genetic engineering strain ATCC14067/pDXW-10-ilvBNr. The fermentation experiments conducted in a 3 L fermentor showed that no L-valine accumulation was detected in the fermentation broth of the original strain, while an L-valine accumulation of 5.0 g/L was observed in the fermentation broth of the constructed engineering strain.
acetyl-carboxylic acid synthase;anti-feedback inhibition;Brevibacterium flavum;fermentation;L-valine
Q851
A
1002-6630(2010)23-0262-05
2010-04-15
国家“863”计划项目(2007AA02Z229;2007AA02Z230)
徐大庆(1972—),男,博士研究生,研究方向为微生物代谢工程。E-mail:daqingxu@yahoo.com.cn
*通信作者:王小元(1964—),男,教授,博士,研究方向为食品安全及微生物代谢工程。E-mail:xiaoyuanwang@hotmail.com
