对饱和溶液性质的补充探究
2010-03-23金国平
■金国平
对饱和溶液性质的补充探究
■金国平
新课程九年级化学教材第34页,通过在一定量的水里溶解NaCl和KNO3的探究活动,得出饱和溶液的概念:“在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,得到的溶液叫做饱和溶液;还能继续溶解的溶液,叫做不饱和溶液。”为了让学生充分理解饱和溶液的概念,以及提高学生学习化学的兴趣和培养学生的探究能力,笔者试着让师生一起共同探宄了有关饱和溶液的性质及运用。
探究一:某溶质的饱和溶液还能溶解其他溶质吗
实验活动程序(如图):

上述实验探究活动表明,一定温度下的某溶质饱和溶液不能溶解这种溶质,但可能溶解其他的溶质。
探究二:KNO3晶体和NaCl晶体结晶的对比
从饱和溶液中析出晶体的方法一般有两种。但不同的溶质选择合适的方法并不一定相同。笔者和学生一起共同探究了KNO3晶体和NaCI晶体结晶的对比。
实验过程如下:
(1)用两支不同的烧杯分别装入50mL80℃的热水,然后在这两支不同的烧杯中,分别加入KNO3固体和Na-Cl固体,并不断地搅拌,直到两支烧杯中都有未溶解的固体为止,静置。
(2)将这两支烧杯中的饱和溶液各取20ml,分别倒入另两支空烧杯中。并贴上标签,注明一杯是KNO3饱和溶液,另一杯是NaCl饱和溶液。
(3)将这两杯20mL的KNO3,饱和溶液和NaCl饱和溶液,同时放入冷水中冷却。
大约2分钟后,拿出这两杯溶液,观察。
现象:KNO3饱和溶液中底部有大量的KNO3晶体析出;NaCl饱和溶液中底部看不到晶体析出。通过对比,说明从饱和溶液中析出晶体,用降温的方法并不一定都有效。这也同时说明了KNO3的溶解性(溶解度)受温度影响较大;而NaCl的熔解性(溶解度)受温度影响较小。
那从NaCl饱和溶液中析出大量的NaCl晶体,用什么方法较为理想呢?于是我又引导学生把没有析出NaCl晶体的20mlNaCl饱和溶液倒入蒸发皿中,用酒精灯加热,大约2分钟后,蒸发皿底部有大量的NaCl晶体析出。那就是说,物质溶解度受温度影响不大的,通常可用蒸发结晶。我们所吃的食盐大多数就是从海水中提炼出来的,人们把海水引入盐田,经过风吹日晒,水逐渐蒸发后,溶液变浓,最后食盐就会结晶析出。
不过,人们从水溶液中提取物质时,通常是将以上两种方法综合起来使用,也就是先通过加热使溶液浓缩(减少水分),再将溶液冷却(降低温度),使溶液中的溶质结晶析出。如提取盐碱湖中的纯碱,就是利用这种原理制得的。
探究三:升高温度也有晶体析出吗请看下面的实验(如图所示):
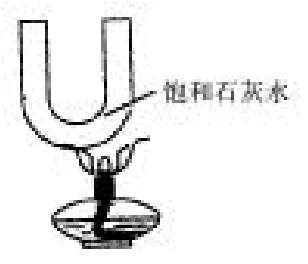
将饱和的石灰水用酒精灯加热,发现石灰水变浑浊。石灰水变浑浊的原因是,饱和石灰水温度升高,有溶质Ca(OH)2析出。
一般来说,大多数固体物质的溶解度是随着温度的升高而增大,随温度的降低而减小。将这些固体的饱和溶液冷却,一般会有晶体析出。但熟石灰Ca(OH)2的溶解度相反,它的溶解度是随温度的升高而减小。所以升高温度,溶液中Ca(OH)2溶质减少而析出。
以上实验的探究,有助于学生对饱和溶液和溶解度的理解。教师在教学中,可以不拘泥于教材中的实验,自行挖掘设计探究案例,提高学生的探究能力。
(作者单位:武汉市第二十八中学)
责任编辑 王爱民
