抗黄曲霉毒素B1单链抗体的表达载体的比较
2010-03-22刘自琴陈海琴
杨 炼,刘自琴,刘 蓉,陈海琴,陈 卫,张 灏*
(江南大学食品学院,食品科学与技术国家重点实验室,江苏 无锡 214122)
抗黄曲霉毒素B1单链抗体的表达载体的比较
杨 炼,刘自琴,刘 蓉,陈海琴,陈 卫,张 灏*
(江南大学食品学院,食品科学与技术国家重点实验室,江苏 无锡 214122)
目的:比较4种不同的pET载体在表达抗黄曲霉毒素B1(AFB1)的单链抗体(scFv)克隆的特点,确定用以表达scFv-H4的合适载体。方法:将目的基因H4分别克隆到载体pET20b、pET22b、pET28a和pET32a上,分别转入大肠杆菌BL21(DE3)或Origami(DE3)中,比较诱导过程中细胞的生长状况和诱导结束后细胞破碎液中scFv-H4的生物活性以及细胞各部分包涵体。结果:pET20b和pET22b能表达具有生物活性的scFv-H4,这些具有生物活性的蛋白主要存在于周质中;pET28a和pET32a不能表达有生物活性的scFv-H4,而pET32a仅能在细胞质中产生大量的包涵体。结论:pET22b可能是表达AFB1的单链抗体较优的表达载体。
黄曲霉毒素;单链抗体;表达;大肠杆菌;p E T
农产品常常受到产毒素的霉菌污染,真菌毒素是霉菌的次级代谢产物。在这些真菌毒素中,黄曲霉毒素最具有致癌性[1]。除色谱分析法外,免疫学分析方法能高通量、高灵敏、高特异性地分析食品和饲料中的黄曲霉毒素的污染[2]。免疫学方法的建立非常依赖于高亲和力、高特异性的抗体。
继多克隆抗体制备技术和单克隆抗体制备技术之后,重组抗体技术无需免疫动物,能够低成本地大量制造抗体,而且能很容易地控制抗体的亲和力和特异性。现在有许多重组抗体已经成功的应用在食品科学研究和食品工业中,比如莠去津[3]、小麦蛋白[4]和核盘菌[5]等的检测。
在这样的研究中需要大量制备片段,而抗体片段的表达水平严重限制了对抗体片段的研究[6]。为解决表达问题,人们尝试了多种表达系统来表达抗体片段的基因,比如细菌表达系统[7-9]、酵母表达系统[10-11]、植物表达系统[12-13]、昆虫和哺乳动物细胞[14]。Miller等[15]比较了酿酒酵母、毕赤酵母和大肠杆菌表达抗体片段的效率和稳定性,认为大肠杆菌表达系统能最快速、最稳定的表达单链抗体,也有利于后续的纯化操作。在前期工作中,从Tomlinson I+J人源单链抗体文库中筛选到了一个高亲和力的抗黄曲霉毒素B1的抗体克隆[16];在
此研究基础上,拟用大肠杆菌来表达这个克隆。基于T7启动子的pET表达系统是目前最为常用的表达异源蛋白的大肠杆菌表达系统[17],而该表达系统有多种载体以适应不同性质蛋白的要求,本实验拟研究不同的pET载体(pET20b、pET22b、pET28a、 pET32a)表达抗黄曲霉毒素B1的单链抗体(scFv-H4)的特点,为scFv-H4的表达选择合适的载体。
1 材料与方法
1.1 菌种、试剂与培养基
抗黄曲霉毒素B1的单链抗体H4(GenBank 登录号1176324)从Tomlinson I+J单链抗体文库 (Geneservice Ltd.,英国剑桥)筛得[16]。E.coli DH5α、E.coli BL21(DE3)、E.coli Origami(DE3)由Novagen公司(北京)提供。
黄曲霉毒素B1-牛血清白蛋白复合物(AFB1-BSA)、黄曲霉毒素B1(AFB1) Sigma公司(上海)的生化级试剂;蛋白A-辣根过氧化氢酶复合物(protein A-HRP)、镍离子亲和树脂 GE Healthcare公司(上海);异丙基硫代-β-D-半乳糖苷(IPTG)、四甲基联苯胺(TMB)、氨苄青霉素(amp)、卡那霉素 上海生工生物工程技术服务有限公司;胰蛋白胨、酵母提取物 Oxoids公司(上海);DNA聚合酶 Promega公司(北京);限制性内切酶、T4连接酶 NEB公司(北京);其他试剂均为分析纯。
LB培养基:胰蛋白胨10g、酵母提取物5g、10g NaCl溶于1000mL去离子水;LB平板培养基:琼脂粉10g、胰蛋白胨10g、酵母提取物5g、10g NaCl溶于1000mL去离子水。
1.2 仪器与设备
2MK4洗板机和Multiscan MK3酶标仪 热电(上海)有限公司;UV2100型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;PowerPac型电泳仪和GelDoc XR型凝胶成像系统 伯乐生命医学产品(南京)有限公司:Sonics超声波破碎仪 Vibracell公司。
1.3 scFv-H4基因的克隆
将含有H4基因的pIT2噬菌粒通过聚合酶链式反应(PCR)获得H4基因,引物为:CAG GAA ACA GCT ATG AC和 CTA TGC GGC CCC ATT CA。用1.2%的琼脂糖凝胶电泳纯化和胶回收后,在37℃,用限制性内切酶NcoI和NotI双酶切H4基因与载体pET。再经1.0%琼脂糖凝胶电泳纯化和胶回收后,用T4连接酶将内切酶酶切后的目的基因和载体在16℃连接24h。
取连接产物10μL,热激转入感受态的E.coli DH5α,将该E.coli DH5α涂布于LB平板培养基(含amp)。20h后,挑取单克隆用LB培养基(含amp)培养,提取质粒后,用限制性内切酶NcoI和NotI酶切验证,另测序(上海生工生物工程技术服务有限公司)验证。然后将成功构建的pET/4H转入感受态的E.coli BL21(DE3)或E.coli Origmi (DE3)中,在含有amp抗性的LB平板培养基上涂布培养,挑取单克隆,并用LB培养基(含amp)培养过夜,提取质粒后NcoI和NotI双酶切验证,将甘油加入剩余的菌液中至终体积分数为8%,分装于-20℃冻存。
1.4 大肠杆菌的培养与scFv-H4的诱导表达
将冻存的菌株接入5mL LB培养基(含amp)中,37℃、200r/min振摇活化至培养物在波长600nm处光密度值(OD600nm)为0.5左右。取活化后的菌液2mL加入100mL LB培养基(含amp)中、37℃、200r/min振摇培养至OD600nm为0.6~0.8后,加入诱导物IPTG(终浓度为1mmol/L),再在20℃继续诱导20h。在E.coli Origami(DE3)的培养和诱导过程中,培养基中加入50μg/mL的卡那霉素维持菌体的突变型。取培养液1mL用水稀释10倍,测OD600nm值,菌体生物量以OD600nm值表示。
1.5 各部分蛋白的提取
取1.4节获得的发酵物1mL,在11600×g离心15min,所得菌体沉淀用100μL,2×上样缓冲液溶解,用以分析全细胞蛋白。
培养基上清液:取40mL培养物,14000×g离心,富集菌体;上清液用三氯乙酸浓缩10倍后用于电泳分析。
细胞周质组分:将富集的菌体重悬于1 0 m L 20g/100mL的蔗糖溶液(pH8.0,30mmol/L的Tris-HCl缓冲液)中,加入20μL 0.5mol/L E DTA,室温缓慢振荡10min,10000×g 4℃离心收集细胞,弃上清液。将处理后的细胞重悬于10mL冰冻的5mmol/L MgSO4溶液,在冰上缓慢振荡10min,此时细胞周质蛋白被释放到缓冲液中。4℃、11600×g离心收集细胞,上清液用三氯乙酸浓缩10倍后用于电泳分析。
细胞质可溶组分:提取细胞周质蛋白后的细胞沉淀用10mL PB S重悬,冰浴上超声(200W,1s工作,9s间歇)1h后,4℃、10000×g离心,上清液用于电泳分析。
取超声破碎液1mL于一个干净的EP管中,11600×g离心15min后,用1mL含2g/100mL曲拉通的PBS洗涤,沉淀3次,再11600×g离心15min,沉淀用100μL 2×上样缓冲液溶解,用以分析包涵体。
1.6 scFv-H4的纯化
取诱导结束后的发酵物100mL,3300×g离心15min后收集菌体沉淀,用10mL的PBS重悬菌体。重悬的菌体用超声波破碎仪在200W(1s工作,9s间歇)超声60个循环,将超声破碎液11600×g离心15min。
菌体破碎液离心后的上清液加入螯合有NiSO4的Sepharose Fast Flow凝胶上,用50mmol/L的咪唑溶液(含0.5mol/L NaCl,pH7.7)洗去杂蛋白后,用10mL
200mmol/L的咪唑溶液(含0.5mol/L NaCl,pH7.7)将目标蛋白洗脱。取50μL洗脱液与50μL 2×上样缓冲液混合,以分析蛋白纯度。
1.7 SDS-PAGE凝胶电泳
取5μL样品(按1.5节制备)在12%的聚丙烯酰胺凝胶上电泳,80V浓缩25min,再150V分离60~80min。用考马斯亮蓝染色和醋酸-乙醇溶液脱色,在凝胶成像系统上分析蛋白分布与质量浓度。
1.8 ELISA检测
25μL、0.33μg/mL的AFB1-BSA平铺于酶标板孔底(Costar 25 92),在37℃包被2h,用PBS洗涤两次后,用2g/100mL的BSA溶液封闭酶标板,37℃温浴2h,再用PBS洗涤两次。将待测样液50μL与100μL 2g/100mL BSA溶液一起加入酶标板,37℃温浴1h,用含有0.1 g/100mL 吐温-20的PBS(PBST)洗板5次,加入含蛋白A-HRP(体积分数0.02%)2g/100mL的BSA 溶液100μL,再在37℃温浴1h,用PBST洗板5次。加入含H2O2(体积分数0.006%)和TMB(100μg/mL)的醋酸钠缓冲溶液(pH5.5)100μL,室温下反应15min后,用50μL、1mol/L的H2SO4终止反应,在酶标仪上读取OD450nm值和OD650nm值,ELISA的信号值为OD450nm-OD650nm。
在竞争ELISA检测中,50μL纯化后的抗体,100μL 2g/100mL的BSA和不同质量浓度(0~2ng/mL)的黄曲霉毒素B1混合,37℃温浴1h,取100μL混合液加入上述包被并封闭好的96孔板,ELISA剩余过程如上所述。
2 结果与分析
2.1 目标蛋白分析与载体选择
将scFv-H4基因序列翻译成蛋白质序列后,发现scFv-H4中有4个半胱氨酸。重链部分含有两个半胱氨酸,分别位于可变区的第一框架区和第三框架区,形成连接上下两个反平行的β-片层的二硫键,而轻链部分也含有两个半胱氨酸,分别位于可变区的第一框架区和第三框架区,也形成二硫键以连接上下两个反平行的β-片层。这两个保守的二硫键的形成对维持scFv-H4的两个结构域的正确构象具有重要意义。重组蛋白在细菌菌体中的大量表达会导致外源蛋白来不及正确折叠,形成不可溶的包涵体,蛋白包涵体一般都没有生物活性;一般大肠杆菌的还原性细胞质不利巯基氧化成二硫键,所以含二硫键的蛋白质形成包涵体的概率很大。经Wilkinson- Harrison模型预测[18],当scFv-H4在大肠杆菌中过量表达时,scFv-H4有高达96.5%的倾向以不溶的状态聚集,形成包涵体。为了今后研究的方便,希望scFv-H4以生物活性的形式表达。
对于具有二硫键的蛋白来说,如何使重组蛋白中二硫键正确形成是表达有生物活性的抗体片段的关键。要使scFv-H4形成正确的二硫键有两种策略:一是将scFv-H4转运到周质中,周质中的氧化性环境有利于二硫键的形成;二是让scFv-H4与能够增加蛋白溶解性的标签融合,这些融合标签是高度可溶的多肽,可以增加目标蛋白的溶解性,进而促进二硫键的形成。
针对以上两种策略,本实验采用4种p E T载体(pET20b、pET22b、pET28a、pET32a)来表达scFv-H4。这4种载体有着诸多不同,比如启动子、筛选标记和其他载体元件(表1)。pET20b上的多克隆位点的N端有一个pelB信号肽序列,用以引导目标蛋白穿过细胞内膜,分泌到周质空间中,启动子为T7。pET22b的多克隆位点的N端也有一个pelB信号肽序列,但其启动子为T7lac,比T7启动子能更严谨地控制目标蛋白的表达,降低目标蛋白在没有诱导剂存在时的本地表达。pET28a载体不含pelB信号肽,所表达的产物主要在细胞质中积累。pET32a在多克隆位点的N端有一个109个氨基酸残基的硫氧还原蛋白基因,能够增加蛋白的溶解性,也可以在trxB突变宿主菌的细胞质中催化二硫键的形成。

表1 4种pET载体的比较Table 1 Comparison of four vectors for scFv-H4 expression
2.2 用不同的载体表达scFv-H4
根据scFv-H4的蛋白序列估算scFv-H4的分子质量大小为29kD,加上信号肽等,最终由大肠杆菌表达的蛋白分子质量大小应为31kD左右,由图1A可见,纯化后的scFv-H4约为31kD。比较含pET20b/H4和pET22b/ H4的E.coli BL21(DE3)的未诱导的细胞总蛋白(TCP)发现,未诱导的TCP明显多于诱导后的TCP,这与图1B中的菌体生物量在未诱导的条件下也明显高于诱导条件下的现象一致;诱导后的TCP在31kD处有明显的增强条带,该条带应该是由诱导产生的scFv-H4。图1B中的ELISA信号能反映scFv-H4的生物活性,也可以发现诱导后菌体破碎液中ELISA信号大大高于未诱导的菌体破碎液。而在用pET28a表达scFv-H4的实验中,无论诱导与否,菌体的生物量、TCP和ELISA结果都差别不大,说明pET28a不能够用以表达scFv。在采用pET32a作为载体的实验中,scFv-H4与硫氧还原蛋白(Trx)形成融合蛋白表达,分子质量大小约为44kD。比较含有pET32a/H4的E.coli BL21(DE3)在诱导和非诱导情况下的TCP可以发现,诱导后的TCP比未诱导的情况下
明显减少,这一点也可以通过检验培养物的生物量来验证(图1B);而在IPTG的诱导下,44kD附近有明显的条带产生,这就是scFv-H4-Trx融合蛋白。但图1B中显示含pET32a的经诱导后E.coli BL21(DE3)菌体破碎液没有明显生物活性,所以该融合蛋白可能是以包涵体的形式存在。下一步将pET32a在细胞质呈氧化性的E.coli Origami(DE3)中表达scFv-H4。

图2 在E.coliOrigami (DE3)中,用pET32a表达scFv-H4时的TCP和包涵体Fig.2 TCP profile and inclusion body of scFv-H4 expressed with pET32a vector inE. coliOrigami (DE3)

图1 用不同的pET载体表达scFv-H4Fig.1 Expression of scFv-H4 inE. coliBL21(DE3) using different pET vectors
2.3 在E.coli Origami(DE3)中,pET32a也不能表达有生物活性的scFv-H4
用pET32a在E.coli BL21(DE3)中表达scFv-H4时,scFv-H4也没有生物活性,但有大量融合蛋白的包涵体产生。大肠杆菌的细胞质中存在硫氧蛋白还原酶(trxB)和谷胱甘肽还原酶(gor),保持了细胞质环境的还原性,所以scFv-H4中的半胱氨酸以巯基的形式存在,不能维持scFv-H4中重链可变区和轻链可变区的正确构象,可能导致scFv-H4没有生物活性。而E.coli Origami(DE3)是硫氧蛋白还原酶和谷胱甘肽还原酶突变体,这进一步增强了二硫键的形成。然而在E.coli Orig ami(DE3)中,pET32a表达scFv-H4的结果也不是很理想。
由图2可见,E.coli Origami(DE3)经过诱导后也大量表达了scFv-H4-Trx融合蛋白(第1、2泳道),而这些融合蛋白绝大多数是以包涵体的形式存在(第3、4道),而ELISA实验信号为0.062±0.007(空白为0.048±0.004)。这说明在E.coli Origami(DE3)细胞破碎液中没有明显的scFv-H4生物活性。由此可见,细胞的氧化还原势不是唯一决定scFv-H4正确折叠的因素,其他的因素比如分子伴侣可能也决定着scFv-H4的正确折叠。
2.4 严谨的启动子有利于scFv-H4的表达
从2.2节的结果可以看出在E.coli BL21(DE3)宿主中,具有信号肽的载体pET20b和pET22b所表达的scFv-H4是有生物活性的。但是E.coli BL21(DE3)/pET20b/H4的菌体破碎液中的生物活性低于E.coli BL21(DE3)/pET22b/H4的菌体破碎液中的生物活性。pET20b和pET22b的载体的主要区别在于启动子,pET22b由T7lac启动,比pET20b的T7更加严格。从E. coli BL21(DE3)/pET20b/H4和E.coli BL21(DE3)/pET22b/H4培养的生长曲线(图3A)和诱导过程中具有生物活性的scFv-H4的表达情况(图3B)可以发现它们之间的区别。在尚未添加IPTG的时候,E.coli BL21(DE3)/pET20b/H4菌体破碎液已经能检测到一定水平的scFv-H4生物活性,但E.coli BL21(DE3)/ pET22b/H4菌体破碎液并无明显的scFv-H4生物活性被检测到;添加了IPTG后,E.coli BL21(DE3)/pET20b/H4菌体破碎液scFv-H4生物活性有所上升,但上升的速度较慢,而E.coli BL21(DE3)/pET22b/H4在IPTG的诱导后菌体破碎液中scFv-H4生物活性快速上升。
T7启动子由E.coli BL21(DE3)基因组上的T7 RNA聚合酶启动,而T7 RNA聚合酶有lacUV5启动子控制表达。在没有IPTG的情况下,也会有少量T7 RNA聚合酶表达,因此存在外源蛋白的本底表达。宿主需要耗费能量与资源去表达外源蛋白,这对宿主来说是一种代谢负担,会或多或少影响到宿主的正常生理功能。在对数中期添加IPTG以解除对lacUV5的抑制(图3A),启动目的基因的表达。在此之前,宿主需要有足够的生
物量,这是大量表达目的蛋白的基础。用pET20b表达scFv-H4时,由于T7启动子不严谨,导致E.coli BL(DE3)/ pET20/H4有较高的本底表达(图3B),这影响了菌体的生长,此后的菌体量一直较低,从而影响了scFv-H4最终的表达水平。而pET22b能严谨地控制scFv-H4的表达,在未添加IPTG时,scFv-H4的活性表达量很低,菌体生物量在对数期以及后面的稳定期一直都处于比较高的水平;当添加IPTG后,有生物活性的scFv-H4迅速表达,且菌体破碎液中scFv-H4的生物活性明显高于采用pET20b的情况。

图3 含有pET20b和pET22b的E.coliBL21(DE3)在表达scFv-H4过程中的生长曲线(A)和期间具有生物活性的scFv-H4的表达情况(B)Fig.3 Growth curves ofE. coliBL21 (DE3) using pET20b and pET22b vectors and the bioactivity of scFv-H4 expressed by both constructs
2.5 用pET22b表达的scFv-H4在E.coli BL21(DE3)分布
pET22b是带有信号肽的载体,能引导目标蛋白跨越细胞内膜,分泌于细胞周质中。本实验通过培养物上清,细胞周质,细胞质可溶部分和细胞质不可溶部分的电泳图来分析scFv-H4的分布。
从图4可以发现,由于外膜的限制,很少有蛋白质能分泌到培养基中,在细胞周质中的蛋白质种类较少,但是有大量可溶性的scFv-H4;而在细胞质可溶部分仅有很少量的scFv-H4,细胞质中的scFv-H4基本上是以不溶性的包涵体形式存在。
2.6 scFv-H4特性的测定
由E.coli BL21(DE3)/pET22b系统表达的scFv-H4经纯化后,用竞争ELISA测定其亲和力。取质量浓度为0.5μg/mL的scFv-H4与不同质量浓度的AFB1溶液混合后,加入AFB1-BSA包被的酶标板中。
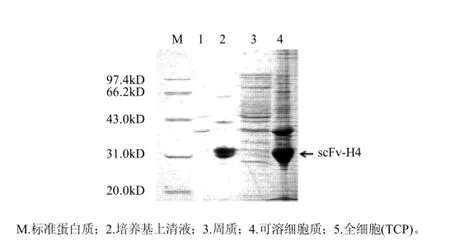
图4 scFv-H4培养物各部分的分布情况Fig.4 Distribution of scFv-H4 in cell culture

图5 scFv-H4的竞争ELISA结果Fig.5 Binding results of scFv-H4 to AFB1in competitive ELISA
图5结果表明,scFv-H4的半抑制质量浓度(IC50)为0.4ng/mL。Moghaddam等[19]从未经免疫的人源抗体文库中通过竞争洗脱筛选到的单链抗体的IC50为400ng/mL;而Daly等[20]从免疫过的小鼠单链抗体文库中筛选到的抗体的 IC50为16ng/mL。相比较而言,scFv-H4更为敏感,能检测到更低浓度的AFB1,所以这个抗体具有一定的应用价值。scFv-H4与AFB2有12%的交叉反应性,与AFG1有42%的交叉反应性,与AFG2有9%的交叉反应性[16]。
3 结 论
Wilkinson- Harrison模型预测表明当抗AFB1的scFv-H4在大肠杆菌中大量表达的时候,有96.5%的可能形成包涵体。为得到可溶的、有生物活性的scFv-H4,本实验采用了4个不同的pET载体pET20b、pET22b、pET28a和pET32a来表达scFv-H4,其中pET20b和pET22b能将scFv-H4分泌到大肠杆菌的细胞周质中,而pET32a的表达产物则存在于细胞质中。
pET20b和pET22b能用来表达有生物活性的scFv-H4,而pET22b的T7lac启动子能严谨地控制scFv-H4的本底表达,从而避免由于诱导后scFv-H4的表达影响对数前
期的细胞生长。pET22b表达的scFv-H4分为两部分:分泌到细胞周质中的有生物活性的可溶性蛋白和在细胞质中的包涵体。而采用pET20b作为表达载体时,scFv-H4的本底表达比较高,影响了细菌本身的生长和新陈代谢。
pET28a不能用来表达scFv-H4,实验结果显示没有明显的scFv-H4蛋白产生。带有Trx标签的载体pET32a在E.coli BL21(DE3)中能表达大量的Trx-scFv-H4融合蛋白,但是都没有生物活性,把宿主换为细胞质呈氧化性的E.coli Origami(DE3)后,情况并没有特到改善,所以scFv-H4的正确折叠可能不仅局限于分子中二硫键的因素,还需要考虑其他的影响因素如分子伴侣等。
E.coli BL(DE3)/pET22b这样的表达系统不仅有利于scFv-H4的表达,也可能为此类蛋白的表达提供参考;并有可能为以后的抗体亲和力成熟和稳定性改进奠定良好的基础。
[1]SMLA M E, CURRIER S S, BAILEY E A, et al. The chemistry and biology of aflatoxin B1∶ from mutational spectrometry to carcinogenesis [J]. Carcinogenesis, 2001, 22(4)∶ 535-545.
[2]PAKNEJAD M, JAVADRASAEE M, MOHAMMADNEJAD J, et al. Development and characterization of enzyme-linked immunosorbent assay for aflatoxin B1 measurement in urine sample using penicillinase as label[J]. Journal of Toxicological Science, 2008, 33(5)∶ 565-573.
[3]GRANT S D, PORTER A J, HARRIS W J. Comparative sensitivity of immunoassays for haptens using monomeric and dimeric antibody fragments[J]. Journal Agricultural and Food Chemistry, 1999, 47(1)∶340-345.
[4]HILL A S, GIERSCH T M, LOH C S, et al. Immunoassay for wheat processing quality∶ utilization of a sandwich assay incorporating an immobilized single-chain fragment[J]. Journal of Agricultural and Food Chemistry, 1999, 47(10)∶ 4484-4490.
[5]YAJIMA W, RAHMAN M H, DAS D, et al. Detection of Sclerotinia sclerotiorum using a monomeric and dimeric single-chain fragment variable (scFv) antibody[J]. Journal of Agricultural and Food Chemistry, 2008, 56(20)∶ 9455-9463.
[6]LIM K P, LI H, NATHAN S. Expression and purification of a recombinant scFv towards the exotoxin of the pathogen, Burkholderia pseudomallei [J]. Journal of Microbiology, 2004, 42(2)∶ 126-132.
[7]YANG J, MOYANA T, MACKENZIE S. One hundred seventy-fold increase in excretion of an FV fragment-tumor necrosis factor alpha fusion protein (sFV/TNF-alpha ) from Escherichia coli caused by the synergistic effects of glycine and Triton X-100[J]. Applied Environmental Microbiology, 1998, 64(8)∶ 2869-2874.
[8]SANTALA V, LAMMINMAKI U. Production of a biotinylated singlechain antibody fragment in the cytoplasm of Escherichia coli[J]. Journal of Immunological Methods, 2004, 284(1)∶ 165-175.
[9]SORENSEN H P, MORTENSEN K K. Advanced genetic strategies for recombinant protein expression in Escherichia coli[J]. Journal of Biotechnology, 2005, 115(2)∶ 113-128.
[10]REN F, LI B C, ZHZANG N N, et al. Expression, purification and characterization of anti-BAFF antibody secreted from the yeast Pichia pastoris[J]. Biotechnology Letters, 2008, 30(6)∶ 1075-1080.
[11]SHI X, KARKUT T, CHAMANKHAH M, et al. Optimal conditions for the expression of a single-chain antibody (scFv) gene in Pichia pastoris[J]. Protein Expression and Purification, 2003, 28(2)∶ 321-330.
[12]SCHOUTEN A, ROOSIEN J, de BORE J M, et al. Improving scFv antibody expression levels in the plant cytosol[J]. FEBS Letters, 1997, 415(2)∶ 235-241.
[13]ARTSAENKO O, PEISKER M, ZURNIEDEN U, et al. Expression of a single-chain Fv antibody against abscisic acid creates a wilty phenotype in transgenic tobacco[J]. Plant Journal, 1995, 8(5)∶ 745-750.
[14]HU Y C. Baculovirus as a highly efficient expression vector in insect and mammalian cells[J]. Acta Pharmacology Sinica, 2005, 26 (4)∶ 405-416.
[15]MILLER K D, WEAVER-FELDHAUSE J, GRAY S A, et al. Production, purification, and characterization of human scFv antibodies expressed in Saccharomyces cerevisiae, Pichia pastoris, and Escherichia coli[J]. Protein Expression and Purification, 2005, 42 (2)∶ 255-267.
[16]YANG Lian, DING Husheng, GU Zhennan, et al. Selection of single chain fragment variables with direct coating of aflatoxin B1 to enzymelinked immunosorbent assay plates[J]. Journal of Agricultural and Food Chemistry, 2009, 57(19)∶ 8927-8932.
[17]SORENSEN H P, MORTENSEN K K. Soluble expression of recombinant proteins in the cytoplasm of Escherichia coli[J]. Microbiology Cell Factory, 2005, 4(1)∶ 1-8.
[18]SMIALOWSKI P, MARTIN-GALIANO A J, MIKOLAJKA A, et al. Protein solubility∶ sequence based prediction and experimental verification [J]. Bioinformatics, 2007, 23(19)∶ 2536-2542.
[19]MOGHADDAM A, LOBERSLI I, GEBHARDT K, et al. Selection and characterization of recombinant single-chain antibodies to the hapten aflatoxin-B1from naive recombinant antibody libraries[J]. Journal of Immunological Methods, 2001, 254(1)∶ 169-181.
[20]DALY S, DILLON P, MANNING B, et al. Production and characterization of murine single chain Fv antibodies to aflatoxin B1 derived from a pre-immunized antibody phage display library system[J]. Food and Agricultural Immunology, 2002, 14(4)∶ 255-274.
Comparison of pET Vectors for the Expression of Single Chain Antibody for Aflatoxin B1
YANG Lian,LIU Zi-qin,LIU Rong,CHEN Hai-qin,CHEN Wei,ZHANG Hao*
(State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Objective∶ Recombinant antibody expression in microorganism greatly facilitated the affinity and stability studies of recombinant antibodies, but previous studies had less reports about the selection of vectors. A suitable expression vector is important during the expression of the single chain antibody (scFv-H4) for aflatoxin B1. Methods∶ Four pET vectors such as pET20b, pET22b, pET28a and pET32a were employed in the functional expression of scFv-H4. Results∶ pET20b and pET22b vectors were able to express the functional antibody in periplasm. The vector of pET28a was not suitable for the expression of scFv-H4 due to lack of detectable scFv-H4 in total protein. Moreover, the detectable scFv-H4 was only expressed in inclusion body through pET32a expression system. Conclusion∶ pET22b was an excellent vector for the expression of scFv-H4, which might be a good reference for similar protein expression and be useful in the later study of scFv-H4 affinity and stability.
aflatoxin;single chain fragment;expression;Escherichia coli;pET
Q782
A
1002-6630(2010)09-0171-06
2009-10-24
教育部新世纪人才计划资助项目(NCET-06-0482)
杨炼(1978—),男,博士研究生,研究方向为食品生物技术。E-mail:yanglian27@yahoo.com.cn
*通信作者:张灏(1962—),男,教授,研究方向为食品生物技术。E-mail:zhanghao@jiangnan.edu.cn
