紫玉米成熟期以及不同干燥方式条件下花青素和两种毒素的含量变化
2010-03-21肖丽霞于洪涛赵晓燕胡晓松
肖丽霞,汪 芬,于洪涛,赵晓燕*,胡晓松
紫玉米成熟期以及不同干燥方式条件下花青素和两种毒素的含量变化
肖丽霞1,汪 芬1,于洪涛1,赵晓燕2,*,胡晓松3
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.北京市农林科学院蔬菜研究中心,北京 100097;3.中国农业大学食品科学与营养工程学院,北京 100087)
建立高效液相色谱方法准确检测紫玉米中富马毒素B1和黄曲霉毒素B1、B2、G1、G2。在紫玉米成熟、不同干燥过程中监测苞叶、穗轴、籽粒三部分的毒素及花青素含量的变化情况,从而找到最佳的采收时间、最佳干燥方法。结果表明:从紫玉米种植开始,10周后为最佳采收时间;紫玉米苞叶中花青素含量最高且易干燥;微波干燥解毒能力强,但花青素损失较多且很难用于工业化操作;鼓风干燥适合用来干燥籽粒;日光干燥苞叶和穗轴花青素几乎没有损失,能降低50%左右的毒素,经济适宜,适合工业化生产。
紫玉米;花青素;富马毒素;黄曲霉毒素;干燥
紫玉米(Zea Mays L.)原产于南美安第斯山区,其籽粒和植株呈紫黑色,有“黑珍珠”之称[1],且富含天然色素——花青素。花青素具有抗氧化、清除自由基、增强人体免疫力等生理功效,市场前景十分广阔[2-3]。但是紫玉米生长、储藏过程中极其容易受真菌感染而产生富马毒素(FB1)和黄曲霉毒素(AFs)[4-5],而AFs毒性是氰化钾的10倍,为砒霜的68倍。国际癌症中心将AFs定为一类致癌剂[6-7],将FB1定为人类可能的致癌物[7]。在提取紫玉米花青素时,原料中的毒素会通过浓缩、纯化等工艺进一步聚集,使花青素提取物中的毒素含量超标[8],从而影响到从紫玉米中提取花青素的工业化推广。本研究确定最佳的采收时期和适宜的干燥方式,使紫玉米中毒素的增长得到有效地控制,对紫玉米花青素的生产具有指导意义。
1 材料与方法
1.1 材料与试剂
紫玉米(苞叶、穗轴、籽粒):北京市延庆农场2008年种植。
FB1标准品、AFs标准品(AFB1、AFB2、AFG1和AFG2) 美国Sigma公司;巯基乙醇(分析纯)、三氟乙酸(分析纯) 北京索来宝科技有限公司;邻苯二甲醛(分析纯) 北京金龙化学试剂有限公司;乙腈、甲醇(均为色谱纯) 迪马科技有限公司。
1.2 仪器与设备
DGU-20A5高效液相色谱仪(配RF-10AXL荧光检测器)日本岛津公司;C18反相柱 美国Waters公司;SUPELCO固相萃取装置、TC-F120富马毒素专用富集柱、PuriToxSR多功能净化柱 北京锐鑫农科贸有限公司;DZQ-500型抽真空机 北京日上公司;UV-3802紫外分光光度计 美国Unic公司;TTL-DCⅡ型氮吹仪 余姚长江温度仪表厂;格兰仕WD800型微波炉 顺德格兰仕电器厂有限公司;DHG-9240A电热恒温鼓风干燥箱 北京雅仕林实验设备有限公司;ALPHA 2-4 LD冻干机 Christ公司。
1.3 方法
1.3.1 采样
从紫玉米种植第8周起每隔一周去北京延庆农场紫玉米试验田随机采样,包括苞叶、穗轴、籽粒,采样6周。
1.3.2 干燥
对原料(未处理)分别采用不同方式进行干燥。日光干燥:将原料在日光下晒20h;鼓风干燥:将原料置于鼓风干燥箱中60℃干燥16h;微波干燥:将原料置于微波炉中,调至中挡,籽粒和穗轴烘烤10min,苞叶烘烤5min;真空低温干燥:将原料在冻干机中冻干72h。各种干燥方式都要达到原料中的水分含量小于10%。
1.3.3 AFs标准曲线的绘制和检测
1.3.3.1 色谱条件
色谱柱:C18反相柱(150mm×4.6mm,5μm);柱温:20℃;激发波长:360nm,发射波长:440nm;流动相:甲醇-乙腈-水体积比1:1:4,流速:1mL/min;衍生剂:三氟乙酸溶液(10mL三氟乙酸+5mL冰乙酸+35mL水);进样量:10μL。
1.3.3.2 AFs标准曲线的绘制
以1mL苯-乙腈(体积比98:2)溶解1mg AFB1、AFB1、AFB2、AFG1、AFG2标准品,将之分别配成1mL质量浓度分别为1.2、0.2、0.6、0.2μg/mL的标准品工作液,分别吸取90、180、270μL氮气吹干后以10mL乙腈溶解,取其200μL与700μL衍生剂于液相进样瓶混匀,60℃水浴下反应10min后进样检测。以AFs质量为横坐标,峰面积为纵坐标,绘制标准曲线[9-12]。
AFB1、AFG1、AFB2、AFG2的线性回归方程分别是Y=3.0×106X-63.506(R2=0.9996,P<0.05)、Y= 3.0×106X+78.036(R2=0.9998,P<0.05)、Y=734300X+ 404.2(R2=0.9974,P<0.05)、Y=940629X+161.86(R2= 0.9968,P<0.05);检出限分别为0.005、0.003、0.001、0.0015ng/mL。
1.3.3.3 测定的精密度、准确度和重现性
测定4种毒素的加标回收率在84%~106%,平均回收率分别为95.7%、91.3%、99.8%、93.7%,平均变异系数分别为4.4%、3.1%、6.8%、3.7%,样品检测准确度和精密度好,日内变异系数和日间变异系数分别为2.8%和4.3%,说明方法的重现性好。
1.3.3.4 AFs的提取和测定
将干燥后的原料粉碎,过60目筛,称取2g置于30mL乙腈-水(体积比9:1)的中,摇床振荡1h后8000r/min离心20min,上清液过中性滤纸得AFs提取液,吸取3mL过PuriToxSR真菌毒素多功能净化柱,得AFs净化液[13]。取样200μL衍生后进样检测,计算质量浓度(C),毒力指数[14]计算公式为:
毒力指数=CAFB1+0.22CAFB2+ 0.5CAFG1+ 0.11CAFG2
1.3.4 FB1标准曲线绘制和检测
1.3.4.1 色谱条件
色谱柱:C18反相柱(150mm×4.6mm,5μm);柱温:23℃;激发波长:335nm,发射波长:440nm;流动相:甲醇-0.1mol/L NaH2PO4(体积比78:22,磷酸调至pH3.3),流速1mL/min;衍生剂:邻苯二甲醛溶液(40mg OPA+1mL甲醇+5mL 0.1mol/L四硼酸钠+50μL 2-巯基乙醇);进样量:20μL。
1.3.4.2 FB1标准曲线的绘制
以1mL乙腈-水(体积比1:1)溶解1mg FB1标准品,分别配成0.2、0.5、1.0、2.0、5.0、10.0μg/mL的标准品工作液,取样50μL与200μL衍生剂漩涡混匀,3min内进样检测,以标准液质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线[15-16]。回归方程为:Y=365961X+28412 (R2=0.9998,P<0.05),检出限为0.1μg/mL。
1.3.4.3 测定的精密度、准确度和重现性
测定FB1的加标回收率在76%~82%,平均回收率为79%,平均变异系数为4.1%,样品检测的准确度和精密度好,日内变异系数和日间变异系数为3.5%和5.3%,说明检测方法重现性好。
1.3.4.4 FB1的提取纯化及检测
将干燥后的原料粉碎,过60目筛,称取2g置于30mL甲醇-水(体积比3:1)中,振荡1h后8000r/min离心20min,取上清液过中性滤纸得FB1提取液,用1mol/L NaOH溶液调pH值至5.8~6.5待用[17-18]。依次用5mL甲醇,5mL甲醇-水(3:1)溶液活化富马毒素专用净化柱,流速不超过1mL/min。吸取10mL FB1提取液过柱后,依次用5mL甲醇-水(3:1),3mL甲醇淋洗,最后用10mL冰乙酸-甲醇(1:99)洗脱,收集洗脱液,60℃氮气挥干。分析时用1mL乙腈-水(1:1)溶解,0.45μm有机溶剂滤膜过滤,取样50μL衍生后进样检测。
1.3.5 花青素的提取测定方法
花青素的提取:选用乙醇溶剂,料液比为1:15(m/V),65℃条件下提取40min。花青素的测定:采用pH示差法[19]。
2 结果与分析
2.1 AFs的液相色谱图

图1 AFs标准品液相色谱图Fig.1 HPLC chromatograms of aflatoxin standards

图2 紫玉米中AFs液相色谱图Fig.2 HPLC chromatograms of aflatoxins in purple corn
利用高效液相色谱法柱前衍生法,以三氟乙酸作为衍生剂,荧光检测器检测,得到液相色谱图,其中未标示杂峰为溶剂峰。通过比较紫玉米的AFs和AFs标准品的液相色谱图可知,AFB1、AFG1、AFB2、AFG2的保留时间分别为5.456、7.328、11.532、16.788min。AFB2未被检测出,这与Muller的实验结果一致[20]。
2.2 FB1液相色谱图

图3 FB1标准品液相色谱图Fig.3 HPLC chromatogram of fumonisin B1standard

图4 紫玉米中FB1液相色谱图Fig.4 HPLC chromatogram of fumonisin B1in purple corn
利用高效液相色谱柱前衍生法,以OP A为衍生剂,荧光检测器检测,得到液相色谱图,其中未标示杂峰为溶剂峰。通过比较紫玉米的FB1液相色谱图和FB1标准品的液相色谱图可知,FB1保留时间为7.652min。

图5 采样周期内花青素含量变化情况Fig.5 Change of anthocyanin in purple corn during the harvesting period

图6 采样周期内毒素含量变化情况Fig.6 Changes of toxins in purple corn during the harvesting period
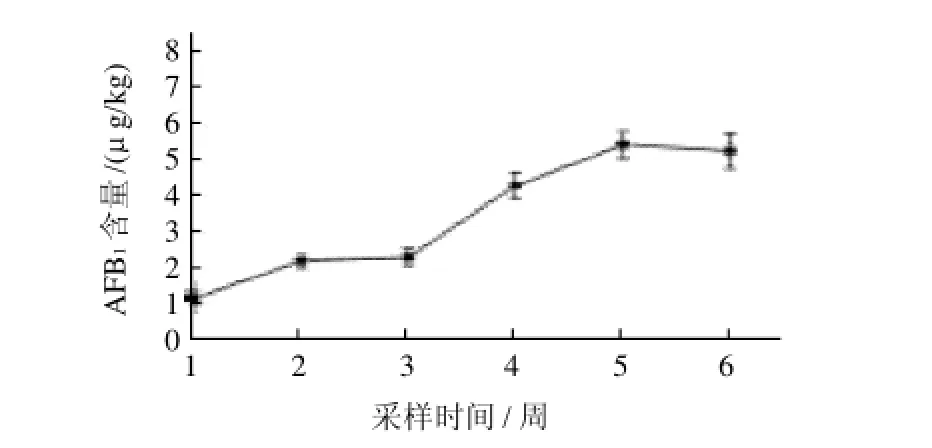
图7 采样周期内AFB1含量变化情况Fig.7 Change of fumonisin B1in purple corn during the harvesting period
2.3 紫玉米在成熟期花青素与毒素含量的变化情况如图5~7所示,采样两周后花青素质量分数增高约15倍,而毒素增加较为缓慢,成熟初期紫玉米生理活动旺盛,能产生较多花青素并抑制霉菌的生长。在成熟后期,花青素呈下降趋势,可能是成熟后期紫玉米自身合成花青素能力下降、加之日晒、氧气等条件下,花青素不稳定而开始降解;而霉菌生长分泌毒素快速增长数倍达到较高水平后不再增长。综合看来,紫玉米种植开始第10周为最佳紫玉米采收时间,此时紫玉米中花青素含量最多且毒素含量相对较低,对后期紫玉米花青素加工中毒素控制有利。
2.4 不同干燥方式对花青素和毒素含量的影响

图8 不同干燥方式对花青素含量的影响Fig.8 Effect of drying method on the content of anthocyanin in purple corn
如图8所示,紫玉米三种部位相比,苞叶中花青素含量最高达到62.4mg/g。各种干燥处理中花青素均有所下降。日光干燥处理苞叶几乎不会使花青素损失,而微波处理下苞叶花青素损失最多达到4%~13%。对于穗轴,微波干燥造成的损失依然较多达16.2%,其他3种处理在2%~4.5%之间,并不显著。处理籽粒时,鼓风干燥产生的损失相比更少为5.9%,其他3种处理差别不大在29.4%~30.4%之间。花青素在光、氧和热等条件下不稳定,易分解导致花青素的损失,但与霉菌的大量生长导致分泌大量毒素相比,10%左右的花青素损失可以忽略不计,其中日光干燥更有利于花青素的保持。微波干燥用时最短,鼓风干燥与日光干燥耗时差别不大,低温干燥耗时太长。

图9 不同干燥方式对FB1含量的影响Fig.9 Effect of drying method on the content of fumonisin B1in purple corn
由图9可知,干燥能不同程度的降低苞叶、穗轴、籽粒中的FB1,日光干燥、鼓风干燥、低温真空干燥和微波干燥下,苞叶中的FB1分别减少40.7%、30.1%、16.7%和53.6%,穗轴中的FB1分别减少37.0%、39.9%、62.0%和68.4%,籽粒中的FB1分别减少39.2%、52.3%、6.6%和31.5%。相比之下,微波干燥能使FB1平均减少51.2%,日光干燥和鼓风干燥稍逊,分别为39.0%和40.8%。
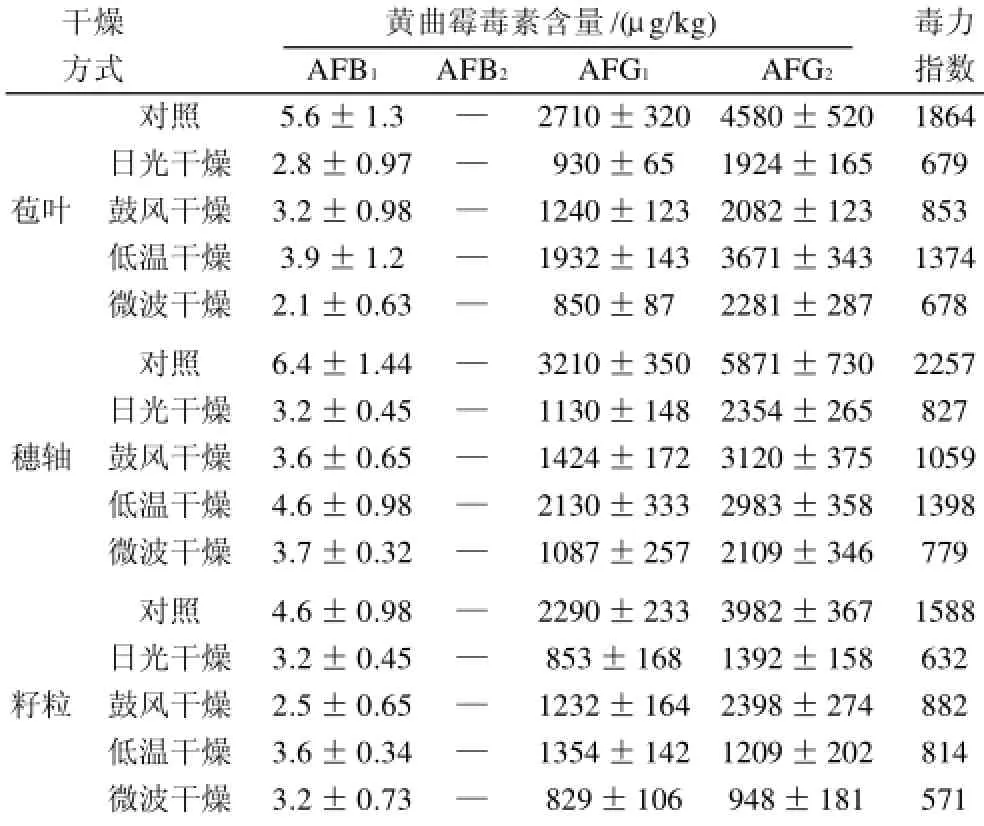
表1 不同干燥方式对黄曲霉毒素含量的影响Table 1 Effect of drying method on the content of aflatoxins in purple corn
由表1可知,紫玉米中黄曲霉产生的AFG1和AFG2更多,而毒力最强的AFB1极少。毒力指数是表征各种AFs的联合毒性的一个指标[13]。不同方式干燥后毒力指数均有大幅降低,日光干燥、鼓风干燥、低温真空干燥和微波干燥下,紫玉米不同部位AFs的毒力指数平均分别降低62.4%、49.9%、38.4%和64.4%。日光干燥与微波干燥对AFs都有较强的解毒能力。
刚收获的苞叶、穗轴、玉米粒中含有的水分含量高,利于串珠镰刀菌,黄曲霉菌,寄生霉菌等真菌的
生长,产生对人体危害极大的FB1和AFs。干燥能降低紫玉米中水分,抑制霉菌的生长产毒并能降低毒素含量,可能是干燥过程中毒素发生了分解转化,而日光和微波加热所具有的光热作用能加快其分解转化作用。
3 结 论
根据实验实际情况,通过参考AOAC,建立了测定紫玉米中AFs和FB1的高效液相色谱法,方法准确可靠,重现性好。紫玉米种植后第10周花青素质量浓度最高,所含毒素较少,是最佳采收时间。苞叶、穗轴和籽粒中,苞叶中花青素远多于其他部位达到62.4mg/g,而且苞叶易干燥,是生产花青素的良好原料。所采用的几种干燥方法均有解毒作用,其中微波干燥耗时短,解毒作用强,但花青素损失较多。日光干燥能较好的保持花青素,与微波干燥有相近的解毒能力,用来干燥苞叶和穗轴可以降解平均38.9%的FB1和63.5%的AFs,能耗小,是适合工业化生产的方法。鼓风干燥解毒能力稍逊,但用来干燥籽粒能大幅减少花青素的损失,是干燥籽粒的好方法。花青素作为一种保健功能成分,具有广泛的应用市场。本研究能为紫玉米花青素生产的原料准备提供有效的指导作用。
[1]BRIDLE P. Anthocyanians as natural food colous-selected aspects[J]. Food Chemistry, 1997, 58(12): 103-109.
[2]辛国胜, 林祖军, 韩俊杰, 等. 紫甘薯花色素研究进展及其产业化前景[J]. 辽宁农业科学, 2006(5): 48-50.
[3]李娟娟. 花青素研究进展[J]. 中山大学研究生学刊, 2007, 28(2): 1-5.
[4]朱旗, 毛清黎, 王征, 等. 粮食真菌毒素污染的预防与脱毒[J]. 食品科学, 2003, 24(8): 264-268.
[5]许牡丹, 毛根年. 食品安全性与分析检测[M]. 北京: 化学工业出版社, 2003.
[6]孙秀兰, 赵晓联, 汤坚. 大米中黄曲霉毒素B1的提取方法优化[J]. 食品科学, 2004, 25(7): 128-131.
[7]居乃琥. 黄曲霉毒素[M]. 北京: 轻工业出版社, 1980: 90-98.
[8]SHIER W. The fumonisin paradox: a review of research on oral bioavailability of fumonisin B1, a mycotoxin producedby Fusarium moniliforme[J]. Journal of Toxicology, 2000, 19(2): 161-187.
[9]MARASAS W F, MILLER J D, RILEY R T. Environmental Health Criteria 219: fumonisinB1, international programme on chemical safty [R]. Geneva: EHC, 2000.
[10]江湖, 熊勇华, 许杨. 黄曲霉毒素分析方法进展[J]. 卫生研究, 2005, 34(2): 252- 255.
[11]付学文, 王爱军. 黄曲霉毒素B1测定方法概述[J]. 食品研究与开发, 2007, 28(12): 187-189.
[12]许艳丽, 鲍蕾, 梁成珠, 等. 黄曲霉毒素检测及其生物防治方法的研究进展[J]. 安徽农业科学, 2007, 35(32): 10210-10212.
[13]SOBOLEV V S, DORNER J W. Cleanup procedure for determination of aflatoxins in major agricultural commodities by liquid chromatography [J]. J AOAC Int, 2002, 85(3): 642- 651.
[14]张浩, 侯红漫, 刘洋, 等. 富马毒素检测方法的研究进展[J]. 中国粮油学报, 2007, 22(4): 137-141.
[15]FARAG R S, RASHED M M, ABO HGGEL A A. Aflatoxin destruction by microwave heating[J]. International Journal of Food Sciences and Nutrition, 1996, 41: 197-208.
[16]权英, 王硕, 韩英素, 等. 高效液相色谱法检测玉米中的伏马毒素B1和B2[J]. 分析与检测, 2005, 31(8): 87-90.
[17]AOAC International. AOAC Official Method 944. 08 Aflatoxins in Corn, Almonds, Brazil Nuts, Peanuts, and Pistachio Nuts. Multifunctional Column(Mycosep) Method[S].
[18]AOAC International. AOAC Official Method 995. 15 Fumonisin B1, B2, B3in Corn Liquid Chromatographic Method[S].
[19]王少波, 杜永峰, 姚秉华. pH示差法测定黑豆皮中的花青素[J]. 化学分析计量, 2008, 17(1): 46-48.
[20]MULLER P, BASEDOW T. Aflatoxin contamination of pods of Indian Cassia senna L. (Caesalpinaceae) before harvest, during drying and in storage: Reasons and possible methods of reduction[J]. Journal of Stored Products Research, 2007, 43(4): 323-329.
Effects of Maturity Degree and Drying Methods on Anthocyanin and Toxins Contents in Purple Corn
XIAO Li-xia1,WANG Fen1,YU Hong-tao1,ZHAO Xiao-yan2,*,HU Xiao-song3
(1. College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China;2. Vegetable Research Center of Beijing Academy of Agricultural and Forest Sciences, Beijing 100097, China;3. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100087, China)
In order to explore the optimal harvesting season and drying method, the content changes of fumonisin B1 and aflatoxin B1, B2, G1 and G2 in husk, cob and grain of purple corn during mature period and different drying methods were determined by high performance liquid chromatography. Results indicated that the best time for harvesting purple corn was its plantation after 10 weeks; the husk of purple corn exhibited the highest content of anthocyanin and was easy to be dried at this harvesting time point. Microwave drying had strong detoxification capability, however, it also resulted in the loss of anthocyanin. Thus, microwave drying was not suitable for industrialized production. Airflow drying was suitable for kernels. The loss of anthocyanin in husk and cob of purple corn was less during sunlight drying. In addition, sunlight drying method could degrade 50% toxins. Therefore, sunlight drying is an economic drying method and suitable for industrialized production.
purple corn;anthocyanin;fumonisin;aflatoxin;drying
S509;S513
A
1002-6630(2010)21-0142-05
2010-06-17
北京市科委成果转化项目(Z08000503250821)
肖丽霞(1966—),女,副教授,博士,研究方向为农产品贮藏加工。E-mail:lxxiao@yzu.edu.cn
*通信作者:赵晓燕(1968—),女,研究员,博士,研究方向为蔬菜加工。E-mail:zhaoxiaoyan@nercv.org
