3-氧十二烷酰高丝氨酸内酯对淋巴细胞Toll样受体2和4的影响*
2010-03-17余加林杨锡强
芦 起, 余加林, 杨锡强, 刘 伟
(重庆医科大学附属儿童医院,重庆400015)
铜绿假单胞菌是医院感染中最常见的机会致病菌。它常引起急性和慢性肺部感染,多见于局部或全身免疫功能障碍的患者。现代微生物学观点认为铜绿假单胞菌(Pseudomonas aeruginosa,PA)感染大多以生物膜形式存在[1]。PA内各个细胞间的交流有赖于群体感应系统(quorum-sensing,QS系统)。QS系统不仅在调节铜绿假单胞菌生物膜形成上,而且在免疫调节上均有关键作用[2]。Toll样受体(Toll-like receptor,TLR)是一组重要的免疫模式识别受体,TLR信号转导在启动机体的固有免疫反应、介导获得性免疫反应中起到重要作用。本研究探讨QS系统信号分子对外周血淋巴细胞增殖、TLR 2、TLR4表达,及肿瘤坏死因子α(tumor necrosis-α,TNF-α)分泌的影响。
材料和方法
1主要试剂
3-氧十二烷酰高丝氨酸内酯(3-oxo-C12-homoserine lactone,3-O-C12-HSL)购自Cayman公司,R/MINI-1640培养基和小牛血清购自杭州四季青生物制品公司。MTT和 DMSO购自Sigma,淋巴细胞分离液购自天津灏洋生物制品科技有限公司。RNA提取试剂盒购自北京Biotake公司,逆转录-聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒和DNA marker购自大连宝生物工程有限公司,PCR引物由上海生工生物工程公司合成,CD3单克隆抗体、人TNF-α试剂盒购自深圳晶美生物工程有限公司。
2 外周血淋巴细胞的分离和分组
取健康献血者外周静脉血40 mL,肝素抗凝,以淋巴细胞分离液分离出外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),PBS充分洗涤,用含10%小牛血清RPMI-1640培养液调整细胞数为1×1010cells/L,采用12孔塑料培养板,随机分成5组。分别加入0、1、10、50、100 μmol/L 3-O-C12-HSL各10 μL,在37℃、5%CO2培养箱中培养12 h。吸取上层淋巴液。经CD3单克隆荧光抗体染色后用流式细胞仪检测,证实所得的细胞85%以上为CD3+淋巴细胞。
3 TLR 2和4 mRNA的表达检测
按Trizo1说明书抽提总RNA。以oligod T为引物将提取的总RNA反转录,然后采用25 μL反应体系,运用PCR方法对TLR2和4及内参照β-actin同时进行PCR扩增。引物序列:TLR2:正义链5'-ggacttctcccatttccgtct-3,反义链5'-ctccaggtaggtcttggtgttc-3,产物138 bp;TLR4:正义链5'-ctgtccctgaaccctatgaact-3,反义链5'-cttctaaaccagccagaccttg-3’,产物135 bp;β-actin正义链5'-ccacgaaactaccttcaactcc-3,反义链5'-gtgatctccttctgcatcctgt-3',产物131 bp。扩增产物采用2%琼脂糖凝胶电泳分离(电泳条件:100 V,20 min),溴化乙啶(5 mg/L)紫外灯下照相,用图像分析系统分析计算吸光度值(A),表达的相对量用目的基因/β-actin A值表示。
4 MTT法测定
淋巴细胞悬液置于96孔微量细胞培养板中,每孔加入7×l09cells/L细胞100 μL,随机分成5组。同时分别加入0、1、10、50、100 μmol/L 3-O-C12-HSL 1 μL,各设6个重复孔,另设培养液空白对照孔,在37℃、5%CO2培养箱中继续培养12 h,加入20 μL MTT(5 g/L)。37℃继续培养6 h,加入150 μL DMSO低速振荡10 min。用酶联仪测定波长490 nm A值。
5 ELISA法检测TNF-α
将加入0、1、10、50、100 μmol/L 3-O-C12-HSL加入1×1010cells/L外周血单个核细胞,培养12 h后,收集培养上清,14 000 r/min离心10 min,保存于-80℃冰箱中。用人TNF-α试剂盒按其说明书进行操作。
6 统计学处理
结果
1 不同剂量3-O-C12-HSL对CD3+淋巴细胞TLR2/4 mRNA的表达
未处理组TLR2/4 mRNA表达最低,随着3-O-C12-HSL剂量的加大,单核细胞TLR 2/4 mRNA逐渐增高,仅TLR4 mRNA未处理组和1 μmol/L比较P>0.05,余组间比较P<0.05,差异显著,见图1、表1。
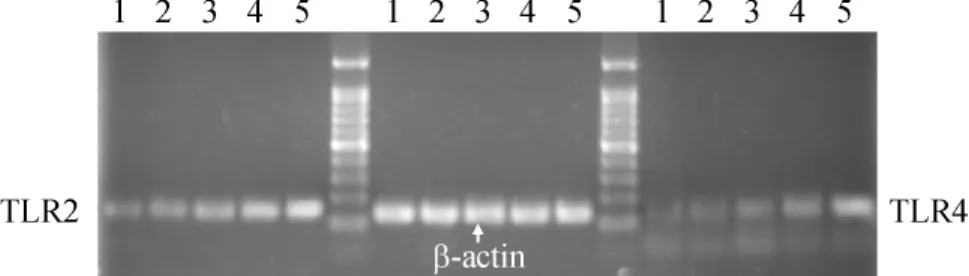
Figure 1.TLR2/4 mRNA expression in lymphocyte cells stimulated with 3-O-C12-HSL at different concentrations for 12 h.Lane 1:3-O-C12-HSL 0 μmol/L; Lane 2:1 μmol/L;Lane 3:10 μmol/L;Lane 4:50 μmol/L;Lane 5:100 μmol/L.图1 不同浓度3-O-C12-HSL刺激后CD3+淋巴细胞TLR2/4 mRNA的表达
表1 不同浓度3-O-C12-HSL刺激后淋巴细胞TLR2/4 mRNATable 1 .Comparison of TLR2/4 mRNA expression in lymphocyte cells stimulated with 3-O-C12-HSL at different concentrations for 12 h(±s.n=3)

表1 不同浓度3-O-C12-HSL刺激后淋巴细胞TLR2/4 mRNATable 1 .Comparison of TLR2/4 mRNA expression in lymphocyte cells stimulated with 3-O-C12-HSL at different concentrations for 12 h(±s.n=3)
△P<0.05 vs 0 μmol/L 3-O-C12-HSL;#P<0.05 TLR2 mRNA at same dose of 3-O-C12-HSL.
?
2 不同剂量3-O-C12-HSL对CD3+淋巴细胞活力的影响
淋巴细胞的活力与未处理组比较增高,P<0.05,差异显著。100 μmol/L 3-O-C12-HSL促进细胞增殖的作用最明显,见表2。
表2 不同浓度3-O-C12-HSL刺激淋巴细胞MTT比色结果Table 2 .Comparison of MTT results in 3-O-C12-HSL-stimulated lymphocytes(±s.n=4)

表2 不同浓度3-O-C12-HSL刺激淋巴细胞MTT比色结果Table 2 .Comparison of MTT results in 3-O-C12-HSL-stimulated lymphocytes(±s.n=4)
△P<0.05 vs 0 μmol/L 3-O-C12-HSL.
?
3 不同剂量3-O-C12-HSL对TNF-α分泌的影响
不同剂量3-O-C12-HSL作用于外周血单个核细胞12 h后,在0 μmol/L、1 μmol/L、10 μmol/L、50 μmol/L、100 μmol/L 3-O-C12-HSL浓度组,单个核细胞TNF-α分别为719.968±5.732、593.256 ±25.040、490.649 ±9.654、367.137±15.386、267.090±13.878。与0 μmol/L组相比,其余各剂量组均可抑制外周血单个核细胞上清中的TNF-α的表达(P<0.05),差异显著。100 μmol/L组3-O-C12-HSL抑制TNF-α分泌作用最明显,见图2。

Figure 2.Effect of 3-O-C12-HSL on production of TNF-α in mononuclear cells.±s.n=3.*P<0.05 vs 3-O-C12-HSL.图2 不同浓度3-O-C12-HSL抑制单个核细胞TNF-α的分泌
讨论
PA主要产生2种QS系统信号分子:3-氧十二烷酰高丝氨酸内酯[N-(3-oxododecanoyl)-L-homoserine lactone,3-O-C12-HSL]和N-丁酰基高丝氨酸内酯[N-butyryl-L-homoserine lactone,C4-HSL]。QS系统信号分子具有调节宿主免疫反应的作用。研究发现:lasI基因或lasI rhlI双基因缺失的铜绿假单胞菌不能在C57BL/6鼠肺部形成感染模型[3]。QS系统缺陷铜绿假单胞菌与相对应的野生型比较诱导HCE细胞产生IL-8能力降低[4]。3-O-C12-HSL能够诱导巨噬细胞的细胞毒性导致凋亡[7]。将3-OC12-HSL直接注射到小鼠皮肤里,其可通过NF-κB通路导致某些细胞因子的分泌,检测发现皮肤组织中的IL-1、IL-6、MIP-2、MIP-1 mRNAs表达增高[5]。
TLRs是一组与固有免疫密切相关的受体家族[6]。可介导固有免疫应答的产生和细胞因子的分泌[7]。TLR 2、TLR4在非特异性免疫中可广泛识别配体,在识别危险信号并诱发机体免疫反应中具有重要作用。感染后细胞TLR2和TLR4表达上调,并可诱导合成一系列炎性介质,是机体免疫系统对感染的一种防御反应,清除外来病原菌。目前对于抗原呈递细胞上TLRs研究较透彻,而淋巴细胞上的TLRs研究较少,多集中在调节性T细胞上。研究表明,TLR2可以引起调节性T细胞(T regulate cell,Treg)增殖,但同时Treg抑制活性发生了一过性消除;随着TLR2配体的清除,Treg抑制活性可以完全恢复。离体实验显示,细菌产物可以直接作用于Treg的TLR4,增强Treg的抑制活性[8,9]。
本研究结果表明,不同浓度的3-O-C12-HSL刺激单个核细胞后,淋巴细胞TLR 2、TLR4表达几乎均上调,TLR2亚家族的上调较TLR4为明显,提示TLR 2、TLR4上调不仅仅是增殖的结果,3-O-C12-HSL可影响淋巴细胞TLR 2、TLR4的不同表达,其原因可能为TLR 2、TLR4对3-O-C12-HSL的刺激有着明显的差异,TLR 2对3-O-C12-HSL更易感。其次RT-PCR检测存在一定误差,可通过实时定量PCR进一步证实。此外,3-O-C12-HSL能诱导淋巴细胞的增殖,与Hooi等[10]报道的QS系统可以通过抑制T细胞的增殖,扰乱免疫调节活动的结果不一致,这可能与Hooi等[10]直接用3-O-C12-HSL刺激淋巴细胞,而本研究是用3-O-C12-HSL刺激单个核细胞后,然后收集淋巴细胞有关,其原因可能为3-O-C12-HSL刺激单核细胞后,其分泌的细胞因子影响淋巴细胞TLR 2、TLR4表达有关。本研究发现TNF-α表达是随着3-O-C12-HSL增高而降低,而Kim等[11]发现CD4+CD25+Foxp3-或CD8+T细胞能够抑制不同固有免疫细胞的细胞因子的释放。因此,我们推测淋巴细胞的TLR 2、TLR4表达抑制了TNF-α表达,获得性免疫对固有免疫有反馈作用。至于是哪种(CD4+或CD8+)淋巴细胞亚型的增高,以及该亚群淋巴细胞的增高,对细胞内信号转导的影响,尚不清楚,还需进一步深入研究和探讨。
[1] Bauer TT,Torres A,Ferrer R,et al.Biofilm formation in endotracheal tubes.Association between pneumonia and the persistence of pathogens[J].Monaldi Arch Chest Dis,2002,57(1):84-87.
[2] Saleh AC,Figarella W,Kammouni S,et al.Pseudomonas aeruginosa quorum-sensing signal molecule N-(3-oxododecanoyl)-L-homoserine lactone inhibits expression of P2Y receptors in cystic fibrosis tracheal gland cells[J]. Infect Immun,1999,67(10):5076-5082.
[3] Smith RS,Harris SG,Phipps R,et al.The Pseudomonas aeruginosa quorum-sensing molecule N-(3-oxododecanoyl)homoserine lactone contributes to virulence and induces inflammation in vivo[J].J Bacteriol,2002,184 (4):1132-1139.
[4] Zhu H,Conibear TC,Thuruthyil SJ,et al.Pseudomonas aeruginosa quorum-sensing signal molecules induce IL-8 production by human corneal epithelial cells[J].Eye Contact Lens,2008,34(3):179-181.
[5] Tateda K,Ishii Y,Horikawa M,et al.The Pseudomonas aeruginosa autoinducer N-3-oxododecanoyl homoserine lactone accelerates apoptosis in macrophages and neutrophils[J].Infect Immun,2003,71(10):5785-5793.
[6] 田 青,周 恒,王 蕾,等.Toll样受体3在自身免疫性心肌炎小鼠心肌细胞中的表达及意义[J].中国病理生理杂志,2009,25(12):2323-2328.
[7] 刘 颖,郑春泉.Toll样受体和免疫性疾病[J].中国眼耳鼻喉科杂志,2008,8(1):58-60.
[8] Sutmuller RP,den Brok MH,Kramer M,et a1.Tolllike receptor 2 controls expansion and function of regulatory T cells[J].J Clin Invest,2006,116(2):485-494.
[9] Caramalh I,Lopes-carvalho T,Ostler D,et al.Regulatory T cells selectively express Toll-like receptors and activated by lipopolysaccharide[J].J Exp Med,2003,197 (4):403-411.
[10]Hooi DS,Bycroft BW,Chhabra SR,et al.Differential immune modulatory activity of Pseudomonas aeruginosa quorum-sensing signal molecules[J].Infect Immun,2004,72(11):6463-6470.
[11]Kim KD,Zhao J,Auh S,et al.CD4+CD25+Foxp3+Tregs resolve experimental lung injury in mice and are present in humans with acute lung injury[J]Nat Med,2007,13(10):1248-1252.
