Tregs调节小鼠肝癌局部引流淋巴结内免疫效应细胞的功能*
2010-03-17汪礼坤彭宝岗李绍强华赟鹏
汪礼坤, 匡 铭, 彭宝岗, 何 强, 李绍强, 华赟鹏, 陈 斌, 王 晔
(中山大学附属第一医院肝胆外科,广东广州510080)
肝细胞癌(hepatocellular carcinoma,HCC)发病率居世界最常见癌症第5位,居最常见癌症死亡原因第3位。目前早期肝细胞癌传统的治疗方法包括外科手术切除、肝脏移植和局部消融(射频消融或无水酒精注射),其5年生存率达到50%-70%,但较高的复发率影响手术切除和局部消融的疗效,辅助治疗难以预防复发,且肝脏移植仍存在供体短缺问题[1]。
肝细胞癌免疫治疗方法包括过继免疫活性细胞、应用呈递肿瘤抗原的树突状细胞或肿瘤疫苗等措施,临床应用表明可产生不同程度的免疫效应,影响肝癌病人的复发率和生存率[2]。然而肿瘤免疫抑制微环境与肿瘤抗原弱免疫原性不利于免疫效应细胞发挥作用和激发产生抗肿瘤免疫反应。临床研究显示小肝癌局部肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)高浓度的患者肝切除术后的复发率显著低于肿瘤局部无淋巴细胞浸润者[3],而调节性T细胞(regulatory T cells,Tregs)使TILs功能低下[4]。CD4+CD25+Foxp3+Treg不仅调节自体免疫耐受[5],而且通过其免疫抑制作用影响抗肿瘤免疫反应的产生,促进肿瘤进展,维持肿瘤免疫耐受微环境,影响临床免疫治疗疗效[6,7]。肿瘤病人存在免疫抑制现象,肿瘤引起机体免疫耐受和抑制抗肿瘤免疫效应的产生及机制有待阐明。许多证据表明肿瘤引流淋巴结(tumor-draining lymph nodes,TDLNs)体积虽小,却是一个免疫特惠/耐受位点,TDLNs内抗原提呈细胞(APCs)的表型和功能发生活性改变,呈递肿瘤抗原偏向于耐受产生,在产生和维持肿瘤抗原获得性外周耐受进而导致全身耐受中发挥重要作用。已知TDLNs内Treg数量增加且抑制活性增强[8],Tregs可能是影响TDLNs免疫状态的关键因素,然而其确切机制尚未阐明。本研究旨在通过建立小鼠肝癌TDLNs模型,探讨TDLNs内Tregs影响机体全身免疫耐受状态和抑制特异性抗肿瘤免疫反应的作用及机制。
材料和方法
1 主要试剂
RPMI-1640培养基和Trizol试剂购自Invitrogen,细菌脂多糖(LPS,L2880)购自Sigma,免疫组化Ⅰ抗 rabbit anti-mouse Foxp3、rat anti-mouse CD4、rat anti-mouse CD8均购自Biolegend,兔二步法和大鼠二步法检测试剂盒(Ⅱ抗)购自北京中杉金桥。流式细胞术抗体APC-conjugated anti-mouse Foxp3、FITC-conjugated anti-mouse CD4和PE-conjugated anti-mouse CD25均购自eBioscience。RT-PCR kit和SYBR green realtime PCR master mix购自Toyobo。Anti-CD3抗体(clone:145-2C11)购自eBioscience。小鼠IFN-γ酶联免疫斑点法(enzyme-linked immunosorbent spot technique,ELISPOT)试剂盒购自R&D Systems。
2 Hepa1-6细胞培养
Hepa1-6肝癌细胞株来源于C57BL/6J小鼠的化学诱导肝肿瘤。应用含10%FBS、100 mg/L青霉素G和1×105U/L链霉素的RPMI-1640培养基在37℃、5%CO2环境培养箱内培养Hepa1-6细胞,传代后收集细胞。
3 建立小鼠肝癌TDLNs模型
6-8周龄大小雌性C57BL/6J小鼠购自中山大学和南方医科大学实验动物中心,饲养于中山大学实验动物中心。悬浮于20 μL PBS的Hepa1-6细胞(6×105cells)注射于每只小鼠右后肢足掌皮下,观察肿瘤生长,每隔3 d测量肿瘤长径。第12 d处死小鼠,获取足掌肿瘤侧的腘淋巴结(TDLNs)并称重,同时获取同侧腹股沟淋巴结(第二站引流淋巴结)以及脾脏,小鼠肿瘤足重量减去对侧正常足重量测得肿瘤重量,最后剖检小鼠,观察肺、肝外观及有无转移结节。作为对照,细菌脂多糖(LPS)溶于蒸馏水中,浓度1 g/L,每只小鼠右后肢足掌皮下每天注射20 μg,连续2 d,2 d后处死小鼠并收集上述淋巴结标本和脾脏。
4 免疫组织化学染色
Foxp3染色所用标本为4%多聚甲醛固定,常规石蜡包埋,每例蜡块连续切片数张,厚4 μm,1张备染,其余行HE染色,镜下观察有无肿瘤细胞淋巴结转移。组织切片置柠檬酸缓冲液(pH 6.0)中高压抗原修复4 min,0.3%Triton破膜40 min,室温放置于3%H2O2中15 min以阻断内源性过氧化物酶,滴加Ⅰ抗rabbit anti-mouse Foxp3(稀释度1∶150),4℃孵育过夜,加Ⅱ抗室温孵育2.5 h,DAB显色。CD8和CD4染色采用OCT包埋的新鲜标本的冰冻切片(厚6 μm),4℃丙酮固定切片10 min,-20℃保存备用。CD8和CD4Ⅰ抗稀释度1∶200,滴加Ⅰ抗后室温孵育3 h,加Ⅱ抗室温孵育1.5 h,DAB显色。
5 流式细胞术检测
采用细针头刺入淋巴结或脾脏,再向组织内注入细胞培养基,将细胞冲出,然后用塑料针芯钝端在培养基中轻压组织,最后通过不锈钢筛网(孔径75 μm)过滤制成单细胞悬液,脾脏组织制成的单细胞悬液再加入红细胞裂解液,反复冲洗2次。APC-conjugated anti-mouse Foxp3、FITC-conjugated anti-mouse CD4和PE-conjugated anti-mouse CD25 3种抗体用以标记Tregs,操作按说明书步骤进行。
6 实时定量PCR检测
通过Trizol试剂从淋巴结和脾脏组织抽提总RNA,按照RT-PCR kit的操作步骤合成cDNA。应用SYBR green染料法,通过ABI7000定量PCR仪检测,扩增条件:95℃变性60 s,95℃15 s,60℃15 s,72℃ 45 s,进行40个循环。引物如下:小鼠Foxp3,5′-GGG AGC AGT GTG GAC CGT AG-3′,5′-CCA CAG CCT CAG TCT CAT GGT-3′;小鼠β-actin,5′-CTT CAA CAC CCC AGC CAT GT-3,5′-TGG CGT GAG GGA GAG CAT AG-3′。结果根据目标基因相对于内参照 β -actin的△Ct值 = 2-(Ct[Foxp3]﹣Ct[β-actin])进行分析。
7 ELISPOT检测
按上述方法从淋巴结和脾脏制成的单细胞悬液(8×106-1×107cells)加入6孔板或预包被anti-CD3抗体的6孔板中,每孔2 mL RPMI-1640培养基(含10%FBS、2 mmol/L L-glutamine、25 mmol/L Hepes、100 mg/L penicillin G和1×105U/L streptomycin),置入37℃、5%CO2培养箱内培养48 h后收集淋巴细胞并计数,然后在小鼠IFN-γ ELISPOT试剂盒96孔板中进行细胞种板,重复3孔,设阴性和阳性对照孔,按试剂盒操作说明依次加入生物素化检测抗体(biotinylated detection Ab)、抗生蛋白链菌素碱性磷酸酶(streptavidin-alkaline phosphatase)和BCIP/NBT发色团(BCIP/NBT chromagen),每步骤之间均以冲洗液反复冲洗,37℃烤干30 min后应用ImmunoSpot Series 3B Analyzer(CTL,Cleveland,OH)进行斑点计数并分析,数据结果以1×106接种细胞中形成IFN-γ斑点细胞数(IFN-γ spot-forming cells,SFCs)表示。实验设定≥30 IFN-γ SFC/ 106cells为特异性淋巴细胞分泌反应阳性,与评估人外周血单个核细胞(PBMCs)对记忆抗原刺激阳性反应的标准一致[9]。
8 统计学处理
结果
1 小鼠足掌肿瘤生长速度和TDLNs组织学改变
Hepa1-6细胞接种小鼠足掌皮下后第4 d可见足掌中心局部稍隆起,呈暗紫褐色,此后足掌肿瘤逐渐增大。第12 d肿瘤长径达5 mm(图1A),重量为(0.0614 ± 0.0250)g,同时肿瘤侧腘淋巴结(TDLNs)重量为(0.0042±0.0002)g,明显大于对侧腘淋巴结[(0.0007±0.0001)g,P<0.01]和足掌注射LPS组小鼠炎性腘淋巴结的重量[(0.0009± 0.0001)g,P<0.01],且体积较肿瘤同侧的腹股沟淋巴结大(图1B)。HE染色镜下见TDLNs内淋巴细胞密集,生发中心扩增,未见淋巴结中心髓窦扩大和淋巴液增多现象(图4A)。
2 TDLNs中CD4+T细胞和CD8+T细胞扩增
除TDLNs体积较正常腘淋巴结明显增大外,免疫组化显示 TDLNs的髓质和副皮质区 CD4+和CD8+两类T淋巴细胞数量明显增多(图4B、C)。
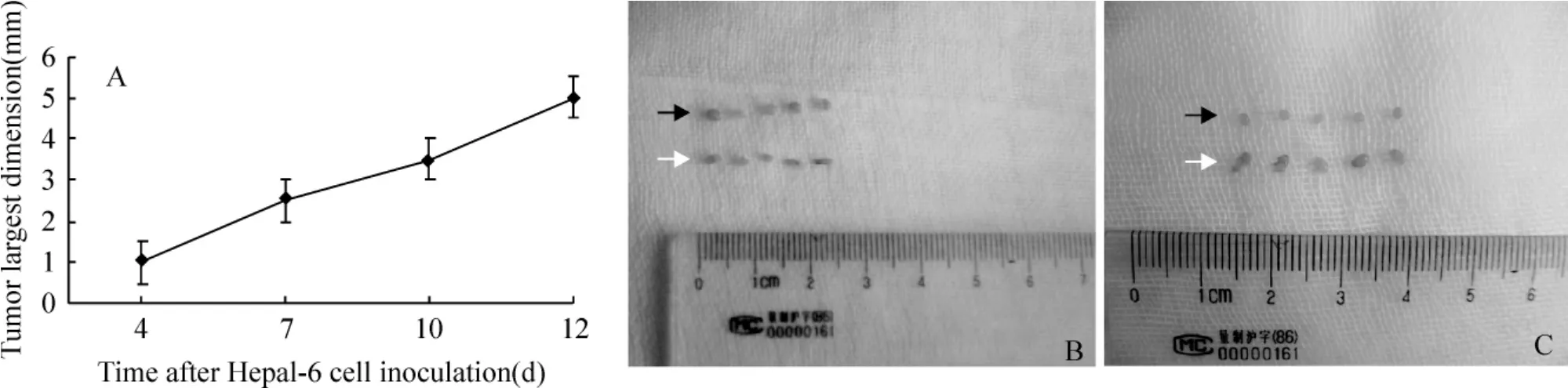
Figure 1.Growth curve of Hepa1-6 tumor after Hepa1-6 footpad challenge.A:footpad tumor largest dimension was measured every three days after Hepa1-6 cells(6×105cells)were injected s.c.into the footpad of right hind limb of each mouse(n= 20);B:representative photographs of tumor-draining lymph nodes(popliteal lymph nodes)(black arrow)and inguinal lymph nodes(white arrow)12 d after inoculation;C:representative photographs of draining popliteal lymph nodes(black arrow)and inguinal lymph nodes(white arrow)two days after LPS footpad injection.图1 小鼠足掌肿瘤生长曲线和腘淋巴结、腹股沟淋巴结大小改变
3 Foxp3+Tregs在TDLNs中聚集
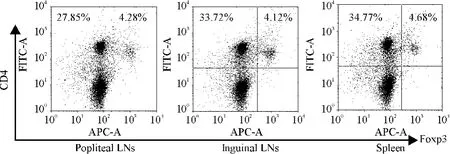
Figure 2.Analysis of CD4+Foxp3+T cell frequency.A representative flow cytometry data showed the frequency of CD4+lymphocytes and CD4+Foxp3+T cells in the popliteal lymph nodes(TDLN),inguinal lymph nodes and spleen,which were obtained from two mice 12 d after Hepa1-6 inoculation.Frequency of CD4+ Foxp3+T cells after tumor inoculation respectively was 13.32%,10.88%and 11.86%of total CD4-positive cells.Frequency of CD4+CD25+T cells(data not shown)was slightly higher than that of CD4+ Foxp3+T cells because CD4+CD25+Foxp3+T cells were really Tregs.图2 肿瘤引流腘淋巴结、同侧腹股沟淋巴结及脾脏组织中CD4+CD25+Foxp3+T细胞流式细胞仪分析
转录因子Foxp3是Tregs的特异标志[10]。流式细胞分析显示TDLNs中CD4+CD25+Foxp3+T细胞占CD4+T细胞总数的13.32%,大于在腹股沟淋巴结(10.88%)和脾脏(11.86%)中的比例,见图2。实时定量PCR结果显示小鼠TDLNs内Foxp3 mRNA表达水平明显高于同侧腹股沟淋巴结(0.01393± 0.00283 vs 0.01045±0.00308;P<0.01)和脾脏(0.01393±0.00283 vs 0.01039±0.00362;P< 0.01),而腹股沟淋巴结和脾脏之间的表达水平无显著差异(P>0.05)。荷瘤小鼠TDLNs和脾脏Foxp3 mRNA的表达水平明显高于足掌注射LPS的对照组小鼠炎性腘淋巴结(0.01393±0.00283 vs 0.00743± 0.00378;P<0.01)和脾脏(0.01039±0.00362 vs 0.00549±0.00383;P<0.01)的表达水平,见图3。荷瘤小鼠TDLNs、同侧腹股沟淋巴结和脾脏免疫组化染色的结果显示Foxp3定位于细胞核,Foxp3阳性细胞弥散分布于T细胞区,与淋巴结内CD8+T细胞分布区域基本一致。与同侧腹股沟淋巴结和脾脏相比,TDLNs内的Foxp3阳性细胞数量最多,见图4D、E、F。

Figure 3.Foxp3 expression in lymph nodes and spleen.Relative quantity of Foxp3 mRNA by real-time PCR using the ΔCt method(n=20)in draining lymph nodes and spleen 12 d after Hepa1-6 footpad inoculation or 2 d after LPS footpad injection.**P<0.01 vs popliteal LNs in Hepa1-6-inoculated mice;##P<0.01 vs spleen in LPS-injected mice.图3Foxp3 mRNA表达实时定量PCR结果
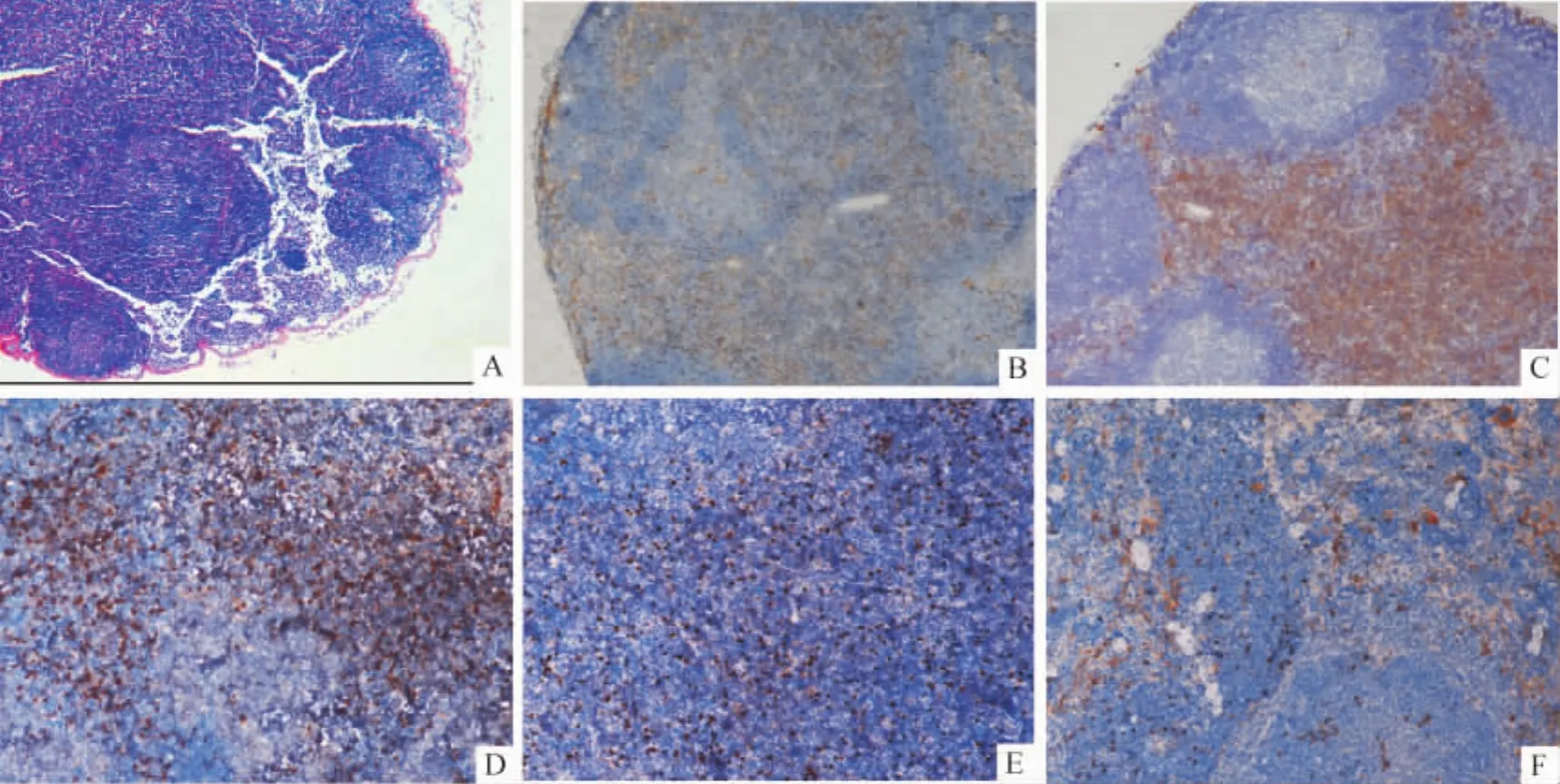
Figure 4.Representative features of CD4+,CD8+,or Foxp3+T lymphocytes in TDLNs(popliteal lymph nodes)and Foxp3+T lymphocytes in inguinal lymph nodes and spleen after Hepa1-6 inoculation(A,B,C,×100);(D,E,F,×200).TDLN(AD),inguinal lymph nodes(E)and spleen(F).HE staining(A)and immunostaining for CD4(B),CD8(C),and Foxp3(D,E,and F).图4 CD4,CD8和Foxp3免疫组织化学染色
4 Treg抑制TDLNs内CD8+T细胞分泌IFN-γ的功能
由淋巴结和脾脏制成的单个淋巴细胞悬液经过单纯培养基培养或anti-CD3抗体刺激激活后种板观察显示:荷瘤小鼠TDLNs、同侧腹股沟淋巴结和脾脏分泌IFN-γ的细胞计数分别为2、0和0 IFN-γSFC/106cells。经anti-CD3抗体激活处理后,荷瘤小鼠TDLNs、同侧腹股沟淋巴结和脾脏分泌IFN-γ的细胞计数上升为179、54和13 IFN-γ SFC/106cells,而足掌注射LPS的炎性腘淋巴结、同侧腹股沟淋巴结和脾脏分泌IFN-γ的细胞计数分别为6、19和20 IFN-γ SFC/106cells,见图5。
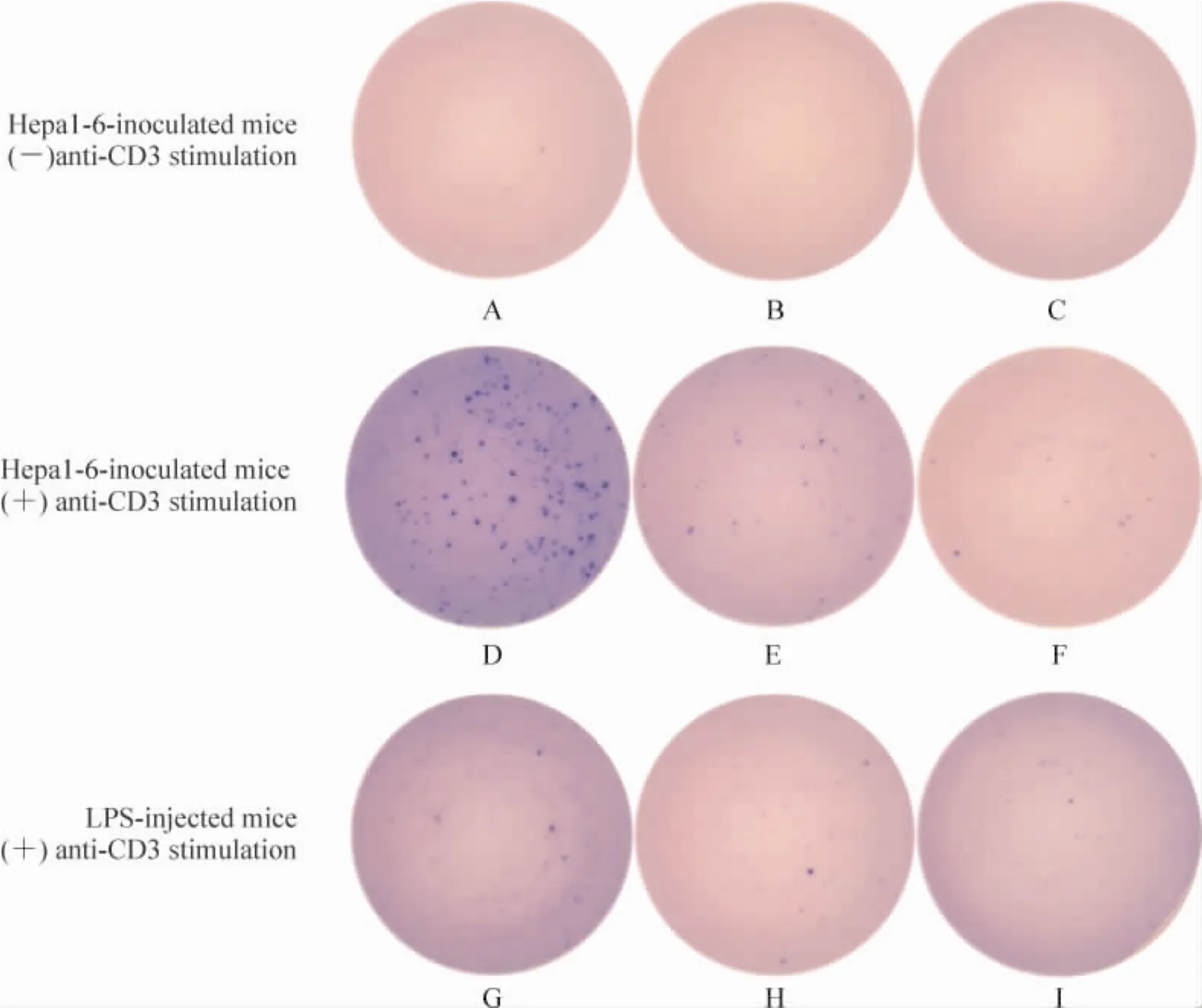
Figure 5.Detection of CD8+T cells by IFN-γ ELISPOT in the draining lymph nodes and spleen(n=10).The same pool of lymphocytes were plated 48 h after single-cell suspension from popliteal lymph nodes(A,D,G),inguinal lymph nodes(B,E,H),and spleen(C,F,I)was stimulated via anti-CD3 Ab or was cultured in the absence of anti-CD3 stimulation. Representative wells were shown after plate development and spots quantified by automated digital image analysis.Responses are reported as SFC/106input cells.图5 ELISPOT观测CD8+T细胞IFN-γ分泌功能
讨论
研究证实肿瘤可以使 TDLNs内高内皮静脉(HEV)被重构改造成血管、淋巴窦增多并扩张和淋巴液增加等结构和功能改变[11,12],而我们建立的小鼠Hepa1-6肝细胞癌肿瘤引流腘淋巴结内未发现明显的类似结构改变,而主要表现为淋巴细胞扩增聚集,提示不同肿瘤细胞系发生区域淋巴结转移的潜能存在差异,因此可能引起TDLNs不同的形态结构改变。
我们的研究显示TDLNs重量与体积明显大于足掌注射LPS的炎性腘淋巴结,CD4+和CD8+2类T淋巴细胞在TDLNs中明显扩增,表明TDLNs内发生了与炎症引流淋巴结不同程度或特征性的免疫应答反应。
肿瘤进展引起TDLNs中的Tregs和抗肿瘤效应性T细胞被初始化,两者之间的相互作用决定了TDLNs的免疫状态[13]。临床研究显示Tregs在调控机体对肝细胞癌的免疫反应中发挥关键作用,其具有的免疫抑制效应使 TILs功能低下[4,14,15]。表达Foxp3是Tregs的基本特征,同时也是鉴别Tregs的特异标志[16]。我们的研究发现随着肝细胞癌逐渐生长成瘤,Foxp3+Tregs首先聚集于TDLNs,数量明显增加,而非TDLNs(腹股沟淋巴结)和脾脏中却无Tregs数量扩增现象,提示TDLNs在形成机体对肿瘤免疫耐受的过程中是一个启动位点。已有研究发现移植耐受条件下Tregs聚居外周淋巴结内而非脾脏对于主动维持移植物耐受是必需的[17]。体外实验表明培养的肝细胞癌细胞系上清液导致CD4+CD25+调节性T细胞扩增且抑制功能增强[18]。因此我们认为引流进入TDLNs的肿瘤抗原或肿瘤分泌因子可能诱导天然的Tregs扩增或Tregs由CD4+T细胞新生而来。
肿瘤主动地改变了肿瘤引流淋巴结的免疫微环境,表现为 Tregs较均匀弥散地分布于 CD4+或CD8+T细胞聚居的副皮质和髓质区。这种分布方式促使细胞间直接相互接触,进而Tregs通过表达CD86和CD4+效应T细胞的CTLA-4相互作用而抑制其发挥效应功能[13],然而有研究认为Tregs表达并分泌TGF-β是抑制CD8+T细胞功能的一种机制[19,20],我们的研究显示Tregs弥散分布模式也符合细胞因子局部发挥作用的特性,因而可以认为Tregs分泌的细胞因子影响其周围的CD8+T细胞的功能。CD8+T细胞在抗肿瘤免疫中具有至关重要的作用,我们的研究发现TDLNs中CD8+T细胞的功能受到了抑制,这种抑制并未使CD8+T细胞彻底丧失效应功能,在一定的条件下CD8+T细胞仍可对外界刺激产生应答并恢复分泌IFN-γ能力。因此,消除TDLNs内Tregs对特异性抗肿瘤效应细胞的抑制,打破Tregs维持的TDLNs免疫耐受环境或TDLNs的效应细胞在体外经短期激活和扩增用于过继免疫治疗可能成为一种有效的肿瘤免疫治疗新途径。
[1] Bruix J,Llovet JM.Major achievements in hepatocellular carcinoma[J].Lancet,2009,373(9664):614-616.
[2] Butterfield LH.Recent advances in immunotherapy for hepatocellular cancer[J].Swiss Med Wkly,2007,137(5-6):83-90.
[3] Wada Y,Nakashima O,Kutami R,et al.Clinicopathological study on hepatocellular carcinoma with lymphocytic infiltration[J].Hepatology,1998,27(2):407-414.
[4] Unitt E,Rushbrook SM,Marshall A,et al.Compromised lymphocytes infiltrate hepatocellular carcinoma:the role of T-regulatory cells[J].Hepatology,2005,41(4):722-730.
[5] Sakaguchi S.Regulatory T cells:key controllers of immunologic self-tolerance[J].Cell,2000,101(5):455-458.
[6] Zou W.Regulatory T cells,tumor immunity and immunotherapy[J].Nat Rev Immunol,2006,6(4):295-307.
[7] Curiel TJ.Regulatory T cells and treatment of cancer[J]. Curr Opin Immunol,2008,20(2):241-246.
[8] Munn DH,Mellor AL.The tumor-draining lymph node as an immune-privileged site[J].Immunol Rev,2006,213:146-158.
[9] Currier JR,Kuta EG,Turk E,et al.A panel of MHC class I restricted viral peptides for use as a quality control for vaccine trial ELISPOT assays[J].J Immunol Methods,2002,260(1-2):157-172.
[10]Fontenot JD,Gavin MA,Rudensky AY.Foxp3 programs the development and function of CD4+CD25+regulatory T cells[J].Nat Immunol,2003,4(4):330-336.
[11]Qian CN,Berghuis B,Tsarfaty G,et al.Preparing the“soil”:the primary tumor induces vasculature reorganization in the sentinel lymph node before the arrival of metastatic cancer cells[J].Cancer Res,2006,66(21): 10365-10376.
[12]Harrell MI,Iritani BM,Ruddell A.Tumor-induced sentinel lymph node lymphangiogenesis and increased lymph flow precede melanoma metastasis[J].Am J Pathol,2007,170(2):774-786.
[13]Hiura T,Kagamu H,Miura S,et al.Both regulatory T cells and antitumor effector T cells are primed in the same draining lymph nodes during tumor progression[J].J Immunol,2005,175(8):5058-5066.
[14]Ormandy LA,Hillemann T,Wedemeyer H,et al.Increased populations of regulatory T cells in peripheral blood of patients with hepatocellular carcinoma[J].Cancer Res,2005,65(6):2457-2464.
[15]Kobayashi N,Hiraoka N,Yamagami W,et al.Foxp3+regulatory T cells affect the development and progression of hepatocarcinogenesis[J].Clin Cancer Res,2007,13 (3):902-911.
[16]陈莉娟,周 浩,朱剑文,等.Foxp 3转染小鼠CD4+CD25-T细胞抑制NK细胞活性[J].中国病理生理杂志,2009,25(6):1151-1155.
[17]Ochando JC,Yopp AC,Yang Y,et al.Lymph node occupancy is required for the peripheral development of alloantigen-specific Foxp3+regulatory T cells[J].J Immunol,2005,174(11):6993-7005.
[18]Cao M,Cabrera R,Xu Y,et al.Hepatocellular carcinoma cell supernatants increase expansion and function of CD4+CD25+regulatory T cells[J].Lab Invest,2007,87 (6):582-590.
[19]Chen ML,Pittet MJ,Gorelik L,et al.Regulatory T cells suppress tumor-specific CD8 T cell cytotoxicity through TGF-beta signals in vivo[J].Proc Natl Acad Sci USA,2005,102(2):419-424.
[20]Somasundaram R,Jacob L,Swoboda R,et al.Inhibition of cytolytic T lymphocyte proliferation by autologous CD4+/CD25+regulatory T cells in a colorectal carcinoma patient is mediated by transforming growth factor-beta[J].Cancer Res,2002,62(18):5267-5272.
