年轻骨髓间充质干细胞可通过细胞融合改善年老骨髓间充质干细胞功能*
2010-03-17陈敏生杨伟健张振辉刘世明
黎 佼, 陈敏生, 杨伟健, 张振辉, 钟 赟, 刘世明
(广州医学院第二附属医院心内科,广州心血管疾病研究所,广东广州510260)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)对间充质组织功能的维持和修复起重要作用。多项实验和临床研究表明:BMSCs具有分化与修复心肌组织的潜力,能够改善心功能。干细胞在修复心肌治疗中起重要作用。与年龄相关的心脑血管疾病以及肝脏、皮肤和骨骼等器官或组织的退行性疾病的发生,可能与干细胞数量减少和功能下降有关。近几年研究发现年老供体来源与年轻供体来源干细胞相比,细胞功能下降[1]。供体骨髓干细胞的年龄因素可能是影响心肌梗死后干细胞修复心肌效果的重要因素。最近细胞融合机制成功解释了骨髓来源的干细胞通过细胞融合如何使病变的肝脏细胞、心肌细胞等细胞再生。本研究探讨了年轻BMSCs通过细胞融合对年老BMSCs功能的影响及其意义。
材料和方法
1 主要试剂
细胞培养粉(iscove's modified Dulbecco's medium,IMDM)、胎牛血清(fetal bovine serum,FBS)、细胞培养液 (Dulbecco's modified Eagle's medium,DMEM)均购自 Gibco;氨苄青霉素、硫酸链霉素、PKH26试剂盒、异丁基甲基黄嘌呤、EDTA、胰岛素、地塞米松、吲哚美辛、油红O染色剂、VitC、β磷酸甘油钠、茜素红染色剂均购自 Sigma;大鼠抗小鼠CD44、Sca-1、CD34、CD117、CD31、CD45单克隆抗体及羊抗鼠 IgG AlexaFluor 633抗体均购自 BD Pharmingen;DAPI核酸染色剂购自Invitrogen;聚乙烯二醇购自Roche。
2 动物
年轻普通C57BL/6小鼠、年轻绿色荧光蛋白转基因 C57BL/6小鼠、年轻红色荧光蛋白转基因C57BL/6小鼠(2-3月龄);年老普通C57BL/6小鼠、年老绿色荧光蛋白转基因C57BL/6小鼠(18-24月龄),均由Tac提供。
3 小鼠BMSCs的分离和培养
小鼠麻醉处死后,在无菌条件下取出股骨,将骨髓冲出至无菌管中,将骨髓吹打均匀,制成细胞悬液,加入25 mL含10%FBS的IMDM培养液,接种于175 cm2培养瓶中,置于37℃、5%CO2培养箱中常规培养,3 d后用PBS液洗掉非贴壁细胞,换培养液继续培养,细胞长满80%时用0.25%胰酶消化传代培养。
4 细胞融合
实验分为5组:(1)年轻BMSCs组(young,Y); (2)年老BMSCs组(old,O);(3)PKH26标记的年轻BMSCs和绿色荧光蛋白转基因年轻BMSCs融合组(Y-Y);(4)PKH26标记的年轻BMSCs和绿色荧光蛋白转基因年老BMSCs融合组 (Y-O);(5) PKH26标记的年老BMSCs和绿色荧光蛋白转基因年老BMSCs融合组(O-O);取C57BL/6小鼠第3代BMSCs,按 PKH26染色说明书操作。取 1× 107cells 1 200 r/min离心5 min,用IMDM培养液洗涤细胞1次,加0.5 mL稀释剂C(PKH26试剂盒配套试剂)重悬细胞。将BMSCs悬液快速加至混合染料应用液中(2 μL PKH26加0.5 mL稀释剂C)混匀,在25℃无菌条件下孵化5 min,期间轻柔翻转离心管以确保混匀;加1 mL FBS终止染色,25℃孵化1 min,再加2 mL含10%FBS的IMDM培养液稀释。1 200 r/min离心10 min,转移细胞至另一离心管。含10%FBS的IMDM培养液洗涤3次后,进行细胞计数。取不同年龄组等量BMSCs混合离心后,用IMDM培养液洗涤细胞1次,去上清,1 min内缓慢加入37℃预热的PEG 1500(90 μL/1×106cells),边滴边混匀细胞1 min。4 min内缓慢加入4 mL 37℃预热的含10%FBS的IMDM培养液,边滴边混匀细胞。加入10 mL 37℃预热的含10%FBS的IMDM培养液37℃孵化5 min后离心,进行细胞计数。置于37℃、5%CO2培养箱中常规培养,24 h后换入新鲜含10%FBS的IMDM培养液,培养7 d。
5 融合细胞的鉴定和形态观察
取融合后培养7 d的BMSCs,1 200 r/min离心5 min,PBS洗涤2次,将细胞重悬于500 μL PBS中,经流式细胞仪检测细胞膜表面荧光蛋白的表达。取融合后培养7 d的BMSCs及普通BMSCs,1 200 r/min离心5 min,用冷清洗液(含1%FBS的PBS)洗涤2次,分别滴加大鼠抗小鼠抗体CD44(1∶50)、Sca-1 (1∶20)、CD34(1∶50)、CD117(1∶50)、CD31(1∶400)、CD45(1∶40)混匀后4℃反应60 min;冷清洗液洗2次,加入羊抗鼠IgG抗体(1∶200)4℃反应60 min,低温离心5 min弃上清;冷PBS洗2次,流式细胞仪检测,存取数据后分析。年轻绿色荧光蛋白转基因C57BL/6小鼠与年轻红色荧光蛋白转基因C57BL/6小鼠BMSCs融合,分别培养7 d、14 d、21 d,用DAPI对细胞核染色,在免疫荧光显微镜下观察细胞形态及细胞核特征。
6 细胞增殖能力检测
将5组细胞分别接种于直径35 mm的培养皿中(1×103cells/cm2)。在第1、2、4、6、8 d,胰酶消化细胞,血细胞计数仪对细胞进行计数。
7 BMSCs成骨细胞分化能力检测
将5组细胞分别接种于直径35 mm的培养皿中(1×103cells/cm2)。细胞在含10%FBS的IMDM培养液中培养24 h后,换诱导液培养,每3 d换1次液,培养3周。诱导液为1×10-4mmol/L地塞米松,0.05 mmol/L VitC,10 mmol/L β磷酸甘油钠,含10%FBS低糖DMDM培养液。3周后细胞用PBS洗涤1次,70% 冰乙醇固定1 h。茜素红室温染色10 min后蒸馏水洗涤。在显微镜下,每个培养皿随机选取3个区域,用Image J软件对染色阳性区域进行定量分析。
8 BMSCs脂肪细胞分化能力检测
将5组细胞分别接种于直径35 mm的培养皿中(1×103cells/cm2)。细胞在含10%FBS的IMDM培养液中培养24 h后,换诱导液培养,每3 d换1次液,培养3周。诱导液为含1×10-3mmol/L地塞米松、0.5 mmol/L异丁基甲基黄嘌呤、0.01 mmol/L胰岛素、0.2 mmol/L吲哚美辛的含10%FBS的DMDM培养液。3周后细胞用PBS洗涤1次,4%多聚甲醛固定10 min,60%异丙醇洗涤1次,油红O室温染色5 min后,60%异丙醇及蒸馏水各洗涤1次。在显微镜下,每个培养皿随机选取3个区域,用Image J软件对染色阳性区域进行定量分析。
9 统计学处理
结果
1 细胞融合率测定
PKH26标记的普通小鼠BMSCs细胞膜表达红色荧光,绿色荧光蛋白转基因小鼠BMSCs细胞膜表达绿色荧光。红色荧光及绿色荧光均表达的为融合细胞。以融合细胞数除以观察的总细胞数即为细胞融合率。细胞融合率百分数可达30.45%±4.13%,3组融合组间无显著差异[(29.41% ±3.00%)vs(30.54± 1.20%)vs(31.41%±6.63%),P>0.05],见图1。

Figure 1.The fusion rate(%)of the three fusion groups detected by flow cytometry.Young(Y,2-3 months)and old(O,18-24 months)C57BL/6 mice BMSCs labeled with PKH26 membrane fluorescent kit were fused with young and old GFP transgenic C57BL/6 mice BMSCs by using PEG 1500.30.45%±4.13%fusion cells were obtained,and there were no significant difference in the fusion rate from three groups(Y-Y group,Y-O group,O-O group).±s.n=7.图1 流式细胞仪检测细胞融合率
2 融合细胞形态特征及表面抗原表达
免疫荧光显微镜下红色荧光及绿色荧光均表达的为融合细胞(黄色)。诱导融合培养7 d时,可见正在融合的双核或已完全融合的单核融合细胞;培养14 d及21d时只见已完全融合的单核融合细胞,见图2。流式细胞仪检测普通BMSCs及融合BMSCs表面特异性抗原表达结果显示,表达BMSCs特异性抗原CD44(94.48%±2.20%)、Sca-1(79.70% ± 1.10%),而不表达造血干细胞表面特异性抗原CD34(1.22%±0.28%)、CD117(0.23%±0.10%)、CD31(1.43%±0.22%)、CD45(0.41%±0.10%),见图3。
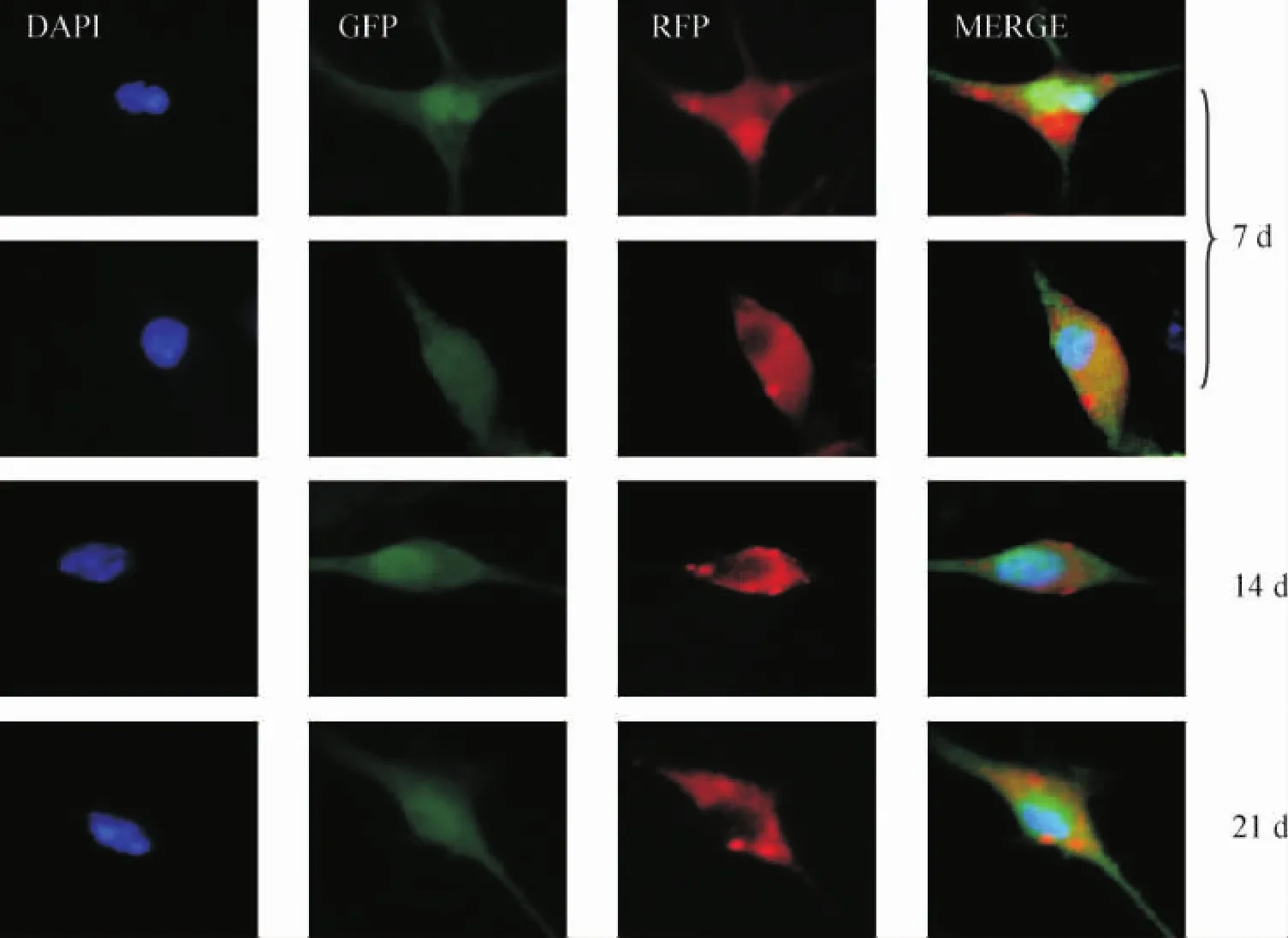
Figure 2.Morphology and nuclear characteristics of fusion cells were detected by fluorescence microscopy(×400).Fusing cells(two nuclears)and fused cells(one nuclear)can be found at 7 d;only fused cells can be found at 14 and 21 d.Blue(DAPI),green(GFP cell),red(RFP cell),yellow(fusion cell).图2 荧光显微镜观察融合细胞形态学特征
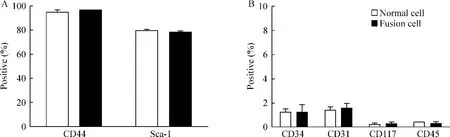
Figure 3.Cell surface markers were detected by flow cytometry.Fusion BMSCs coincided with the normol BMSCs were reactive to the BMSCs lineage-specific CD44,Sca-1 surface markers(A)and negative for the hematopoietic stem cells(HSCs)lineage-specific surface markers such as CD34,CD117,CD31,CD45(B).±s.n=4.图3 流式细胞仪检测细胞表面特异性抗原表达
3 细胞增殖能力检测
在2 d、4 d、6 d、8 d,Y组细胞增殖能力均比O组强,细胞增加百分率具体数值为:(145.15% ± 8.25%)vs(105.09% ±5.58%)、(251.83% ± 10.62%)vs(154.05% ±11.18%)、(397.27% ± 32.44%)vs(256.52% ±20.52%)、(555.68% ± 31.09%)vs(367.71% ±18.71%),P<0.05。Y-O组细胞数量增加百分率比O-O组均显著增高,分别为:(122.20% ±4.60%)vs(104.64% ±1.25%)、(213.25% ±15.29%)vs(130.02% ±6.82%)、 (318.46% ±19.86%)vs(179.40% ±9.54%)、(439.98%±24.09%)vs(240.03%±28.07%),P< 0.05。Y-Y组与Y组、O-O组与O组细胞增殖能力无显著差异,见图4。
4 成骨细胞分化能力检测
Y组成骨细胞分化能力比O组强,茜素红染色阳性百分率为:(30.55% ±3.18%)vs(16.25% ± 2.70%),P<0.01。Y-O组茜素红染色阳性百分率比 O-O组显著增高:(25.46% ±1.52%)vs (13.85%±1.69%),P<0.01。Y-Y组与Y组、O-O组与O组成骨细胞分化能力无显著差异,见图5。
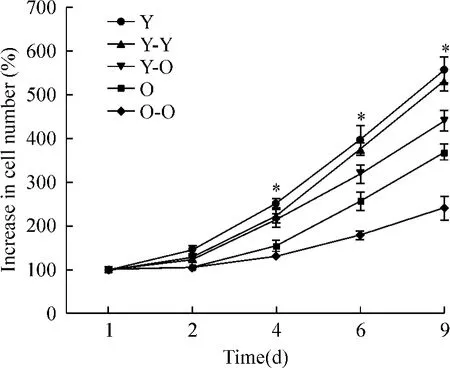
Figure 4.The percentage of increase cell number of five groups. At d 2,4,6,and 8,Y group compared to O group and Y-O group compared to O-O group were significantly greater.Y vs O were(145.15%±8.25%)vs (105.09% ±5.58%);(251.83% ±10.62%)vs (154.05% ±11.18%);(397.27% ±32.44%)vs (256.52% ±20.52%);(555.68% ±31.09%)vs (367.71% ±18.71%);Y-O vs O-O were (122.20% ±4.60%)vs(104.64% ±1.25%); (213.25% ±15.29%)vs(130.02% ±6.82%); (318.46% ±19.86%)vs(179.40% ±9.54%); (439.98%±24.09%)vs(240.03%±28.07%).±s.n=3.*P<0.05 vs O,Y-O vs O-O.图4 细胞增殖能力检测
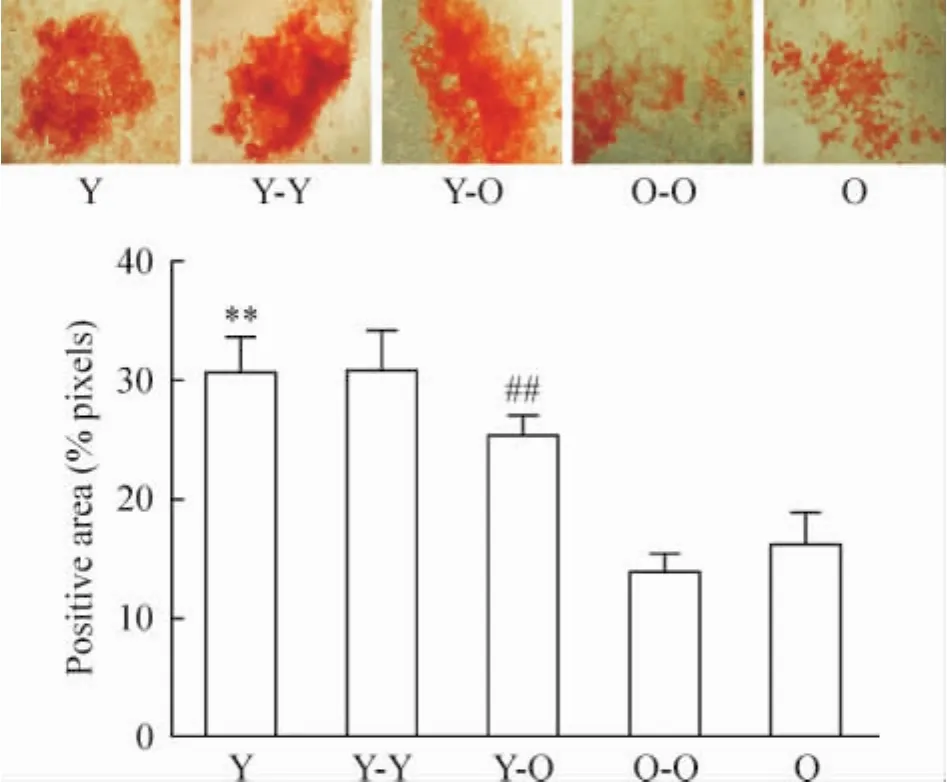
Figure 5.Osteogenic differentiation potential of five groups.The positive area(×40)stained with Alizarin red shows significantly higher in Y group as compared to O group (30.55% ±3.18%)vs(16.25% ±2.70%),and Y-O group as compared to O-O group(25.46% ± 1.52%)vs(13.85% ±1.69%).±s.n=3.**P <0.01 vs O group;##P<0.01 vs O-O group.图5 成骨细胞分化能力检测
5 脂肪细胞分化能力检测
Y组脂肪细胞分化能力比O组强,油红O染色阳性百分率为:(14.46% ±2.63%)vs(6.52% ± 2.35%),P<0.05。Y-O组油红O染色阳性百分率比 O-O组显著增高:(12.99% ±2.61%)vs (6.03%±1.71%),P<0.05。Y-Y组与Y组、OO组与O组脂肪细胞分化能力无显著差异,见图6。
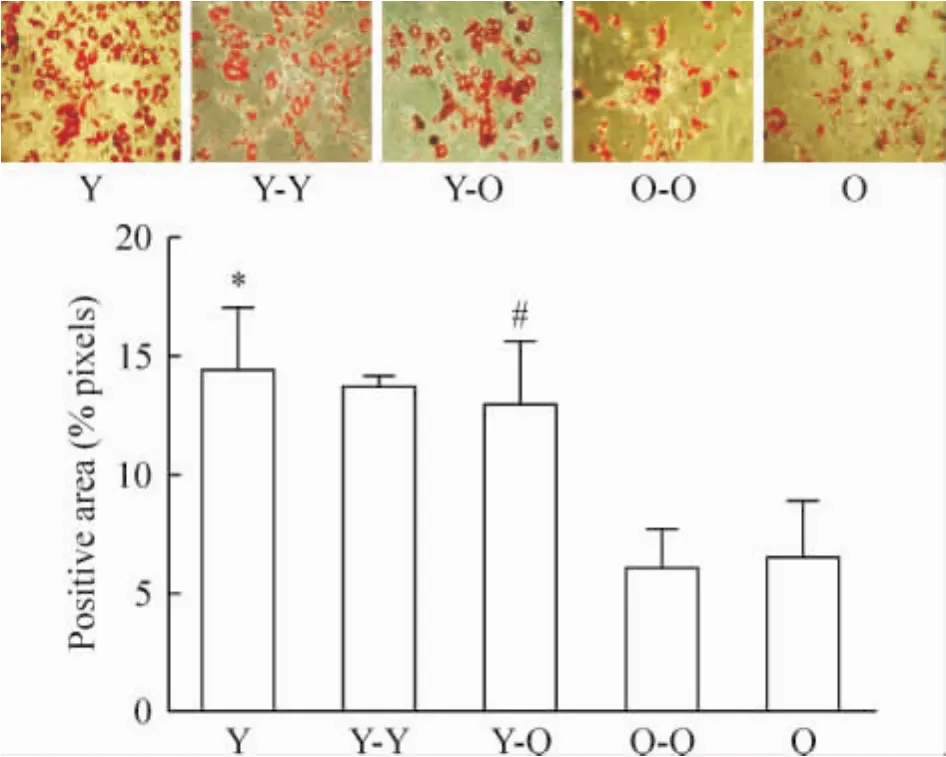
Figure 6.Adipogenic differentiation potential of five groups.The positive area stained with oil red(×200)shows significantly higher in Y group as compared to O group (14.46%±2.63%)vs(6.52% ±2.35%),and Y-O group as compared to O-O group(12.99% ± 2.61%)vs(6.03%±1.71%).±s.n=3.*P< 0.05 vs O group;#P<0.05 vs O-O group.图6 脂肪细胞分化能力检测
讨论
BMSCs作为具有自我更新能力和多向分化潜能的细胞,有着非常重要的理论研究意义和临床应用价值,广泛用于干细胞移植、损伤器官修复、基因治疗等研究[2,3]。衰老是多细胞生物机体功能退变的过程,一般随着年龄的增长,体细胞逐渐出现自我更新能力的降低和功能紊乱。BMSCs随着供体年龄的增加,也相应出现结构和功能的改变,细胞形态变大、变长,细胞集落形成单位的数量下降,细胞增殖能力、成骨细胞、脂肪细胞及成软骨细胞分化能力下降[4],细胞端粒酶变短以及转化生长因子β(transforming growth factor β,TGF-β)[5]、白细胞介素-6 (interleukin-6,IL-6)、白细胞介素-11(interleukin-11,IL-11)等细胞因子、生长因子及酶类功能下降。
细胞融合是近30年来迅速发展起来的细胞工程技术,是指细胞通过介导和培养,在离体条件下用人工方法将不同种的细胞通过无性方式融合(合并)成1个核或多核的杂合细胞的过程。杂合细胞得到了来自2个细胞的遗传物质(细胞核核外和染色体组合基因),具有新的遗传或生物特性。最近的研究发现,体外培养的干细胞可以发生自身融合[6],骨髓干细胞可与浦肯野神经元细胞、心肌细胞[7]、小肠干细胞融合,骨髓干细胞通过分化和细胞融合修复内皮细胞,骨髓干细胞通过细胞融合可使肝脏细胞再生[8],细胞融合被认为是使细胞功能恢复的1种有效方法。
通过本实验,我们发现:(1)在其它条件相同的情况下,随着年龄的增长,BMSCs增殖功能、成骨细胞及脂肪细胞分化功能明显减退;(2)年轻与年老BMSCs通过PEG诱导融合后,能保持干细胞的特性;(3)年轻BMSCs可通过细胞融合改善年老BMSCs增殖功能、成骨细胞及脂肪细胞分化功能。我们认为其可能的机制包括以下3种:(1)年轻BMSCs改善了年老BMSCs端粒酶功能:有研究发现端粒酶可能通过延长端粒的长度恢复其再生和复制功能[9]。年轻BMSCs与年老BMSCs细胞核的融合可能改善了年老BMSCs端粒酶功能,从而改善其增殖及分化功能;(2)年轻BMSCs改变了年老BMSCs细胞因子或基因的表达:有研究发现干细胞成骨细胞及脂肪细胞分化功能与TGF-β、骨形成蛋白-2/4 (bone morphogenetic protein 2/4,BMP2/4)等细胞因子或基因的表达相关[3]。融合后细胞因子或基因表达等的改变可能改善了年老BMSCs多样分化功能; (3)年轻BMSCs改变了年老BMSCs细胞内外微环境:有研究发现干细胞再生功能受周围环境的影响[10],年轻祖细胞微环境可促使年老祖细胞再生[11]。年轻 BMSCs内外微环境可能促进了融合BMSCs的增殖及分化。本研究尚未包括此方面的内容,这些研究只是初步的结果,尚不完整,但对将来的研究提供有益的线索和基础。
综上所述,年龄的增加是导致干细胞功能的重要因素,随着年龄的增加,干细胞的增殖和分化功能减退。通过聚乙烯二醇可建立年轻及年老骨髓间充质干细胞融合模型。通过细胞融合,年轻骨髓间充质干细胞改善了年老骨髓间充质干细胞的增殖功能及成骨细胞、脂肪细胞分化功能。这对干细胞再生能力研究及干细胞移植的临床治疗提供了更多的途径和依据。
(致谢:本实验在加拿大Toronto General Research Institute完成,感谢李曙红老师的悉心指导。)
[1] Stolzing A,Scutt A.Age-related impairment of mesenchymal progenitor cell function[J].Aging Cell,2006,5 (3):213-224.
[2] 陈柏龄,陈东平,张志坚,等.Ang-1基因修饰的骨髓间质干细胞移植治疗脑梗死的实验研究[J].中国病理生理杂志,2009,25(2):241-247.
[3] 李映红,吴正治,吴伟康,等.天然脑活素定向诱导大鼠骨髓间充质干细胞向神经元样细胞分化的实验研究[J].中国病理生理杂志,2009,25(8):1548-1553.
[4] Baxter MA,Wynn RF,Jowitt SN,et al.Study of telomere length reveals rapid aging of human marrow stromal cells following in vitro expansion[J].Stem Cells,2004,22 (5):675-682.
[5] Moerman EJ,Teng K,Lipschitz DA,et al.Aging activates adipogenic and suppresses osteogenic programs in mesenchymal marrow stroma/stem cells:the role of PPAR-gamma 2 transcription factor and TGF-beta/BMP signaling pathways[J].Aging Cell,2004,3(6):379-389.
[6] Terada N,Hamazaki T,Oka M,et al.Bone marrow cells adopt the phenotype of other cells by spontaneous cell fusion[J].Nature,2002,416(6880):542-545.
[7] Alvarez-Dolado M,Pardal R,Garcia-Verdugo JM,et al.Fusion of bone-marrow-derived cells with Purkinje neurons,cardiomyocytes and hepatocytes[J].Nature,2003,425(6961):968-973.
[8] Vassilopoulos G,Wang PR,Russell DW.Transplanted bone marrow regenerates liver by cell fusion[J].Nature,2003,422(6934):901-904.
[9] Allsopp RC,Cheshier S,Weissman IL.Telomerase activation and rejuvenation of telomere length in stimulated T cells derived from serially transplanted hematopoietic stem cells[J].J Exp Med,2002,196(11):1427-1433.
[10]Ryu BY,Orwig KE,Oatley JM,et al.Effects of aging and niche microenvironment on spermatogonial stem cell self-renewal[J].Stem Cells,2006,24(6):1505-1511.
[11]Conboy IM,Conboy MJ,Wagers AJ,et al.Rejuvenation of aged progenitor cells by exposure to a young systemic environment[J].Nature,2005,433(7027):760-764.
