从患病黑分离病原菌HV0811的鉴定及其系统发育分析
2010-03-15战文斌绳秀珍
孟 鹏,战文斌,绳秀珍
(中国海洋大学 教育部海水养殖重点实验室,山东 青岛 266003)
已有报道哈维氏弧菌(Vibrio harveyi)能引起海水网箱养殖高体[1]、尖吻鲈[2]和鲈鱼[3]的溃疡病,但尚未见哈维氏弧菌引起黑患溃疡、瞎眼症的报道。2008年10月,山东威海网箱养殖黑发病,主要症状为溃疡、瞎眼,发病黑体长 15~20 cm,死亡率约为 30%。为了深入了解该疾病从而采取有效防治措施,作者对患病黑进行了病灶处致病菌的分离,在常规生理生化鉴定的基础上,利用基因序列分析的方法对其进行了分类鉴定,并进行了药物敏感试验,以期对该疾病的预防控制提供参考资料。
1 材料与方法
1.1 病原菌分离
取体表溃烂严重的濒死病鱼,无菌条件下从体表、眼睛等部位分离细菌,划线接种于2216E、BHI、TSA平板培养基上,28℃培养18~24 h,挑取形态一致的优势菌落进行纯化培养后于-80℃保存备用。
1.2 人工感染实验
将纯化的 3株优势菌 28℃培养 18~24 h后用0.85%无菌生理盐水洗脱得菌悬液,用McFarland比浊法配制成9×108CFU/mL。并以10倍系列稀释菌悬液至浓度为 9×107、9×106、9×105和 9×104CFU/mL。
1.3 细菌鉴定
将分离纯化的 HV0811和人工感染后分离纯化的HV0811-1划线接种于2216E和TCBS平板培养基上,28℃培养18 h后观察菌落特征,同时进行革兰氏染色和电镜观察。
菌株 HV0811、HV0811-1的生理生化特征实验参照《常见细菌系统鉴定手册》[4]和《伯杰氏细菌学鉴定手册》(第九版)[5]进行,快速鉴定采用法国生物梅里埃公司miniATB鉴定系统ID32E鉴定条。
1.4 16S rRNA和HSP60基因序列的测定和分析
DNA模板制备:菌株HV0811于2216E平板培养基28℃培养24 h。挑取单一菌落悬浮于无菌去离子水中,100℃水浴5 min,冷却后4℃ 12 000r/ min离心10 min,上清液作为PCR扩增反应的模板。
基因序列的 PCR扩增与测序:用于 16S rRNA基因 PCR 扩增的引物为正向:27F:5′-AGAGTTTGATC(C/A) TGGCTCAG-3′(对应于E.coli16S rRNA基因的第 8~27 个碱基位置),反向:1 492R:5′-TACGG(C/T) TACCTTGTTACTT - 3′ (对应于E.coli16S rRNA基因的第1 492~1 510个碱基位置); 用于HSP60 基因 PCR 扩增的引物为正向:P1:5′-ACAACAGCAACGGTACTAGC-3′,反向:P2:5′-CAACTTTCACGATGCCAC-3′[6]。在 50 μL PCR 反应体系中含有:5 μL 10×PCR 缓冲液,3 μL 25 mmol/ L MgCl2,1 μL 10 mmol/ L 4×dNTP,引物各1 μL,Taq DNA聚合酶(5 U/μL) 1 μL,模板 DNA 5 μL。16S rRNA 和HSP60基因PCR反应条件分别为:94 ℃预变性4 min,接94℃变性30 s,55℃复性30 s,72℃延伸100 s,30个循环,最后72℃温育6 min; 94℃预变性2 min,接着94℃30 s,50℃45 s,72℃ 60 s,35个循环,72℃延伸 7 min。PCR产物经琼脂糖电泳确定特异条带后,由上海生物工程技术公司进行PCR产物的纯化和序列测定。
序列分析与系统发育树的构建:菌株 HV0811的16S rRNA和HSP60基因序列已经提交国际互联网 Gen-Bank核苷酸序列数据库,通过 Blast与GenBank数据库中的序列进行比较,从中选取与所分析的基因序列同源性高的已知菌株,采用ClustalX1.8软件进行多序列匹配排列,用 Mega2.1采用邻位相连(Neighbor-joining method)获得系统发育树,通过自举分析(Bootstrap)进行置信度检测,自举数集1 000次。
1.5 药物敏感实验
药敏纸片购自青岛爱普科生物有限公司,共 30种抗菌药物,药敏试验参照纸片扩散法抗菌药物敏感试验操作标准进行。

图1 人工感染黑的实验照片(箭头示病灶处)Fig.1 Sebastodes fuscescens in the artificial infection experiment(arrows point to the lesions)
2 结果
2.1 病原菌的分离和人工感染实验
分离到的优势菌株分别编号为 HV0811、PT0811、JH0811,人工感染3~5 d后,菌株HV0811较高浓度感染组的鱼活动减弱,从注射部位到尾鳍逐渐溃疡,体表溃烂出血,眼睛浑浊不透明,尾鳍溃烂,露出尾椎骨,尾柄表皮充血,肛门红肿,伴有血样物流出(图1),与自然发病症状相同。菌株PT0811、JH0811组与对照组未出现任何症状。HV0811高浓度组死亡率较高,死亡速度较快; 低浓度组陆续发病死亡。用感染发病鱼的溃烂处、眼球及断尾分离到的细菌再次感染黑,得到相同的结果,证明HV0811是黑溃疡、瞎眼症的致病菌。按改进的寇氏法[7]计算菌株HV0811的半致死量为LD50=7.15×105CFU/尾,表明该菌株具有高致病力,对黑的感染力较强,结果见表1。

表1 人工感染一周实验结果Tab.1 Results of artificial infection experiment for a week
2.2 细菌鉴定
在 2216E平板培养基上 28℃培养 24 h,菌株HV0811、HV0811-1呈光滑、圆形、湿润、隆起、灰白色的菌落,直径 1~3 mm; 革兰氏染色为阴性,短杆菌,多呈单个排列; 无芽孢,无荚膜,有运动性,不发光; 电镜观察发现菌体呈短杆状,具有1根端生鞭毛(图2)。在 TCBS平板培养基上菌落绿色,菌株需Na+生长,低于4℃和高于42℃不生长。氧化酶、接触酶、硝酸还原反应均为阳性,具有赖氨酸脱羧酶,不具有鸟氨酸脱羧酶、精氨酸双水解酶、脲酶,发酵葡萄糖产酸不产气,利用麦芽糖、甘露糖、海藻糖,不利用半乳糖、鼠李糖、阿拉伯糖。菌株HV0811、HV0811-1生理生化特性见表2。
2.3 16S rRNA和HSP60基因序列分析及系统发育树的构建
以总DNA为模板,经通用引物27F和1492R扩增到HV0811的16S rRNA基因序列条带约为1 500 bp,经引物P1和P2扩增到HSP60基因序列条带约为100 bp和500 bp (图3),分别选取1 500 bp和500 bp的条带测序。不包括引物结合区,所扩增的 16S rRNA 、HSP60基因序列长度分别为1 033 bp、521 bp。基于 16S rRNA和 HSP60基因序列,采用ClustalX1.8以及 Mega2.1软件构建的系统发育树表明:菌株 HV0811分别与哈维氏弧菌(AY750578)和(AY332571)相类聚,其中16S rRNA基因序列与哈维氏弧菌(AY750578)聚合置信度较低,仅有10%(图4),不能有效地确定该种; HSP60基因序列与哈维氏弧菌(AY332571) 聚为一个分支的置信度达100%(图5)。综合该菌的形态、生理生化及 HSP60基因序列比对结果,将病原菌HV0811鉴定为哈维氏弧菌。
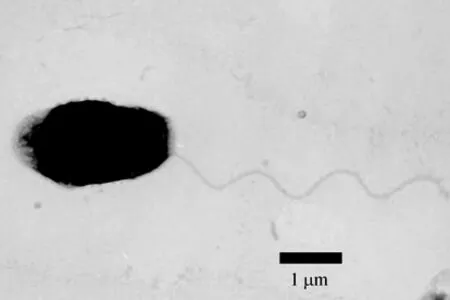
图2 菌株HV0811的负染电镜照片Fig.2 The electron micrograph of strain HV0811 with negative staining
2.4 药物敏感试验
作者对分离的病原菌Vibrio harveyi进行了 30种常见抗菌药物的敏感性测定,结果显示病原菌对庆大霉素、新霉素、红霉素、美满霉素、氯霉素、先锋必素、氟哌酸、丙氟哌酸、菌必治、复达欣、奥复星、头孢呋肟及复方新诺明高度敏感,对卡那霉素、丁胺卡那霉素、麦迪霉素、四环素、万古霉素、先锋霉素Ⅴ及呋喃唑酮中度敏感,对氨苄青霉素、苯唑青霉素、羧苄青霉素、氧哌嗪青霉素、青霉素、强力霉素、多黏菌素B、氯洁霉素、先锋霉素Ⅳ及先锋霉素Ⅵ耐药。实验结果见表3。
3 讨论
哈维氏弧菌是海水鱼的常见致病菌,能引起花鲈[8]、斜带石斑鱼[9~11]、大黄鱼[12]等鱼类不同程度的体表溃疡,充血症状。本文中患病黑不仅具有溃疡的症状同时具有瞎眼症,角膜不透明、眼球突出,与Saeed等[13]曾报道的患病的养殖遮目鱼症状相同。作者认为哈维氏弧菌在导致黑出现以溃疡为主的

表2 菌株HV0811、HV0811-1、哈维氏弧菌《伯杰氏手册》第九版的生理生化特征比较Tab.2 Comparisons of physiological and biochemical characteristics of HV0811、HV0811-1 and Vibrio harveyi

图3 菌株HV0811的16S rRNA和HSP60基因的PCR扩增未纯化产物Fig.3 PCR amplification products of 16S rRNA and HSP60 genes of strain HV0811

图4 以16S rRNA基因构建的弧菌系统发育树Fig.4 Phylogenetic tree of Vibrio based on 16S rRNA gene
本实验分离的哈维氏弧菌HV0811在TCBS上生长呈绿色与相关文献[9~10]报道的黄色结果不一致,原因在于 TCBS的成分中包含蔗糖,相关文献中报道的哈维氏弧菌发酵蔗糖产酸,而本实验分离的哈维氏弧菌不发酵蔗糖,若在 TCBS培养基中加入葡萄糖,生长结果则变为黄色,此差异的主要原因可能是种类个体之间存在差异性。

图5 以HSP60基因构建的弧菌系统发育树Fig.5 Phylogenetic tree of Vibrio based on HSP60 gene

表3 菌株HV0811对不同抗菌药物的敏感性Tab.3 Sensitivity of strain HV0811 to antibacterial agents
从16S rRNA基因序列系统发育树上看,节点的置信度普遍很低,其中菌株 HV0811与哈维氏弧菌(AY750578)聚合的置信度仅有10%,由于弧菌属16S rRNA基因序列的种间差异不显著,导致弧菌不具有唯一的聚类特征[15]。以 HSP60基因构建的系统树,置信度普遍明显高于16S rRNA基因,作者认为16S rRNA基因序列同源性分析不适宜用于亲缘关系较近的弧菌种之间的鉴别,而HSP60基因比16S rRNA基因携带更多的多态信息,因此 HSP60基因比 16S rRNA基因更适合于海水养殖动物中弧菌的分类研究,这与吴淑勤等[10]观点相同。作者采用的 HSP60基因序列分析和生理生化鉴定方法都证明分离的病原菌HV0811属于弧菌属的哈维氏弧菌。
[1]吴后波,潘金培.海水网箱养殖高体弧菌病致病菌研究[J].水产学报,1997,21(2):171-174.
[2]Cop land J W,Grey D L.Management of wild and cultured sea bass barramundi (Lates calcarifer Bloch)[A].Proceeding of an international work shop help at Draw in N T,Australia[C],AC:IAR Proceedings,1987.20.
[3]王国良,金珊,薛良义,等.海水网箱养殖鲈鱼皮肤溃疡病及其病原菌的研究[J].渤海海洋,2000,18(3):01-06.
[4]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[5]Bergey’s Manual of Determinative Bacteriology Ninth Edition [M].Maryland:Williams & Wilkins,1994.
[6]张伟妮,周丽,邢婧,等.养殖大菱鲆腹水症病原菌SR1的分离及鉴定[J].中国水产科学,2006,13(4):603-609.
[7]邹玉霞,张培军,莫照兰,等.大菱鲆出血症病原菌的分离和鉴定[J].高技术通讯,2004,4(4):89-93.
[8]王保坤,余俊红,李筠,等.花鲈弧菌病病原菌(哈维氏弧菌)的分离与鉴定[J].中国水产科学,2002,9(1):52-55.
[9]陈献稿,吴淑勤,石存斌,等.斜带石斑鱼病原菌(哈维氏弧菌)的分离与鉴定[J].中国水产科学,2004,11:313-317.
[10]李宁求,白俊杰,吴淑勤,等.斜带石斑鱼 3种致病弧菌的分子生物学鉴定[J].水产学报,2005,29(3):356-361.
[11]覃映雪,池信才,苏永全,等.网箱养殖青石斑鱼的溃疡病病原[J].水产学报,2004,28(3):297-302.
[12]毛芝娟,刘国勇,陈昌福.大黄鱼溃疡病致病菌的初步分离与鉴定.安徽农业大学学报[J],2002,29(2):178-181.
[13]Saeed M O.Association ofVibrio harveyiwith mortalities in cultured marine fish in Kuwait [J].Aquaculture,1995,136:21-29.
[14]郝贵杰,沈锦玉,潘晓义,等.32种常用渔药对大黄鱼致病菌哈维氏弧菌的体外抗菌试验.中国兽药杂志[J],2008,42(5):36-39.
[15]Kim Y B,Okuda J,Matsumoto C,et al.Identification ofVibrio Parahaemolyticusstrains at the species level by PCR targeted to thetoxRgene[J].J Clin Microbiol,1999,37( 1):173-177.
