样品保藏方式与时间对海洋底栖细菌及原生生物荧光计数效能的影响
2010-03-14孟昭翠类彦立和莹莹徐奎栋
孟昭翠,类彦立和莹莹,徐奎栋
(1.中国科学院 海洋研究所海洋生物分类与系统演化实验室,山东 青岛 266071; 2.中国科学院 研究生院,北京 100039)
DAPI (4′,6-diamidino-2-phenylindole,4′,6-联脒-2-苯基吲哚) 是一种灵敏度高、特异性强的荧光染料,对细胞核及染色体有很好的染色效果。它可与 DNA的 A-T 碱基结合形成 DAPI-DNA 复合物,该复合物在紫外激发光 (365nm) 下会发出蓝色荧光。而福尔马林固定的样品经 DAPI 染色时,甲醛可诱发蛋白质中的芳香乙胺基团转化为荧光色团,从而使细胞质荧光较强,由此可见整个细胞的轮廓[1]。此外,细胞内的色素体在绿色激发光下发出红色荧光,可计数自养鞭毛虫。由此,DAPI 不仅用于细菌计数,也可用于蓝细菌、硅藻、自养和异养小鞭毛虫及纤毛虫等微型底栖生物计数。结合复染剂 Evans Blue的使用,可使染色后的细胞更容易辨认[2]。
样品的保藏方式及保存时间是影响 DAPI 荧光计数效能的重要因素。对海洋浮游细菌及鞭毛虫的研究发现,固定后的样品随着保藏时间延长,可造成数量低估[3]。Daley 等[4]、Sherr 等[5]及 Kepner 等[6]发现经福尔马林固定的浮游样品于 5℃下避光保存1~3 周后,对细菌的计数结果无差异。Porter 等[7]报道福尔马林固定的浮游样品经 DAPI 染色后封片,4℃下保存 24 周对细菌的计数结果无差异。但Hyun等[8]报道经福尔马林固定后的浮游样品,贮藏于样品瓶的计数结果优于封片保存的。Turley 等[3,9]用戊二醛固定浮游样品并经常温避光保藏,40 天后发现对细菌的计数数量平均减少了 39%,而经 DAPI染色封片并冷冻保存 70 d的细菌计数则无影响。而Pomroy[10]发现经过 Lugol’s 液固定的浮游样品在室温避光保存 4年未造成对细菌数量的低估,对鞭毛虫可保存10年甚至更长而无数量变化。但是,上述研究均源自浮游样品,对于底栖样品则缺少系统的研究。仅Hamels 等[11,12]报道沉积物中的鞭毛虫经 DAPI 染色封片后可冷冻避光保存 1个月,而经 Percoll 液提取后的鞭毛虫经同样处理可保存2个月。
由于细菌及原生生物因可附着于其他生物体和/或沉积物颗粒表面 (如“海雪”),若不加处理直接以 DAPI 进行荧光计数,可对其数量乃重要性造成不同程度的低估[13~15]。目前最为有效的做法是首先利用超声波等设备将底栖生物与沉积物分散开,然后再行染色计数。但在野外尤其是海上取样时,因取样站位多、时间紧、超声波分散仪及离心设备等现场无法使用,将样品进行保藏 (冷冻或冷藏) 后带回室内分析是较为可行的方法。保藏方式对于无细胞壁的原生生物尤为重要,如在冷冻保藏的冻融过程中,可因细胞膜的破裂而无法准确计数。此外,出海采集常涉及大量样品,样品分析完成常需数周甚至数月。因此,测试不同保藏方式和保存时间对沉积物样品定量分析的影响,是对数量进行准确估算的重要环节。
作者采用 DAPI 荧光染色计数法对海洋沉积物样品中的细菌、蓝细菌、自养小鞭毛虫 (PNF) 和异养小鞭毛虫 (HNF) 及硅藻进行了冷藏与冷冻两种保藏方式的比较分析,同时比较研究了不同保藏时间 (1 个月和 4 个月) 对这些微型底栖生物计数结果的影响。
1 材料与方法
1.1 研究站位和样品采集
用内径 1.6 cm 的采样管 (注射器改造),从未受扰动的 0.1 m2改进型 Gray-Ohara 箱式采泥器中,随机采集 5 cm 长芯样 4 个,每个芯样按 0~2 cm、2~5 cm 分层移入 50 mL 离心管中,加入经滤膜 (孔径0.22 µm) 过滤的海水配制的 2.5% 甲醛溶液分别至 20 mL 和 30 mL 进行固定。每个重复各取 10 mL 后合并共计 40 mL,一份于4℃避光冷藏保存,一份放置在冰柜-20 ℃ 避光冷冻保存。
冷冻和冷藏对比实验选取 2007年7月采集自黄海的编号为 3205 (32°N,124.5°E)、3403 (33.5°N,123°E)、4018 (33°N,122.5°E) 三个站位的 0~2 cm分层样品; 保存时间实验选取 2008 年开放共享航次编号为 3400-8(34°N,124°E)、3800-1(38°N,121.7°E)两个站位的 0~2 cm、2~5 cm 分层的样品 (图 1)。沉积物粒度分析采用 Cilas (940L) 型激光粒度仪进行测定。其他环境资料来自温盐深测定仪 (CTD) 现场测定。

图1 黄海采样站位Fig.1 Sampling stations in the Yellow Sea
1.2 样品分析方法
取适量样品 (约 2mL) 加入焦磷酸四钠 (f.c.1 mmol/L),常温避光培育 15~30 min。经 JY92-II超声波分散处理 180 s (振幅109 μm,50 W,6 mm Microtip),为避免样品过热,每超声破碎处理 45 s,冷却 1 min。取分样后,根据镜检样品中生物的密度,调节至适当的稀释倍率 (细菌以每个视野 20~30个为宜,鞭毛虫以沉积物不遮挡生物为宜),加入DAPI (f.c.5 mg/L) 和复染剂 Evans Blue (f.c.10-6g/mL),低温避光染色 10 min[1~3,9,13]。染色样品经 Sartorius 真空过滤系统浓缩过滤到黑混合纤维素膜上。封片后置于 Zeiss Axioskop 2 plus HBO 100荧光显微镜油镜下镜检计数。细菌的计数在紫外光激发 (BP 365/12,FT 395,LP 397) 下,每片随机计数 20~40 个视野,总计 500 个左右。鞭毛虫的计数根据其最长粒径划分为 2~5 µm,5~10 µm,>10 µm三个粒级,先在紫外激发光下每片随机计数50个视野 (此为鞭毛虫总数),后转换至绿色激发光 (BP 546/12,FT 580,LP 59) 下,每片快速随机计数50个视野 (为自养小鞭毛虫 (PNF) 总数)[5,16]。异养小鞭毛虫 (HNF) 的数目为鞭毛虫总数与自养小鞭毛虫数目的差值。根据视野面积以及样品稀释倍率换算各生物类群的最终丰度。微型底栖生物丰度的计算按如下公式:

其中,A为丰度(个/mL);N为各视野平均数(个);Sf为1000×下显微镜视野面积(cm2);S为滤膜实际过滤面积(cm2);D为稀释倍数;V为染色用的样品体积(mL)。
文中采用如下缩写:自养小鞭毛虫 PNF (2~5 µm)、PNF (5~10 µm)、PNF (>10 µm); 异养小鞭毛虫 HNF (2~5 µm)、HNF (5~10 µm)、HNF (>10 µm)。
1.3 数据统计分析
采用 SPSS 15.0 统计软件进行分析,将沉积物中各类群丰度的不同处理进行T-test 检验。为使数据正态分布,将原始数据经过 log 转化处理。
2 结果
2.1 站位基本情况
实验中 5 个站位 (3205、3403、4018、3400-8、3800-1) 的环境因子见表 1。

表1 五个站位 3205、3403、4018、3400-8、3800-1的环境因子Tab.1 Environmental factors of the five stations: 3205,3403,4018,3400-8,and 3800-1

图2 DAPI 染色后的细菌 (2-1)、硅藻 (2-2,2-3)、鞭毛虫 (2-4~2-7) 及蓝细菌 (2-8)Fig.2 Bacteria (2-1),diatoms (2-2 and2- 3),flagellates (2-4~2-7) and cyanobacteria (2-8) stained with DAPI
2.2 保藏方式实验
利用 DAPI 染色,对三站位 (3205、3403、4018)0~2 cm 分层的冷冻、冷藏样品进行分析。荧光镜检观察到细菌及各种原生生物的形态如图 2 所示,细菌大小约为 1~2 µm,常见为球菌、杆菌、弧形菌; 硅藻种类多样,有圆筛藻、曲舟藻、直链藻等,常见10 µm大小的直链藻; 鞭毛虫形态多种多样,有球形,椭球形等,个体大小差异也较大; 蓝细菌多为 2 个或 4个一组存在。
图3 示 3205、3403、4018 站冷冻、冷藏两种保藏方式下各类群的丰度。三个站位冷冻样品中细菌平均丰度为 8.69×108±2.92×108个/mL,较冷藏样品低 25% (平均 1.16×109±0.31×109个/mL),2~5 µm 的鞭毛虫平均丰度为 4.00×106±0.97×106个/mL,较 冷 藏 样 品 低 25% (平 均 5.39×106±1.92×106个/mL),5~10 µm 的鞭毛虫平均丰度为 5.07×105±3.06×105个/mL,较冷藏样品低 23%(平均 6.61×105±3.06×105个/mL),>10 µm 的鞭毛虫平均丰度为4.50×104±4.82×104个/mL,较冷藏样品低 79% (平均 2.18×105±1.38×105个/mL),硅 藻 平 均 丰 度 为8.35×104±7.71×104个/mL,较冷藏样品低13% (平均9.63×104±13.9×104个 /mL),蓝 细 菌 平 均 丰 度 为2.56×106±0.75×106个/mL,较冷藏样品高 9% (平均2.35×106±0.86×106个/mL)。沉积物中细菌在丰度(108~109) 上占绝对优势 (冷藏冷冻样品 98.84%~99.35%),冷藏保存下 4018 站的细菌丰度最高; 其次是自养小鞭毛虫 (丰度占0.32%~0.57%)、蓝细菌(丰度占 0.12%~0.40%)、异养小鞭毛虫 (丰度占0.02%~0.25%),硅藻丰度所占比例最小 (0~0.02%)。三个站位沉积物样品中相同粒级的自养小鞭毛虫的丰度均高于异养小鞭毛虫。自养小鞭毛虫丰度 4018站最高,其次是 3403 站、3205 站。按鞭毛虫大小看,2~5 µm 鞭毛虫的丰度最高,5~10 µm 鞭毛虫丰度次之,>10 µm 鞭毛虫丰度最小。
T-test 检验结果表明,冷冻、冷藏两种保藏方式下,3205 站和 3403 站的各测试对象:细菌、硅藻、蓝细菌、自养小鞭毛虫、异养小鞭毛虫均无差异;4018 站的细菌、硅藻、蓝细菌、异养小鞭毛虫及PNF(>10 µm) 均无差异,而 PNF (2~5 µm)、PNF (5~10 µm) 存在显著差异 (P<0.05),PNF (2~5 µm) 冷藏样品丰度显著高于冷冻样品 92.1%,PNF (5~10 µm)冷藏样品丰度显著高于冷冻样品 89.5% (表 2)。
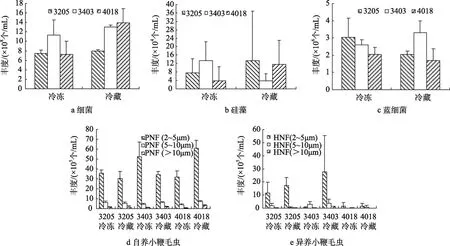
图3 冷冻及冷藏两种保藏方式下3个站位 (3205、3403、4018) 的细菌 (a)、硅藻 (b)、蓝细菌 (c)、自养小鞭毛虫 (d)和异养小鞭毛虫 (e) 的丰度Fig.3 Abundances of bacteria (a),diatoms (b),cyanobacteria (c),PNF (d) and HNF (e) from Stations 3205,3403 and 4018,respectively.Samples that underwent either 4 °C or -20 °C storage were measured
2.3 保藏时间实验
为研究不同保藏时间对细菌及各原生生物类群定量计数的影响,对来自黄海的两个站位 (3400-8及 3800-1) 0~2 cm 及 2~5 cm 分层的样品经保存1 个月和 4 个月后的对比分析见表 3。两个站位的各类群中,细菌丰度均超过 99%,自养小鞭毛虫占0.42%,异养小鞭毛虫、蓝细菌,硅藻所占比例最小。在保存 1 个月和 4 个月后各类群所占的百分比基本保持稳定。统计分析表明,不同保存时间下,3400-8 及 3800-1 站的两个分层的细菌、蓝细菌、PNF (5~10 μm)、PNF (>10 μm)、HNF (>10 μm) 和硅藻均无差异。3400-8 站两个分层的 HNF (2~5 μm)均有显著差异,保存 4 个月后镜检均未检获到; 而PNF (2~5 μm) 和 HNF (5~10 μm)均无差异。3800-1站 0~2 cm 分层的 PNF (2~5 μm)和 HNF (5~10 μm)均有显著差异,保存4个月后PNF (2~5 μm) 的丰度比1个月时减少了47.4%,HNF (5~10 μm)未检获到;2~5 cm 分层的 PNF (2~5 μm)、HNF (2~5 μm)均有显著差异,保存4个月后 PNF (2~5 μm)丰度比 1个月时减少了 59.6%,HNF (2~5 μm)未检获到 (表 3 和表4)。
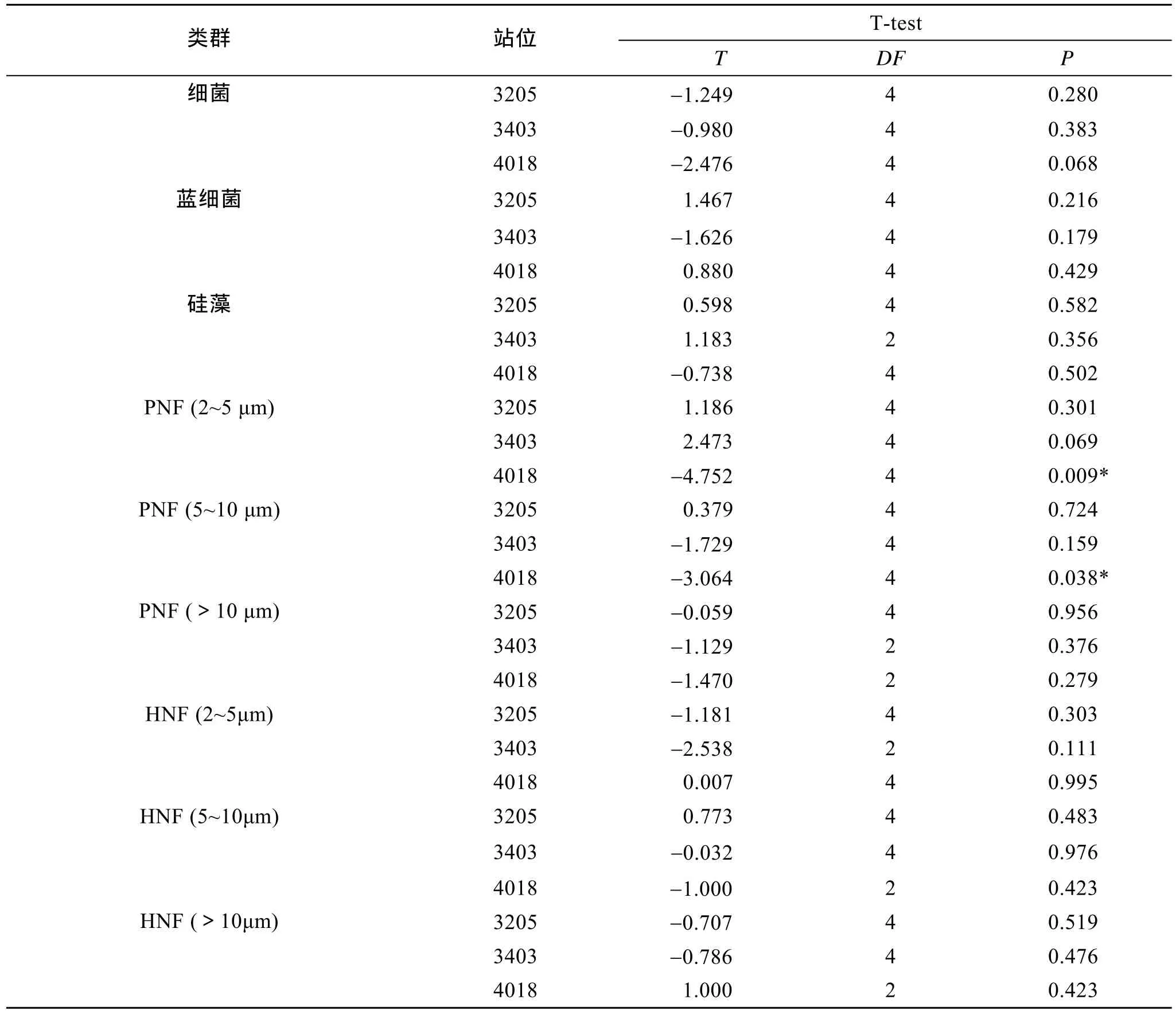
表2 不同保藏方式下3205、3403、4018站位的0~2cm分层细菌,蓝细菌及原生生物的T-Test检验Tab.2 T-Test analyses of bacteria,cyanobacteria and protists in the 0~2 cm layer at Stations 3205,3403 and 4018 under two different preservations
3 讨论
3.1 保藏方式对定量的影响
Porter等[7]报道福尔马林固定后的浮游样品经DAPI 染色封片后,4℃保存24周,细菌计数结果无差异。Hyun等[8]研究发现浮游样品采集后经福尔马林固定,一部分存于样品瓶中,一部分现场染色封片,均冷冻保存90天。结果显示存于样品瓶后的细菌数量为原来的 95%,而封片中细菌数量为原来的80%,且反复冻融可造成细菌数量损失。但有关底栖样品保藏后对实验结果的影响研究极少。本研究三个站位中,对于细菌、蓝细菌、硅藻、三个粒级的异养小鞭毛虫以及大于10 µm的自养小鞭毛虫,冷冻、冷藏两种保藏方式无差异; 而对于 2~5 µm 与 5~10µm的自养小鞭毛虫来说,在一个站位呈现差异显著,冷藏获得的丰度高于冷冻保藏。原因可能在于冷冻样品的解冻过程对细胞尤其是较大个体的细胞造成破碎,解冻对于细胞壁较为坚实的细菌和蓝细菌的影响较小,而对于细胞壁不太坚实的鞭毛虫则影响较大。因此,对沉积物样品短期内宜采用避光冷藏保存。此外,沉积物类型的不同,也会对定量计数造成影响:例如,含砂量较多的样品过滤到黑膜上后,可造成细胞分布不均或镜检时焦距不同而影响计数,而含泥较多则会遮掩部分细菌及小的原生生物。
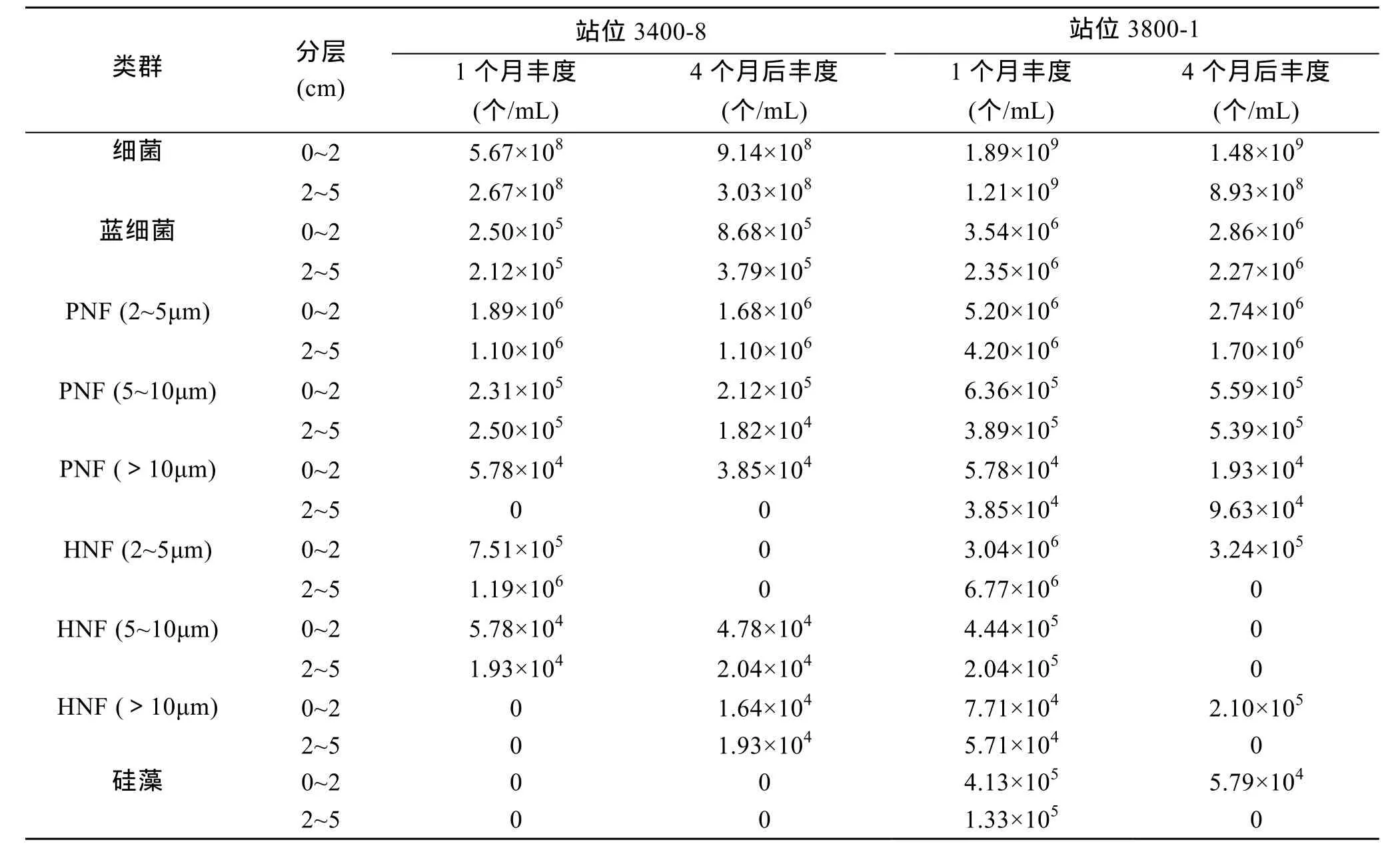
表3 两站位(3400-8,3800-1)的0~2 cm及2~5 cm分层样品在保存1个月和4个月后的细菌、蓝细菌及原生生物的丰度Tab.3 Abundance of bacteria,cyanobacteria and protists in the 0~2 cm and 2~5cm layers of Stations 3400-8 and 3800-1 after 1 and 4 months
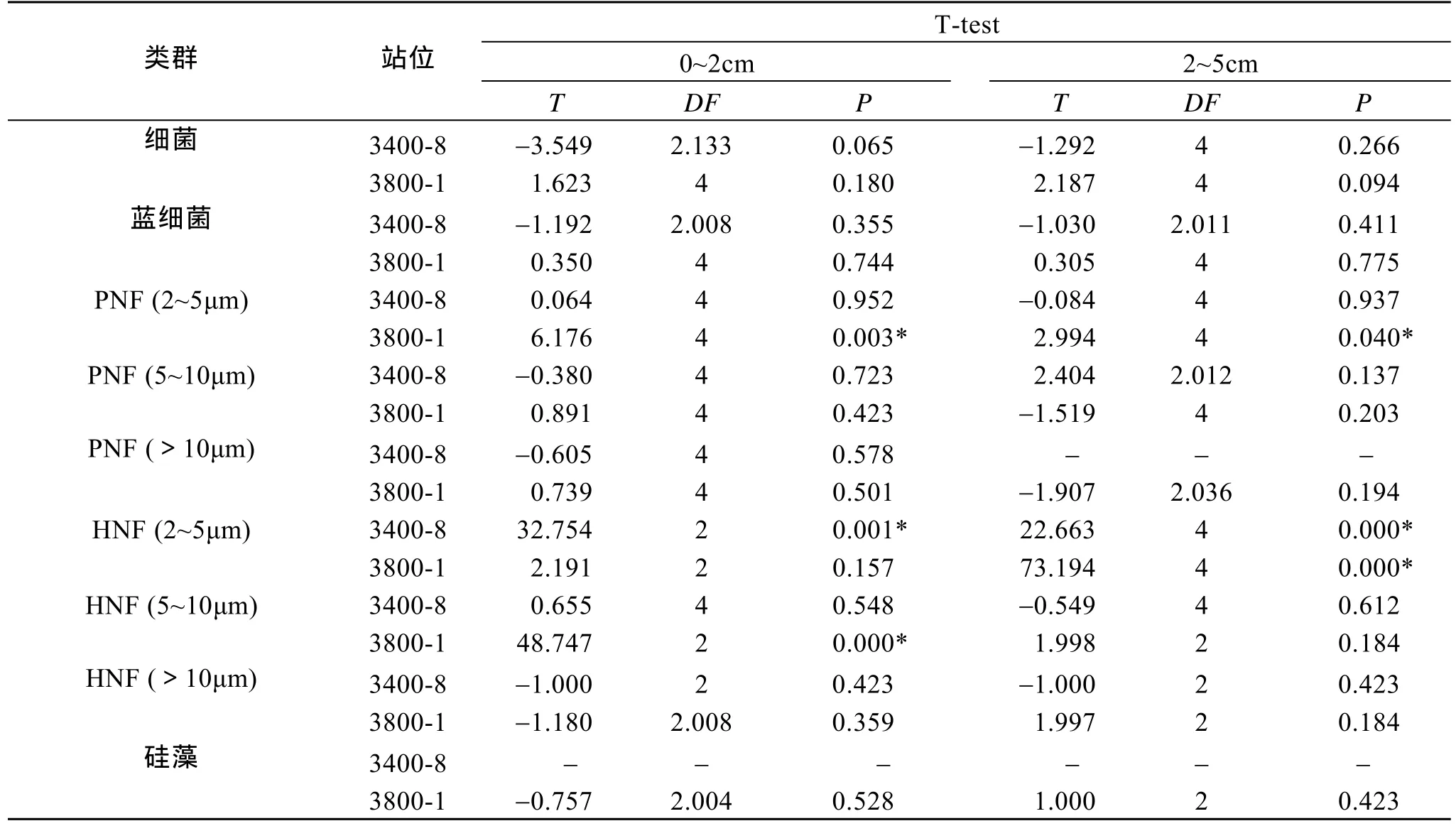
表4 两站位(3400-8,3800-1)的0~2 cm及2~5 cm分层在保存1个月和4个月后的细菌及原生生物的T-Test检验结果Tab.4 T-Test analyses of bacteria and protists in the 0~2 cm and 2~5cm layers of Stations 3400-8 and 3800-1 after 1 and 4 months
3.2 样品保存时间对定量的影响
在样品保存时间对底栖生物定量分析的影响方面,迄今尚无研究报道。Daley等[4]、Sherr等[5]及Kepner 等[6]发现经福尔马林固定的浮游样品于 5℃下避光保存 1~2周后,对细菌的计数结果无差异。Turley[9]曾报道经戊二醛固定后的浮游样品常温避光保藏,前 40天内细胞数量平均减少39%,并证实无论以何种固定液 (戊二醛或甲醛)、样品瓶 (无色或棕色瓶) 或染色剂 (AO或DAPI) 处理,均会造成细胞数量的低估。本研究表明样品随着保存时间的延长 (保藏 1个月和 4个月),对其定量计数依不同研究对象而有程度不同的影响:对于细菌、蓝细菌、PNF (5~10 μm)、PNF (>10 μm)、HNF (>10 μm)、硅藻保存 4 个月后计数无影响; 而对于 PNF (2~5 μm)、HNF (2~5 μm)、HNF (5~10 μm) 的影响不同,例如样品保存4个月后,在3800-1站0~2 cm分层的PNF (2~5 μm) 丰度比1个月时减少了47.4%,2~5 cm分层的丰度减少了 59.6%,而且统计分析存在差异的 HNF (2~5 μm)和 HNF (5~10 μm)在 4 个月后丰度降为0。可见样品保藏时间对异养小鞭毛虫的影响比自养小鞭毛虫的影响大。总体上,样品保藏4个月对细菌、蓝细菌、硅藻均无影响,但对鞭毛虫有一定的影响,因此建议对鞭毛虫样品在采集后宜尽快分析。
4 结语
冷冻和冷藏两种保藏方式对于细菌、蓝细菌和硅藻的影响未呈现明显差异,但对于自养小鞭毛虫则冷藏优于冷冻方式,故建议短期内对沉积物样品采取避光冷藏保存,并在采集后尽快完成样品的定量分析。
致谢:本研究样品源于“中国科学院海洋研究所2007 年度黄海冷水团调查航次”。杜永芬、代仁海、詹子锋协助采样,李承春协助部分样品处理,在此一并致谢。
[1]Sheer E B,Caron D A,Sheer B F.Staining of heterotrophic protists for visualization via epifluorescence microscopy [A].Kemp P F,Sherr B F,Sherr E B,et al.Handbook of methods in aquatic microbial ecology [C].London:Lewis Publishers,1993.213-227.
[2]Epstein S S,Rossel J.Enumeration of sandy sediment bacteria:search for optimal protocol [J].Marine Ecology Progress Series,1995,117:289-298.
[3]Turley C M.Direct estimates of bacteria numbers in seawater samples without incurring cell loss due to sample storage [A].Kemp P F,Sherr B F,Sherr E B,et al.Handbook of methods in aquatic microbial ecology[C].London:Lewis Publishers,1993.143-147.
[4]Daley R J,Hobble J E.Direct counts of aquatic bacteria by a modified epifluorescence technique [J].Limnology and Oceanography,1975,20:875-882.
[5]Sheer E B,Sheer B F.Preservation and storage of samples for enumeration of heterotrophic protists [A].Kemp P F,Sherr B F,Sherr E B,et al.Handbook of methods in aquatic microbial ecology [C].London:Lewis Publishers,1993.208-212.
[6]Kepner Jr R L,Pratt J.Use of fluorochromes for direct enumeration of total bacteria in environmental samples:past and present [J].Microbiology and Molecular Biology Reviews,1994,58(4):603-615.
[7]Porter K G,Feig K G.The use of DAPI for identifying and counting aquatic microflora [J].Limnology and Oceanography,1980,25 (5):943-948.
[8]Hyun J,Yang E.Freezing seawater for the long-term storage of bacterial cells for microscopic enumeration [J].The Journal of Microbiology,2003,41(3):262-265.
[9]Turley C M,Hughes D J.Effects of storage on direct estimates of bacterial numbers of preserved seawater samples [J].Deep-Sea Research,1992,39:375-394.
[10]Pomroy A J.Direct counting of bacteria preserved with Lugol iodine solution [J].Applied and Environmental Microbiology,1984,47(5):1191-1192.
[11]Hamels I,Muylaert K,Casteletn C,et al.Uncoupling of bacterial production and flagellate grazing in aquatic sediments:a case study from an intertidal flat [J].Aquatic Microbial Ecology,2001,25:31-42.
[12]Hamels I,Sabbe K,Muylaert K,et al.Quantitative importance,composition,and seasonal dynamics of protozoan communities in polyhaline versus freshwater intertidal sediments [J].Microbial Ecology,2004,47:18-29.
[13]Velji M I,Albright L J.Improved sample preparation for enumeration of aggregated aquatic substrate bacteria [A].Kemp P F,Sherr B F,Sherr E B,et al.Handbook of methods in aquatic microbial ecology [C].London:Lewis Publishers,1993.139-142.
[14]Schallenberg M,Kalff J,Rasmussen J B.Solutions to problems in enumerating sediment bacteria by direct counts [J].Applied and Environmental Microbiology,1989,55:1 214-1 219.
[15]Epstein S S,Alexander D,Cosman K,et al.Enumeration of sandy sediment bacteria:Are the counts quantitative or relative? [J].Marine Ecology Progress Series,1997,151:11-16.
[16]Maclsaac E A,Stockner J G.Enumeration of phototrophic picoplankton by autofluorescence microscopy [A].Kemp P F,Sherr B F,Sherr E B,et al.Handbook of methods in aquatic microbial ecology [C].London:Lewis Publishers,1993.187-197.
