胶州湾中部海域大型底栖生物生态学初步研究
2010-03-14隋吉星于子山曲方圆刘卫霞
隋吉星,于子山,曲方圆,刘卫霞
(中国海洋大学 海洋生命学院,山东 青岛266003)
胶州湾位于山东半岛南岸,属于典型的半封闭海湾。其海域环境特殊,底栖生物复杂多样,从而成为海湾生态学研究的典型海域。早在20世纪50年代,中国科学院海洋研究所就与苏联科学院动物研究所合作,对胶州湾底栖生物做了比较详细的调查研究[1]。80年代以后关于胶州湾大型底栖生物的生态学研究更是持续不断:刘瑞玉[2]对胶州湾底栖生物群落结构作了详细的论述; 孙道远[3]围绕胶州湾底栖生物的数量动态进行了细致的讨论; 毕洪生等[4]对胶州湾近十几年底栖生物群落的变化进行了总结,等等。而近几年对胶州湾底栖生物的研究也更加详细:单独讨论多毛类[5]、软体动物[6]、甲壳动物[7]、棘皮动物[8]的数量动态及其与环境因子的关系等。此外,对于胶州湾底栖生物多样性、次级生产力也有不少的报道[9~12]。本研究是山东省908专项的一部分,就胶州湾中部海域大型底栖生物丰度、生物量、多样性指数等展开研究,为胶州湾环境质量的生态监控和生物资源的持续利用提供科学依据。
1 材料与方法
1.1 站位布设和样品处理
于2006年8月、12月、2007年4月和10月分4个航次(以下简称夏季、冬季、春季和秋季航次),对胶州湾中部海域的大型底栖生物进行了取样分析,共设5个站位(图1)。样品采集、保存、计数和称量均按照《海洋调查规范》[13]和《908技术规程》进行。另在每站取沉积物表层样,用于测定粒度和有机碳,测定有机碳的样品置于-20℃保存。
图1 调查海区站位图Fig.1 Map of sampling stations in the study area
1.2 环境因子的测定
1.2.1 沉积物粒度的测定
沉积物样品经六偏磷酸钠溶液和超声波分散后,用 Cilas940L 型激光粒度仪(测量范围 0.3~2000μm)进行粒度测试,粒度参数的计算用矩值法。QD07和QD15站因底质颗粒较大而采用筛析法测定。
1.2.2 沉积物有机质的测定
样品60℃烘72 h后,研磨,过100目筛,然后按照《海洋调查规范》重铬酸钾-硫酸氧化法及刘昌岭改进方法[14]进行有机碳的测定。有机碳含量乘以1.724得有机质含量。
1.3 数据处理
采用PRIMER5.0,spss10.0软件包中的相关程序进行数据资料的分析处理。
1.4 相对重要性指标
相对重要性指标全面考虑了大型底栖动物种群的个体大小、数量和分布情况,能定量地反映出它们的地位和数量分布的变化情况[15],其计算公式为:
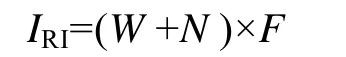
式中,W为种群的生物量占大型底栖动物总生物量的百分比;N为种群的丰度占大型底栖动物总丰度的百分比;F为种群出现的频率。
2 结果
2.1 沉积环境
调查中所测各站位的环境因子数据见表 1(仅春季航次)。本次调查有机质含量平均值为 0.78%,与刘瑞玉等[2]的报道(平均为 0.95%)相差不大,而远低于袁伟[16]等的调查结果(位于胶州湾中部海域的S站,有机质含量为 1.78%)。袁伟等调查的海域位于胶州湾养殖区,饵料的投放和养殖生物的粪便可能是该海域有机质含量高的主要原因。QD06站、QD09站和 QD13站底质为粉砂黏土类型(中值粒径分别为6.55、6.41和6.9),有机质容易聚集,QD07站和QD15站底质为中砂细砂类型,水循环好,含氧量高,有机质含量低。
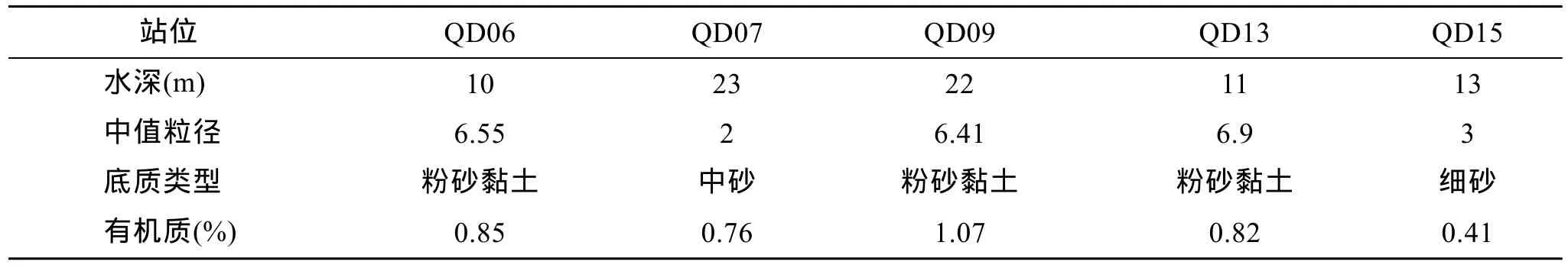
表1 各站位环境因子Tab.1 The environmental variables of each sampling station
2.2 大型底栖生物种类组成
在 4个航次的调查中,共采集鉴定大型底栖生物206种,其中多毛类98种,占总数的47.57%; 甲壳动物53种,占总数的25.73%; 软体动物31种,占总数的 15.05%; 棘皮动物 7种,占总数的 3.4%; 其他类群17种包括腔肠动物门、纽形动物门、鱼类等,占总数的8.25%。
从丰度来看,多毛类占有绝对优势,平均丰度为 925 个/m2,占总平均丰度的 67%; 软体动物为116 个/m2,占总平均丰度的 8%; 甲壳类为 219 个/m2,占总平均丰度的 16%; 棘皮动物为 90 个/m2,占总平均丰度的7%; 其他类群22 个/m2,占总平均丰度的2%。
从生物量来看,多毛类平均生物量最低,为2.78 g/m2,占总平均生物量的10%; 甲壳动物、软体动物、棘皮动物相差不大,分别为 7.95 g/m2、6.59 g/m2、5.96 g/m2,分别占总平均生物量的27%、23%、21%; 其他类群平均生物量为 5.48 g/m2,占总平均生物量的19%。
2.3 相对重要性指数
由于动物有运动能力,多数动物群落研究中以数量或生物量为基础来衡量种的重要性。但一般来说,对于小型动物,以数量为指标易于高估其作用,而以生物量为指标,易于低估其作用; 相反,对于大型动物,数量低估了其作用,而生物量高估其作用。相对重要性指数同时以数量和生物量为指标,并考虑了种的分布情况,因而能较好地反映种的重要性。各季节相对重要性指数前4位的种见表2。可见,不同季节,种群的相对重要性存在差异。
2.4 生物多样性
物种的丰富度反映的是一个群落中种的数目的多寡; 种的均匀度反映的是一个群落中全部种的个体数目的分配情况,它反映了种属组成的均匀程度; 香浓威纳指数在群落多样性测度上借用了信息论中不定性测量方法,就是预测下一个采集的个体属于什么种,如果群落的多样性程度越高,其不定性也越大。在对一个群落多样性进行研究时,一般从以上三种指数出发,综合分析比较物种的多样性及其影响因素[6,9~11]。
表3为本研究各站位在不同季节的三种指数的取值。香浓威纳指数(H′)在冬季和夏季较高,平均值为2.81和2.8,而在春季和秋季较低,平均值为2.59和 2.50,这与李新正[9]等得出的结论是一致的。均匀度指数(J)在各个季节变化不大。物种丰度度指数(D)则为夏季(4.86)>冬季(4.47)>春季(3.81)>秋季(2.79)。One-way ANOVA检验结果表明:不同季节香浓威纳指数差异不显著(F=1.109,P>0.05); 均匀度指数差异不显著(F=1.421,P>0.05); 丰富度指数差异显著(F=4.594,P<0.05)。

表2 各季节大型底栖生物相对重要性指数Tab.2 The IRI of macrobenthos at each season

表3 各站位不同季节多样性指数Tab.3 Diversity of every season at each station

表4 研究海域大型底栖生物丰度Tab.4 The abundance of macrobenthos in the study area (个/m2)
2.5 大型底栖生物的丰度
表4为各站位不同季节大型底栖生物丰度的取值,5个站位的总平均丰度为1 507 个/m2。丰度的最高值出现在夏季航次中的QD07站,为4 170 个/ m2,原因是在该站采集到了大量的寡鳃齿吻沙蚕(Nephthys oligobranchia)、异蚓虫(Heteromastus filiformis)、独指虫(Aricidea fragilis),其次为QD13站,平均丰度为1 498 个/m2。不同季节比较而言,夏季和冬季平均丰度较高,春季和秋季平均丰度较低。One-way ANOVA检验结果表明:不同季节间丰度有显著差异(F=4.067,P<0.05)。
2.6 大型底栖生物的生物量
表5为各站位不同季节大型底栖生物生物量的取值。5个站位的总平均生物量为35.88 g/m2。生物量最高值出现在QD13站,为63.22 g/m2,原因是春季航次中在该站位采到了大个体的棘刺锚参(Protankyra bidentata),秋季航次中在该站位采到了生物量较大的菲律宾蛤仔(Ruditapes philippinarum)。此外,QD07站平均生物量也较高,为49.53 g/m2,原因是秋季航次中,在该站采到了大个体的强壮菱蟹(Parthenope validus)。不同季节比较而言,春季和秋季平均生物量较高,夏季和冬季平均生物量较低。One-way ANOVA检验结果表明:不同季节间生物量差异不显著(F=1.429,P>0.05)。
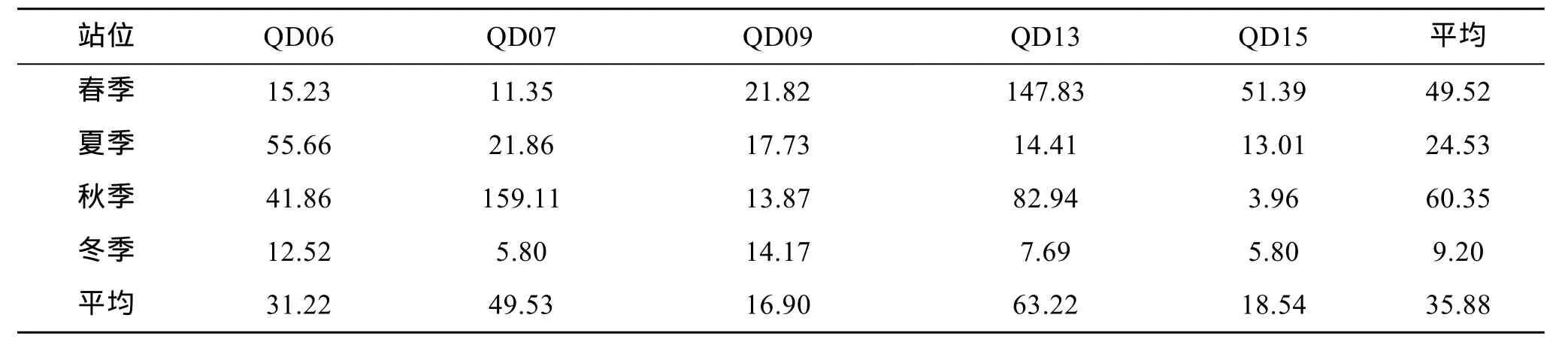
表5 研究海域大型底栖生物生物量Tab.5 The biomass of macrobenthos in the study area (g/m2)
3 分析与讨论
3.1 多样性指数
香浓威纳指数通常用于环境质量评价,但评价环境污染程度的标准不尽一致。有的标准认为正常环境 H′指数值高,环境污染时 H′值低[17]。李永棋[18]、孔凡翔等[19]提出H′值小于1严重污染; 1~3,中度污染; 大于3,清洁。蔡晓明等[20]认为可将H′值分为四个等级:0~1为重污染; 1~2为中度污染; 2~3为轻度污染; 大于 3为清洁。蔡立哲等[21]在蔡晓明的基础上提出5级标准,考虑更加周全。国外有些学者认为多样性指数评价污染程度的值与研究区域沉积环境有关,不同生境选择多样性指数的分值有所不同[22]。参照蔡晓明和蔡立哲的评价标准,本研究海域 5个站位H′指数平均值在2~3之间,属于轻度污染状况。
3.2 丰度与生物量
本次调查海域总平均丰度为1 507 个/m2,结果远大于刘瑞玉等[2](平均丰度为 203个/m2)和李新正等[9](平均丰度为 386 个/m2)得出的报道,而小于袁伟等[16](平均丰度为2 183 个/m2)的报道。本次调查海域总平均生物量为35.88 g/m2,结果远小于李新正等[9](平均生物量为 151.18 g/m2)和袁伟等[16](平均生物量为 469.90 g/m2)的报道,而与于子山等[23](平均生物量为41.90 g/m2)得出的结果相差不大。
造成如此大的差异可能是由于以下原因:(1) 本实验只在胶州湾中部设了 5个站,这与袁伟等研究的胶州湾西部海域和刘瑞玉、李新正等研究的整个胶州湾是不同的; (2) 袁伟和李新正所调查的海域都出现了大量的菲律宾蛤仔。尤其是袁伟等调查的海域,D站位菲律宾蛤仔的生物量高达2 157 g/m2,对结果产生了重大的影响,如果除去这一因素,其平均生物量仅为44.50 g/m2。而本次调查的海域位于胶州湾中部,远离菲律宾蛤仔的养殖区,虽然个别站位也采集到该生物,但对结果没有决定性的影响;(3) 可能是使用网筛孔径的不同,本研究采用的是0.5 mm的网筛,这样就保存了数量较大的小个体的多毛类生物。
3.3 丰度生物量比较曲线
通过丰度和生物量比较曲线(简称 ABC曲线),可以了解底栖生物群落发生的变化,从而揭示环境的污染状况[24-26]。一般地,若丰度曲线位于生物量曲线之下,代表一种群落未受干扰的状况; 若丰度曲线位于生物量曲线之上,代表一种群落受到严重干扰的状况; 若丰度曲线与生物量曲线重叠或交叉,代表一种群落受到中等干扰的状况。本文对春季航次的5个站位做了ABC曲线(图2)。

图2 大型底栖生物丰度和生物量比较曲线Fig.2 Comparison of the abundance and biomass of macrobenthos
ABC结果表明,该海域环境状况比较好,有轻度污染,与 H′结果相吻合。QD06、QD07、QD09、QD13四个站代表大型底栖生物群落受到干扰较轻,亦即污染较轻,QD15站的ABC指示的是接近未受扰动的群落结构。其他3个航次所做ABC曲线与本航次结果相似。
4 结论
本文通过对沉积物中有机质含量、生物多样性指数和丰度生物量比较曲线的综合分析认为,胶州湾中部海域环境质量状况比较好,污染较轻,大型底栖生物群落结构受到的扰动较轻。
[1]古丽娅诺娃,吴宝铃.胶州湾底栖生物群落[J].海洋科学集刊,1963,3:51-61.
[2]刘瑞玉.胶州湾生态学和生物资源[M].北京:科学出版社,1992.
[3]孙道元,张宝琳,吴耀泉.胶州湾底栖生物动态的研究[J].海洋科学集刊,1996,37:103-114.
[4]毕洪生,孙松,孙道元.胶州湾大型底栖生物群落的变化[J].海洋与湖沼,2001,32(2):132-138.
[5]毕洪生,孙道元.胶州湾多毛类的生态特点[J].生态学报,1998,18(1):63-68.
[6]李宝泉,李新正,王洪法,等.胶州湾大型底栖软体动物物种多样性研究[J].生物多样性,2006,14(2):136-144.
[7]于海燕,李新正,李宝泉,等.胶州湾大型底栖甲壳动物数量动态变化[J].海洋与湖沼,2005,36(4):289-295.
[8]李新正,王洪法,于海燕,等.胶州湾棘皮动物的数量变化及与环境因子的关系[J].应用与环境生物学报,2004,10(5):618-622.
[9]李新正,于海燕,王永强,等.胶州湾大型底栖动物的多样性现状[J].生物多样性,2001,9(1):80-84.
[10]毕洪生,冯卫.胶州湾底栖生物多样性初探[J].海洋科学,1996,108(6):58-62.
[11]袁伟,张志南,于子山.胶州湾西部海域大型底栖动物多样性的研究[J].生物多样性,2007,15(1):53-60.
[12]袁伟,张志南,于子山.胶州湾西部海域大型底栖动物次级生产力初步研究[J].应用生态学报,2007,18(1):145-150.
[13]国家技术监督局.海洋调查规范.海洋生物调查.中华人民共和国国家标准GB.北京:中国标准出版社,1991.
[14]刘昌岭,朱志刚,贺行良,等.重铬酸钾氧化-硫酸亚铁滴定法快速测定海洋沉积物中的有机碳[J].岩矿测试,2007,26(3):205-208.
[15]韩洁,张志南,于子山.渤海中、南部大型底栖动物的群落结构[J].生态学报,2004,24(3):531-537.
[16]袁伟,张志南,于子山,等.胶州湾西北部海域大型底栖动物群落研究[J].中国海洋大学学报,2006,36:91-97.
[17]国家质量技术监督局GB17378,7-1998,海洋监测规范第七部分,1998.
[18]李永棋,丁美丽.海洋污染生物学[M].北京:海洋出版社,1991,445-449.
[19]孔繁翔.环境生物学 [M].北京:高等教育出版社,2000,162-163.
[20]蔡晓明,任久长,宗志祥,等.青龙河底栖无脊椎动物群落结构及其水质评价[J].应用生态学报,1992,3(4):364-370.
[21]蔡立哲,马丽,高阳,等.海洋底栖动物多样性指数污染程度评价标准的分析[J].厦门大学学报,2002,41(5):641-646.
[22]Wetsbegrtsbegr S B,Rnaasinhge J A,Dauer D M,et a1.An estuarine benthic index of biotic integrity (B-IBI)for Chesapeake Bay[J].Estuaries.1997,20(l):149-158.
[23]于子山.张志南,王诗红.胶州湾北部软底大型底栖动物丰度和生物量的研究[J].青岛海洋大学学报,2000,30(2):439-444.
[24]田胜艳,于子山,刘晓收,等.丰度/生物量比较曲线法监测大型底栖动物群落受污染扰动的研究[J].海洋通报,2006,25(1):92-96.
[25]Lardicci C,Rossib F.Detection of stress on macrozoobenthos:Evaluation of some methods in a coastal mediterranean lagoon [J].Marine Environmental Research,1998,45:367-386.
[26]Stenton-dozey J M E,Jackson L F,Busby A J.Impact of mussel culture on macrobenthic community structure in Saldanha Bay,South Africa[J].Marine Pollution Bulletin,1999,39:357-366.
