低温强化生物除磷反应器中微生物的竞争关系
2010-03-14任南琪
亢 涵,李 楠,任南琪
(哈尔滨工业大学城市水资源与水环境国家重点实验室,哈尔滨150090,rnq@hit.edu.cn)
强化生物除磷(EBPR)技术利用微生物高效去除污水中的磷酸盐,已经广泛应用于污水处理厂中.聚磷菌和聚糖菌是存在于强化生物除磷系统(EBPR)中的竞争菌.聚磷菌在厌氧阶段分解体内 polyP释放能量来吸收底物合成体内的PHAs储备,在好氧阶段分解体内的PHAs,释放能量吸收磷酸盐合成体内polyP[1].聚糖菌与聚磷菌不同之处在于,厌氧阶段分解体内糖原释放能量,用来吸收底物合成PHAs,在好氧阶段分解体内的PHAs释放能量合成糖原[2].为了让反应器取得更好的除磷效果,前人研究了EBPR系统的影响因素.Zhang等发现当 pH从7.0降到6.5时,反应器除磷能力降低[3].Serafim等发现当pH从7.0增加到8.5时,反应器的除磷能力增加[4]. Oehmen等认为丙酸比乙酸有利于提高EBPR系统的除磷效果,因为聚糖菌吸收丙酸速率小于聚磷菌[5].Panswad等发现,温度从20℃升到35℃时厌氧释磷速率增加,但好养磷吸收速率降低,即使在20℃,反应器中仍存在大量聚糖菌[6].溶解氧(DO)也影响聚磷菌和聚糖菌的竞争[7].
本研究在低温下运行了强化生物除磷反应器,利用FISH技术监测其中的聚磷菌和聚糖菌并将它们量化,研究其竞争关系及其对反应器除磷效果的影响.
1 实验
1.1 实验装置与方法
试验采用有效容积为2 L的圆柱形有机玻璃反应器,内径为10 cm,高度为35 cm.反应器间歇式运行,12 h一个周期.0~90 min厌氧搅拌(其中0~8 min进水),90~330 min好氧曝气,沉降15 min,出水10 min,闲置5 min.温度与DO用WTW DO测定仪监测,控制反应器内温度在(15± 2)℃,好氧阶段溶解氧质量浓度>2.0 mg·L-1.
1.2 实验材料
接种污泥取自哈尔滨文昌污水处理厂曝气池,该污水厂采用传统活性污泥法,污泥具有良好的有机物去除效果,除磷效率<30%.
实验用水采用人工配水,进水的主要组成物质与浓度为 CH3COONa·3H2O 4.69 mmol/L (COD为300 mg·L-1),NH4Cl 1.79 mmol/L(ρN= 25 mg·L-1),NaH2PO4·2H2O 0.32 mmol/L(ρP= 10 mg·L-1),此外每升进水中含有0.5 mL微量元素液:EDTA 100 mg·L-1,MgSO4·7H2O 20.6 g·L-1,CaCl25.6 g·L-1,MnSO4·H2O 0.14 g·L-1,FeSO4·7H2O 5.7 g·L-1,CuCl2·2H2O 0.19 mg·L-1,ZnCl20.05 g·L-1,H3BO30.05 g·L-1.
1.3 取样与水质分析方法
为了考察反应器启动过程中聚磷菌的形态与数量以及与污染物处理效果的关系,分别在反应器运行第0,10,20,30,40,50,60 d取样.取样后离心分离混合液,上清液过滤后按照《水和废水监测分析方法》(第三版)检测COD,PO4
3-等水质指标,污泥部分立即固定用于FISH分析.
1.4 FISH分析
1.4.1 样品的固定
污泥样品在质量分数为4%多聚甲醛中4℃固定2 h,在PBS溶液中冲洗2次,悬浮于PBS-乙醇(体积比1∶1)溶液中,于-20℃保存.
1.4.2 荧光探针
实验应用16S rRNA探针如表1所示.

表1 实验应用的16S rRNA探针
1.4.3 原位杂交
将固定的样品置于用明胶包背的载玻片上,风干后于体积分数分别为50%,80%,95%,100%的乙醇中各脱水3 min,风干后等待杂交.污泥样品在46℃杂交2.5 h,杂交液成分如下:0.9 mol/L NaCl,20 mmol/L Tris-HCl,质量分数为 0.01% SDS,体积分数为20%(EUB388)和体积分数为35%(PAOmix、DFmix、GAOsmix)去离子甲酰胺,pH 7.2.杂交后于48℃用洗液(40 mmol/L NaCl,质量分数为0.01%SDS,20 mmol/L Tris-HCl,pH 7.2)洗20 min,之后用蒸馏水洗去残留洗液,自然风干[12].风干后样品用共聚焦显微镜 LSM 510 META(德国Zeiss公司)观察,并用其配套软件获得聚磷菌数量在全菌数量中所占比例.
2 结果与分析
2.1 COD去除效果
图1给出了反应器COD去除效果.由图可见,在反应器运行的60 d中,COD去除率平稳,保持在95%左右.大部分COD在厌氧阶段去除.0~20 d厌氧末期COD浓度变化较大,20 d之后趋于平稳.

图1 反应器COD的去除情况
2.2 磷酸盐去除效果
图2给出了低温运行的反应器中磷的去除效果.由图可见,初期磷酸盐去除率不稳定,20 d后,出水磷浓度逐渐降低,使磷酸盐去除率持续上升,60 d时达到最大值86.89%.初期厌氧末期磷浓度波动较大,20 d后逐渐增加,45 d时达到最大值26.44 mg·L-1.50 d时突然降低,之后又再次升高.
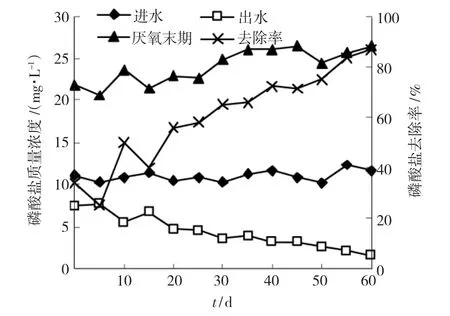
图2 反应器磷酸盐的去除情况
2.3 FISH原位检测反应器中聚糖菌
图3分别为反应器中聚磷菌和聚糖菌的双杂交FISH图片.图3(a)为反应器运行50 d时反应器中的聚磷菌FISH图片.这张图片中用到的杂交探针为FITC染料标记的EUB338mix探针和CY3染料标记的PAOmix探针,图中的黄色荧光为杂交了这两中探针的Rhodocyclus sp.,绿色荧光为只杂交了EUB338mix探针的菌.图3(b)为反应器运行10 d时反应器中的聚糖菌FISH图片.这张图片中用到的杂交探针为FITC染料标记的EUB338mix探针、CY3染料标记的PAOmix探针和CY5染料标记的DFmix探针.图中圆箭头标记的红色荧光为杂交了GAOmix探针的Competibacter phosphatis(Gammaproteobacteria),标准箭头标记的蓝色荧光为杂交了DFmix探针的Defluviicoccus spp.(Alphaproteobacteria),绿色为杂交了EUB338mix探针的菌.
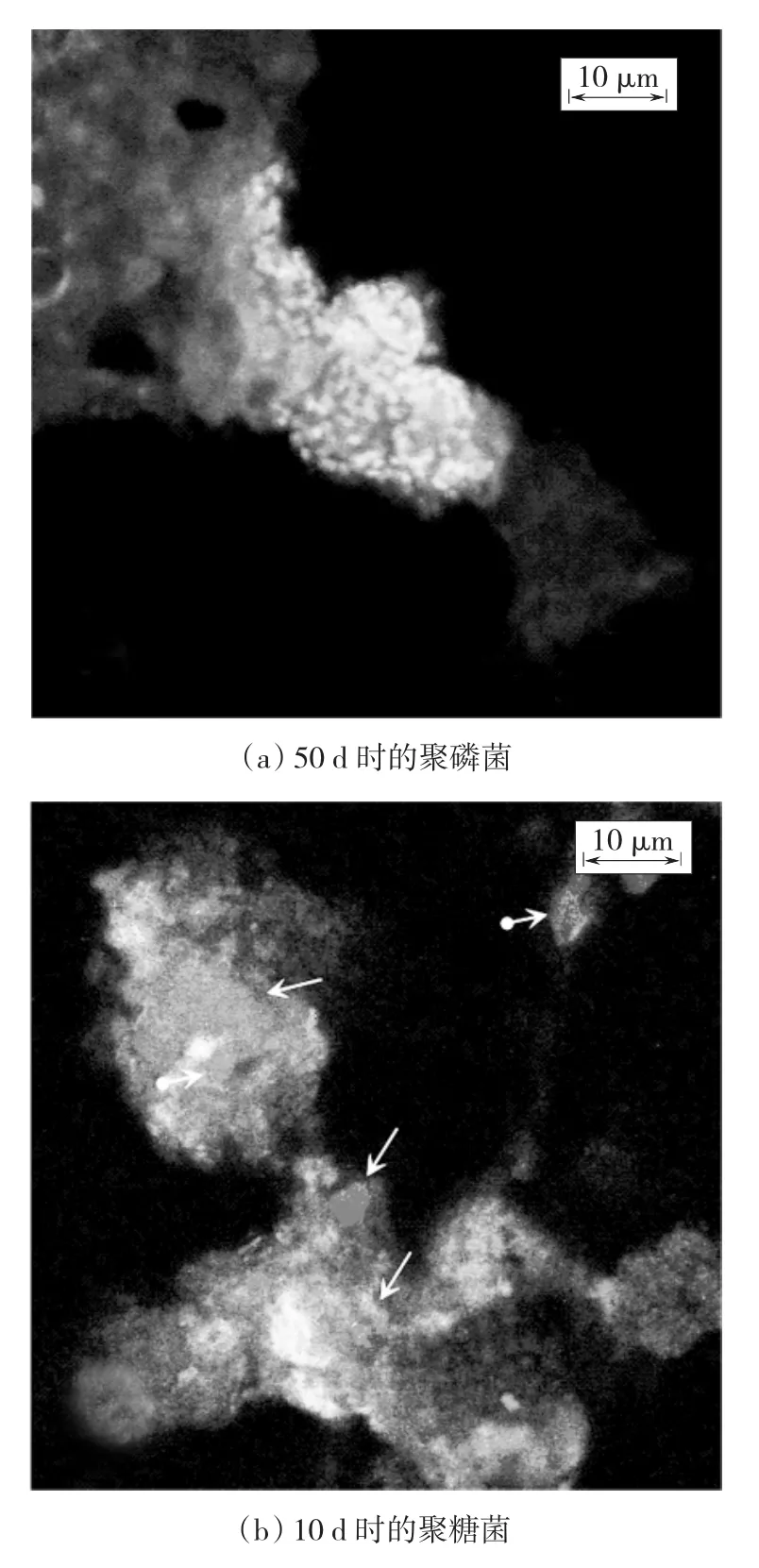
图3 反应器中聚磷菌和聚糖菌的FISH图片
2.4 聚糖菌含量
利用共聚焦显微镜配套软件,可获得聚磷菌在全菌中所占的数量比例(图4).由图可见,聚磷菌在全菌中的数量比例逐渐上升.30 d之前聚磷菌增长较快,数量从19.96%增加到33.13%. 30~50 d聚磷菌数量保持在33%左右,60 d时聚磷菌数量突然增加,达到最大值41.49%.0~30 d反应器中的Alphaproteobacteria数量占全菌数量的比例由15.76%下降到3.1%,30~60 d保持在2.6%左右.Gammaproteobacteria数量逐渐上升,但在全菌数量中所占比例不高,最高为8.11%.
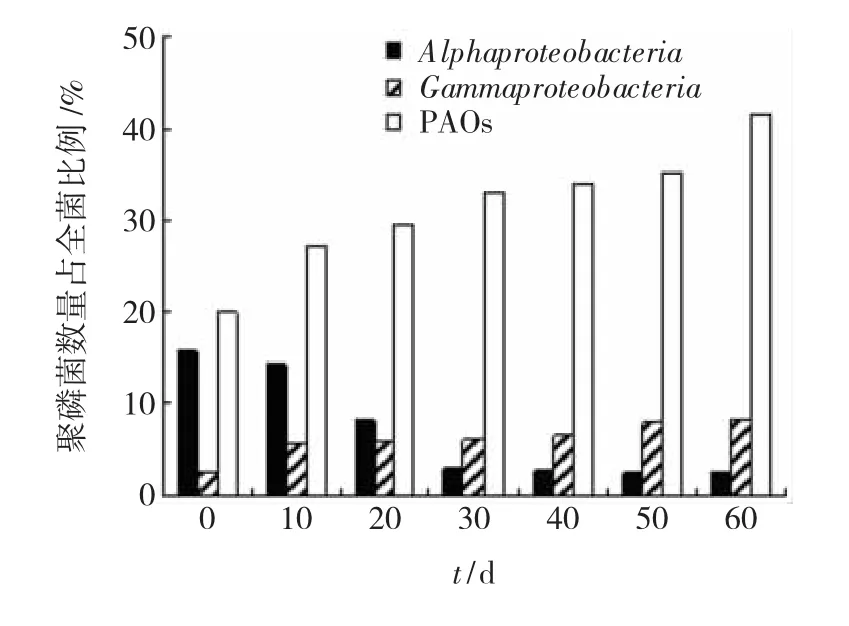
图4 污泥中聚磷菌和聚糖菌占全菌的数量比例
3 讨论
图4(a)为聚磷菌50 d时的照片.此时反应器的除磷率为75%.图中聚磷菌菌体密集成团,菌群面积较大.图5中,此时聚磷菌占全菌的数量比例为35.1%,为0~50 d的最大值.图4(b)为聚糖菌10 d时的照片.图中蓝色为Alphaproteobacteria,此时反应器中Alphaproteobacteria数量较多,占全菌数量的14.24%,菌体呈现明显的四聚体(TFOs)形态,且在污泥中分散存在.图中红色为Gammaproteobacteria,Gammaproteobacteria菌体为大球型,数量较少.
聚糖菌是强化生物除磷反应器中聚磷菌的竞争菌.由图5可以看出,0 d时Alphaproteobacteria的数量较多,达到了15.76%,与聚磷菌的数量19.96%比较接近,Gammaproteobacteria数量很少,为2.49%.低温运行了20 d后,聚磷菌的数量不断增加,Alphaproteobacteria的数量不断降低,而Gammaproteobacteria的数量在反应器运行期间一直保持增加,但是占全菌数量的比例较少,最高为8.11%.Alphaproteobacteria和Gammaproteobacteria都是聚磷菌的竞争菌,但Alphaproteobacteria的数量却不断下降,而Gammaproteobacteria的数量虽然较少,但仍保持增长.这种现象可以解释为,低温条件下聚磷菌更易获得足够底物合成体内PHA用于生长繁殖;而Alphaproteobacteria在低温下吸收底物合成PHA的速率降低,导致其数量的减少;对于Gammaproteobacteria,一方面受到低温影响,一方面受到聚磷菌的数量优势的制约,其数量较少且增加缓慢.这与 Erdal等[13]和 Lopez-Vazquez[14]发现的现象相一致.
观察图2和3发现,与20 d以后的数据相比,20 d之前反应器的各项指标均不稳定,这时是聚磷菌占据优势地位而聚糖菌逐渐被淘汰的调整阶段.20~50 d,聚磷菌增长减缓,数量保持在33%左右,没有了竞争菌的干扰,聚磷菌的除磷能力在逐渐增加.此时COD去除效果稳定,磷酸盐去除率持续上升,厌氧末期磷浓度在30 d之后保持稳定,这与聚磷菌含量曲线相一致.这种现象说明,聚磷菌的数量决定了厌氧末期磷释放量.
观察50~60 d的厌氧末期磷浓度可以发现,50 d时虽然聚磷菌占全菌数量的比例没变,但厌氧磷释放减少,50 d后,随着聚磷菌数量突然增加,厌氧磷释放再次恢复,而整个过程中,COD去除率和厌氧末期COD浓度保持稳定.这种现象可解释为聚磷菌为了繁殖积累体内的磷储备,而减少厌氧释磷量.亢涵等曾发现,在反应器启动阶段,快速增殖的新生聚磷菌不能立刻行使除磷能力,要有一段“积累期”,形成 PHA和 polyP储备[15].而在本文的实验中,聚磷菌快速增殖之后的反应器处理效果并没有滞后.观察亢涵等的聚磷菌数量比例曲线可以发现,聚磷菌的两个增殖阶段的菌体数量增长迅速,比如第一增殖阶段聚磷菌占全菌数量比例在5 d内增加了23.59%.短时间内的大量增殖需要大量的PHA和polyP供给,因此出现了反应器除磷效果延后的现象.在本文的实验中,50~60 d聚磷菌占全菌数量比例在5 d内平均增加了3.2%,数量较少,对反应器的处理效果没有造成影响.
4 结论
1)强化生物除磷SBR反应器在低温下运行了60 d.0~20 d反应器的各项指标不稳定,这时反应器中的菌群结构发生变化,聚磷菌和聚糖菌竞争优势地位.此阶段为反应器的调整阶段,20 d后反应器各项指标逐渐稳定,磷去除率增加.
2)在低温运行的反应器中,0~20 d,低温更有利于聚磷菌的生长繁殖,Alphaproteobacteria被淘汰.而Gammaproteobacteria受到温度与聚磷菌的制约,占全菌数量比例最高为8.11%.
3)50~60 d聚磷菌出现了一个快速增殖阶段,此时反应器的处理效果没有出现亢涵等所说的延迟现象.亢涵等的实验结果中,聚磷菌在短时间内大量增殖,聚磷菌占全菌数量比例5 d内增加了23.59%,PHA和polyP供给不足,导致反应器处理效果延后.本文的实验中,聚磷菌数量5 d内平均增加了3.2%,没有影响反应器的处理效果.
[1]MINO T,LIU W T,KURISU F,et al.Modeling glycogenstorage and denitrification capability of microorganisms in enhanced biological phosphate removal processes[J].Water Sci Technol,1995,31,25-34.
[2]LIU W T,MINO T,NAKAMURA K,et al.Glycogen accumulating population and its anaerobic substrate uptake in anaerobic-aerobic activated sludge without biological phosphorus removal[J].Water Research,1996,30(1):75-82.
[3]ZHANG T,LIU Y,FANG H H P.Effect of pH change on the performance and microbial community of enhanced biological phosphate removal process[J].Biotechnol Bioeng,2005,92(2),173-182.
[4]SERAFIM L S,LEMOS P C,REIS M A M.Effect of pH control on EBPR stability and efficiency[J].Water Sci Technol,2002,46(4/5),179-184.
[5]OEHMEN A,SAUNDERS A M,VIVES M T,et al. Competition between polyphosphate and glycogen accumulating organisms in enhanced biological phosphorus removal systems with acetate and propionate as carbon sources[J].J Biotechnol,2006,123(1),22-32.
[6]PANSWAD T,DOUNGCHAI A,ANOTAI J.Temperature effect on microbial community of enhanced biological phosphorus removal system[J].Water Res,2003,37 (2),409-415.
[7]OEHMEN A,LEMOS P C,CARVALHO G,et al.Advances in enhanced biological phosphorus removal:From micro to macro scale[J].Water Res,2007,41(11),2271-2300.
[8]AMMAN R I,BINDER B J,OLSON R J,et al.Combination of 16S rRNA-targeted oligonucleotide probes with flow cytometry for analyzing mixed microbial populations[J].Appl Environ Microbiol,1990,56(6),1919-1925.
[9]DAIMS H,BRUHL A,AMANN R,et al.The domainspecific probe EUB338 is insufficient for the detection of all Bacteria:Development and evaluation of a more comprehensive probe set[J].Syst Appl Microbiol,1999,22(3),434-444.
[10]CROCETTI G R,HUGENHOLTZ P,BOND P L,et al. Identification of polyphosphate-accumulating organisms and design of 16S rRNA-directed probes for their detection and quantitation[J].Appl Environ Microbiol,2000,66(3),1175-1182.
[11]WONG M T,TAN F M,NG W J,et al.Identification and occurrence of tetrad-forming Alphaproteobacteria in anaerobic-aerobic activated sludge processes[J].Microbiology,2004,150,3741-3748.
[12]AMANN R I.In situ identification of micro-organisms by whole cell hybridization with rRNA-targeted nucleic acid probes[C]//AKKERMANS A D L,ELSAS J D,DE BRUIJ F J,editors.Molecular microbial ecology manual.London:Kluwer,1995:1-15.
[13]ERDAL U G,ERDAL Z K,RANDALL C W.The competition between PAOs(phosphorus accumulating organisms)and GAOs(glycogen accumulating organisms)in EBPR(enhanced biological phosphorus removal)systems at different temperatures and the effects on system performance[J].Water Sci Technol,2003,47(11),1-8.
[14]LOPEZ-VAZQUEZ C M,OEHMEN A,HOOIJMANS C M,et al.Modeling the PAO—GAO competition:Effects of carbon source,pH and temperature[J].Water Research,2009,43(2),450-462.
[15]亢 涵,王秀蘅,李楠,等.生物除磷系统启动期聚磷菌的FISH原位分析与聚磷特性[J].环境科学,2009,30(1):80-84.
