BWMK1互作基因BWIP4对粳稻的转化
2010-03-07刘玲高佳潘素君胡亚军刘雄伦王国梁戴良英
刘玲,高佳,潘素君,胡亚军,刘雄伦,王国梁,戴良英*
(1.湖南农业大学 a.生物安全科学技术学院;b.水稻基因组学实验室,湖南 长沙 410128;2.俄亥俄州州立大学 植物病理系,俄亥俄州 哥伦布 43210)
促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)是一类存在于所有真核生物中的丝氨酸/苏氨酸蛋白激酶[1-4].BWMK1是第1个被克隆鉴定的水稻MAPK基因,它不仅受稻瘟菌浸染和创伤强烈诱导表达[5],还受低温、干旱、黑暗和茉莉酸的诱导,苯并噻二唑(BTH)、光照和水杨酸则负调控其表达[6].BWMK1与植物防御、胁迫和生长发育相关,并可能在植物不同的信号传导途径中起交叉传导作用[6]. 过量表达BWMK1的转基因烟草,植株叶片上形成自发性的过敏性坏死病斑,防卫反应基因表达水平显著提高,而且表现出对烟草黑胫病和野火病的抗病性[7].为了探求BWMK1参与植物信号传导的途径及其作用,笔者通过酵母双杂交体系,获得了7个BWMK1互作基因BWIP1~BWIP7.从中选取BWIP4(水稻磷酸盐转运蛋白)基因,构建了BWIP4-RNAi表达载体pANDA-BWIP4和超表达载体NCGR-1300-BWIP4,经农杆菌介导法,将 pANDA-BWIP4和 NCGR-1300-BWIP4导入粳稻日本晴中,分析了BWMK1互作基因BWIP4的功能及其调控的抗病信号途径.
1 材料和方法
1.1 材 料
供试粳稻品种日本晴、农杆菌菌株EHA105、大肠杆菌DH10B、BWIP4干涉表达载体pANDABWIP4和超表达载体NCGR-1300-BWIP4,均为湖南农业大学水稻基因组学实验室保存.
1.2 方 法
1.2.1BWIP4基因干涉载体和超表达载体构建
将目的片段克隆到 pEUTR™载体(购自Invitrogen 公司).带有目的片段载体 pEUTR™载体,通过位点特异性重组基因克隆技术重组构建在pANDA载体中,完成RNAi(pANDA-BWIP4)干涉载体的构建,干涉载体克隆引物序列,BWIP4Fi:5′-CACCGCAGACGGCGTAGTGTATGA-3′;BWIP4Ri:5′-GTGCCAAATTGCTGGTCTG-3′.
利用PCR引物中引入的酶切位点,以反转录合成的cDNA为模板,扩增BWIP4全长cDNA,构建超表达载体(NCGR-1300-BWIP4).超表达载体克隆引物序列,BWIP4Fox:5′-GGCGCGCCATGGCGC GGCAGGAG-3′;BWIP4Rox:5′-TTAATTAACTAC GCCGTCTGCGGCCGCAC-3′.
质粒提取、酶切、连接、转化等参照文献[8]方法.所用培养基配方及转化培养基按文献[9]、[10].
1.2.2 转化体系
农杆菌介导转化:水稻愈伤诱导10~15 d,愈伤继代10~15 d,农杆菌(菌液OD值0.8左右)浸染水稻愈伤30 min左右,共培养2~3 d (26 ℃暗培养),50 mg/L 潮霉素筛选,预分化至出绿点,分化成苗,1/2MS+50 mg/L潮霉素生根培养基生根,移栽幼苗.
1.2.3 GUS活性测定
水稻细胞中GUS基因的表达基本按文献[11]方法测定.水稻组织在含10 mmol/L EDTA、100 mmol/L 磷酸钠缓冲液、0.5 mmol/L 亚铁氰化钾、0.5 mmol/L 高铁氰化钾、0.1 %X-Gluc溶液中37 ℃保温过夜.
1.2.4 水稻叶片DNA和总RNA的提取
按CTAB法提取转基因水稻DNA,溶于无菌水,用1.0%的琼脂糖凝胶电泳估计其浓度,置于-20 ℃下保存备用.
转基因水稻叶片总RNA的提取及转录合成cDNA参照文献[8].
1.2.5 转基因株系抗潮霉素基因PCR检测
转基因植株潮霉素抗性标记基因鉴定引物为hpt-2F:5′-GATGTTGGCGACCTCGTATT-3′,hpt-2R:5′-GTGCTTGACATTGGGGAGTT-3′. 采用20 μL的PCR反应体系,其中含有2 μL Buffer、2 μL dNTPs、PCR 正、反向引物各1.0 μL、Taq酶0.4 μL,水稻模板DNA 约100 ng.扩增反应条件为:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.0 min,循环32 次,最后72 ℃延伸7 min.PCR产物于4 ℃保存.以日本晴非转化水稻DNA,在相同条件下进行扩增作为阴性对照,扩增产物用1.0%的琼脂糖凝胶电泳进行检测.
1.2.6 转基因株系RT-PCR检测
对抗潮霉素阳性植株RT-PCR检测,参照Takara公司RT-PCR试剂盒说明书进行.引物序列,BWIP4-1F:5′-TCACCCTCATCATCTCCTC C-3′;BWIP4-1R:5′-GCTGTTCCGGGTCACCATC -3′.
2 结果与分析
2.1 BWIP4干涉和超表达载体的酶切鉴定
基于pANDA空载体KpnI和SacI双酶切能切开约4.4 kb左右的条带,如果目的片段与pANDA载体重组位点成功置换,那么利用KpnI和SacI双酶切能切出1.4 kb左右的条带.将含BWIP4基因的RNAi重组质粒经KpnI和SacI对双酶切鉴定,得到了1.4 kb左右的目的片段(图1),与预期结果相符.证明基因成功重组到表达载体中.
鉴于表达载体NCGR-1300不包含BamHI和KpnI这2个酶切位点,而BWIP4基因序列中包含这2个酶切位点,利用这2个酶切位点鉴定超表达载体,BamHI和KpnI双酶切重组质粒NCGR-1300-BWIP4,得到2条酶切片段,其中小片段约为1.2 kb左右(图2),符合BWIP4基因序列中两酶切位点间的距离,证明目的基因BWIP4已成功导入NCGR-1300中.

图 1 BWⅠP4 干涉载体KpnⅠ和SacⅠ双酶切鉴定Fig.1 Ⅰdentification of BWIP4 RNAi constructs by Kpn Ⅰ + Sac Ⅰ
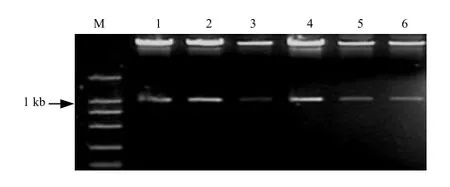
图 2 BWⅠP4 超表达载体NCGR-1300-BWⅠP4 Bam HⅠ和 KpnⅠ双酶切鉴定Fig.2 Ⅰdentification of BWIP4 over-expression construct by digestion
2.2 转 化
利用农杆菌介导法将 pANDA-BWIP4和NCGR-1300-BWIP4载体导入日本晴,经过愈伤诱导、共培养、筛选、预分化、分化和生根,获得了35个BWIP4-RNAi和136个BWIP4-Overexpression转基因水稻株系.
2.3 BWIP4-RNAi植株GUS基因活性检测
将经共培养后的愈伤组织、分化后得到的 T0代植株的根和叶以及T1代种子进行GUS检测.结果显示,有些愈伤组织可以观察到蓝色反应,表明携带了GUS基因.T0代植株的根、叶和T1代种子部分呈蓝色反应,表明 GUS基因已经整合到植株染色体上并得到表达.
2.4 转基因植株的PCR检测
提取转基因水稻总DNA,利用抗Hyg基因引物进行PCR扩增,得到约837 bp的条带(图3),其中,BWIP4-RNAi转化植株成功扩增出抗Hyg基因的植株与GUS显色反应的株系一致.

图 3 转基因株系抗Hyg基因PCR检测Fig.3 Ⅰdentification of transgenic lines by PCR
2.5 转基因植株RT-PCR检测结果
用引物BWIP4-F/BWIP4-R对反转录合成的cDNA进行PCR扩增,BWIP4-RNAi转基因株系和BWIP4-Overexpression转基因株系中都得到了约296 bp大小的特异条带.在RNAi株系中,BWIP4的表达量明显低于日本晴,说明这一基因在RNAi株系中得到成功干扰(图4-A).超表达株系中,BWIP4的表达量明显高于日本晴,说明这一基因在转基因株系中得到超表达(图4-B).

图 4 转基因株系BWⅠP4 RT-PCR分析Fig.4 Expression level analysis of BWIP4 transgenic plants
3 讨 论
本研究对已获得的干涉和超表达转基因株系通过 GUS、PCR和 RT-PCR检测,获得 4个BWIP4-RNAi和5个BWIP4超表达阳性转基因株系,为进一步分析BWIP4基因及其相关基因功能奠定了基础.在很多高等植物中已经证实,高亲和磷转运蛋白属于Pht1和Pht2两个主要的基因家族,且大多数植物高亲和磷转运蛋白属于Pht1家族[12-15].BWIP4(属于Pht1家族)是一个水稻高亲和磷酸盐转运蛋白,但至今为止有关BWIP4基因和功能的研究报道较少.将分析BWIP4基因过量表达和干涉时,水稻在不同磷含量环境条件下对磷素的吸收效率和对病原菌侵染的表型反应,以及相关基因表达量的变化,从而深入探讨BWIP4基因在水稻抗病途径中的作用机制.
[1] Bogre L,Meskiene I,Heberle-Bors E,et al.Stressing the role of the MAP kinase in mitogenic stimulation[J].Plant Mol Biol,2000,43:705-718.
[2] Ligterink W,Hirt H.Mitogen-activated protein (MAP) kinase pathways in plants:Versatile signaling tools [J].Int Rev Cytol,2001,201:209-275.
[3] Jonak C,Ökresz L,Bögre L,et al.Complexity, cross talk and integration of plant MAP kinase signalling [J].Curr Opin in Plant Biol,2002,5(5):415-424.
[4] Zhang S, Klessig D F. MAPK cascades in plant defense signaling[J].Trends Plant Sci,2001,6(11):520-527.
[5] He C,Fong SHT,Yang D,et al.BWMK1,a novel MAP kinase induced by fungal infection and mechanical wounding in rice[J].Mol PlantMicrobe Interact,1999,12(12):1064-1073.
[6] Hong W F,He C Z,Wang L J,et al.BWMK1responds to multiple environmental stress and plant hormones [J].Journal of Integrative Plant Biology,2007,49:843-851.
[7] Cheong Y H,Moon B C,Kim J K,et al.BWMK1,a rice mitogen-activated protein kinase,locates in the nucleus and mediates pathogenesis-related gene expression by activation of a transcription factor[J].Plant Physiol,2003,132(4):1961-1972.
[8] Sambrook J,Fritsch E F,Maniatis T.分子克隆实验指南[M].金冬雁,译.北京:科学出版社,2002.
[9] Hiei Y,Ohta S.Efficient transformation ofrice (Oryza sativalL.) mediated byAgrobacteriumand sequenceananalysis of the boundaries of the T-DNA[J].The Plant Journal,1994,6(2):271-282.
[10] 向建华,高国赋,周小云,等.OsWAX2基因的植物表达载体构建及遗传转化[J].湖南农业大学学报:自然科学版,2007,33(6):639-645.
[11] Jefferson R A.Assaying chimeric genes in plants:The GUS gene fusion system[J].Plant Mol Biol Rep, 1987,5:387-405.
[12] Rausch C,Bucher M.Molecular mechanisms of phosphate transport in plants[J].Planta,2002,216(1):23-37.
[13] Bucher M.Functional biology of plant phosphate uptake at root and mycorrhiza interfaces[J].New Phytologist,2007,173(1):11-26.
[14] Chen A Q,Hu J,Sun S B,et al.Conservation and divergence of bothphosphate and mycorrhiza-regulated physiological responses and expression patterns of phosphate transporters in solanaceous species[J].New Phytologist,2007,173(4):817-831.
[15] Javot H,Penmetsa R V,Terzaghi N,et al. AMedicago truncatulaphosphate transporter indispensable for the arbuscular mycorrhizal symbiosis[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(5):1720-1725.
英文编辑:胡东平
