对虾白斑综合征病毒wsv477基因的克隆表达与时相分析
2010-03-07韩芳王志勇巫旗生王晓清
韩芳,王志勇,巫旗生,王晓清*
(1.湖南农业大学 动物科学技术学院,湖南 长沙 410128;2.集美大学 水产学院,福建 厦门 361021)
白斑综合征病毒(white spot syndrome virus,WSSV)发现于20世纪90年代初,是造成对虾大面积暴发性流行病的主要病原体[1-2].该病毒不仅可以广泛感染所有人工养殖的对虾,还能感染其他淡水及海水甲壳类,如螃蟹、螯虾等,甚至可以感染昆虫.目前尚未发现能够耐受WSSV的虾群,而感染的对虾在一周内死亡率高达90%~ 100%[1].该病害严重阻碍对虾养殖业的发展,还对海洋环境构成威胁,已成为全世界广泛关注和研究的热点.
研究表明,WSSV病毒是一种新型的有囊膜的环状双链DNA病毒,基因组长度约305 kb[3-4],属线头科(Nimaviridae),Whispovirus属[5].该病毒与昆虫杆状病毒形态上很相似,但基因比对没有同源性.生物信息学分析表明,该病毒约有181个开放阅读框,所编码的蛋白质和已知的蛋白质基本没有同源性.目前的研究主要是对WSSV结构和功能基因进行分析,寻找预防和控制白斑综合征感染的有效方法[5].在研究病毒功能基因时,需要确定可以转录表达的基因以及转录表达的时相.杨丰等[3]用生物学软件预测WSSV基因组蛋白质结构域时发现,在基因组274527至275150区间存在1个可能的病毒感染早期基因(wsv477基因).笔者将wsv477基因克隆到原核表达系统中,诱导了这个蛋白的表达,并进行了纯化,制备了多克隆抗体.现将结果报道如下.
1 材料与方法
1.1 材 料
成年小白鼠由厦门大学医学院提供;WSSV由国家海洋局第三海洋研究所提供;试验对虾为日本对虾(Penaeus japonicus),体长10~15 cm,购于厦门集美菜市场.引物由上海生工生物工程技术有限公司合成.
1.2 方 法
1.2.1 人工感染试验
试验前将对虾充气养殖3 d.随机抽取5只进行WSSV检测,确定试验用虾为不带WSSV的健康虾.感染时,每只对虾注射100 μL用生理盐水稀释的WSSV液,分别收集注射后0、2、4、6、12、24、48、96 h的鳃样品(各取2只等量混合),存放于超低温冰箱.
1.2.2 病毒DNA模板的制备
PCR模板的制备参照文献[6]的方法:将20 mg左右的对虾组织置于离心管中,加入200 μL裂解液(50 mmol Tris-HCl,pH8.0,25 mmol EDTA,4 mol guanidinum thiocyanate,0.5 % N-lauroylarcosine)后捣碎,12 000 r/min离心3 min,上清用二氧化硅吸附DNA,乙醇洗涤,60 ℃烘干后用20 μL蒸馏水溶解.
1.2.3wsv477基因克隆和重组质粒构建
wsv477基因 ORF克隆.根据已知的 WSSV ORF477序列(GenBank登录号DQ121373),设计1对引物,P1:5′-CGCGGATCC ATGTATATCTTCGTCG A-3′(BamHI),P2:5′-CCGGAATTCTTATAAGAAA TGTACAA-3′(EcoRI),下划线表示加入的BamHI 和EcoRⅠ酶切位点.以病毒DNA为模板扩增目的片段.PCR扩增条件为:94 ℃预变性3 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,30个循环,72 ℃延伸7 min.取少量PCR扩增产物经琼脂糖凝胶电泳进行检测,剩余的用DNA回收试剂盒(华舜,上海)回收纯化.
重组质粒构建.将回收的PCR产物经BamHI和EcoRⅠ酶切后,连接到经同样酶切的pGEX-4T-2载体(Pharmacia)中(重组质粒命名 pGEX-4T-2-wsv477),然后转化大肠杆菌BL21感受态细胞,少量制备质粒DNA,经双酶切检验后,送上海英骏公司进行测序确认.
1.2.4 重组质粒诱导表达
将测序正确的阳性克隆菌株置于含100 mg/L氨苄青霉素的LB培养基(10 g/L胰蛋白胨,5 g/L酵母浸粉,10 g/L氯化钠)中,37 ℃摇培过夜.次日按1 100转接后,继续培养3 h至OD600nm约为0.7,加入异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度1 mmol/L,37 ℃振荡培养4~6 h.5 000 r/min离心5 min,收集菌体,每1.5 mL菌液所得的菌体沉淀用100 μL的TE缓冲液悬浮,加入2×SDS- PAGE加样缓冲液煮沸10 min,进行12 % SDS - PAGE电泳,以转化空载体的E. coliBL21为对照,电泳结束后,用0.025 %考马斯亮兰R250进行显色后观察.
1.2.5 融合蛋白的可溶性分析和蛋白质纯化
按1%的接种量转接菌液250 mL,37 ℃摇培诱导.诱导表达的菌液于5 000 r/min 离心5 min,收集菌体,加入15 mL裂解液(含1 %Triton X-100的1×PBS),冰浴超声(超声10 s,间隔10 s,功率200 W)直至菌液清亮.4 ℃下15 000 r/min离心20 min后,分别取上清和沉淀,用于SDS-PAGE进行融合蛋白可溶性分析[7].
将超声裂解的菌液上清与Glutathione Sepharose 4B(Sigma)低温混匀装柱.用冰冷的PBS洗去杂蛋白,至流出液的OD280nm接近于0.用洗脱缓冲液(50 mmol/L Tris-HCl,10 mmol/L还原型谷胱甘肽,pH 8.0)洗脱目的蛋白.
1.2.6 多克隆抗体的制备
将纯化的wsv477-GST融合蛋白2 mL(质量浓度为100 μg/mL)与 2 mL弗氏完全佐剂(Sigma)乳化,腹腔注射 10只小白鼠进行免疫.初次免疫 1周后,改用不完全佐剂,每周加强免疫1次,连续4周.小鼠末次免疫3 d后断尾取血,免疫血清利用 ProteinA进行纯化[7].纯化后的抗体分装,于-80 ℃保存备用.
1.2.7wsv477转录时相分析
分别提取不同WSSV感染时间(0、2、4、6、12、24、48、96 h)的对虾鳃组织总RNA作为模板,用随机引物oligo (dT)逆转录合成cDNA第一条链,以wsv477基因特异的引物进行PCR扩增,以日本对虾β-actin基因作为阳性对照.
1.2.8 蛋白质印迹( Western blot) 检测
用蛋白裂解液(50 mmol Tris,1.0 mmol EDTA,150 mmol NaCl,0.1 % SDS,1 % TritonX-100,1 %去氧胆酸钠,1 mmol蛋白酶抑制剂coclktail)从对虾鳃组织中提取总蛋白.采用文献[8]的方法定量蛋白质后,取1 mg蛋白质上样,在12 %SDS-PAGE上进行电泳,分离后转移至PVDF膜(70 V, 1 h).用5 %脱脂牛奶(溶于TBST中)封闭1 h,以1 ∶ 10 000的比例加入wsv477的多克隆抗体,与膜杂交反应1 h,TBST多次漂洗,再加HRP标记的羊抗鼠二抗杂交1 h,经TBST 漂洗后,用TMB显色[9].3次重复.
2 结果与分析
2.1 wsv477基因克隆
以WSSV病毒DNA为模板,用wsv477特异性引物进行PCR扩增,经电泳检测得到1条600 bp左右的目的带(图1),与预测的大小一致.将wsv477基因克隆到pMD-18T进行测序,比对结果与已知序列完全一致.重新将wsv477基因克隆到pGEX-4T-2表达载体上(重组质粒被命名为wsv477-pGEX-4T-2),转化E. coliBL21感受态细胞,挑取阳性转化菌培养后,提取质粒进行双酶切检验(图2).进一步测序结果表明,插入序列正确,且没有出现移码.该基因编码的开放阅读框(ORF)624 bp,预测编码 208个氨基酸,本试验原核表达的WSV477蛋白理论相对分子质量约为24 000.

图1 wsv477基因的PCR产物Fig. 1 PCR product of wsv477 gene

图2 重组质粒的双酶切鉴定Fig.2 Double digestion of the recombinant plasmid.
2.2 WSV477蛋白质表达和纯化
将测序正确的阳性克隆菌株经IPTG诱导表达后进行SDS-PAGE分析.pGEX-4T-2质粒本身有谷胱甘肽-S-转移酶(GST)的基因,编码蛋白质相对分子质量约为25 000,当插入外源基因片段后,可表达出外源基因和GST基因的融合蛋白.本试验中融合蛋白GST-WSV477的预计相对分子质量约为49 000.重组菌株经IPTG诱导后在相对分子质量49 000左右处出现一条明显的蛋白条带,而在表达载体 PGEX-4T-2及不诱导的重组质粒对照中都无此带(图3),说明wsv477基因克隆到表达载体后在大肠杆菌中获得了高效表达.超声裂解细菌,高速离心后将上清和沉淀进行SDS-PAGE电泳,分析重组蛋白的可溶性,在菌液上清中重组蛋白大量存在,而沉淀中极少(图4),说明GST-WSV477融合蛋白在菌体里为可溶性表达.
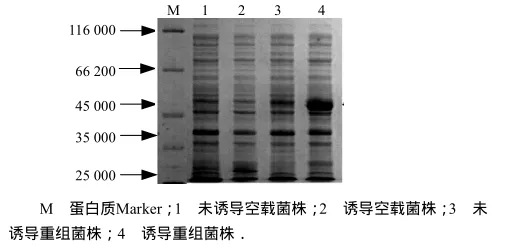
图3 GST-WSV477融合蛋白质表达分析Fig.3 Solublity analysis of expressed GST-WSV477 fusion protein

图4 GST-WSV477融合蛋白质的可溶性分析Fig.4 Solublity analysis of expressed GST-WSV477 fusion protein
大量摇配重组表达菌,将菌液裂解上清经Sepharose 4B亲和层析纯化,纯化的重组蛋白经SDS-PAGE (图5),获得了纯度较高的融合蛋白.
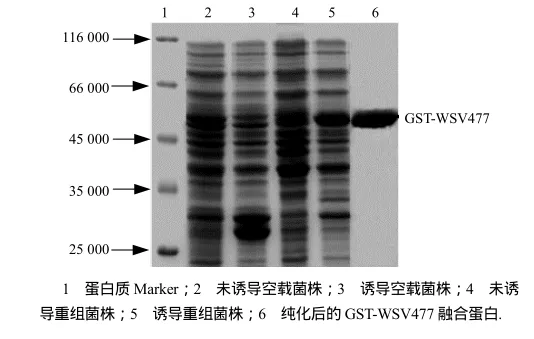
图5 wsv477在E.coli中的表达和纯化Fig.5 Expressed and purified proteins encoded by wsv477 gene in E. coli
2.3 wsv477基因转录时相的RT-PCR分析
图6结果表明,wsv477基因在病毒感染后4 h开始转录(图6-A).
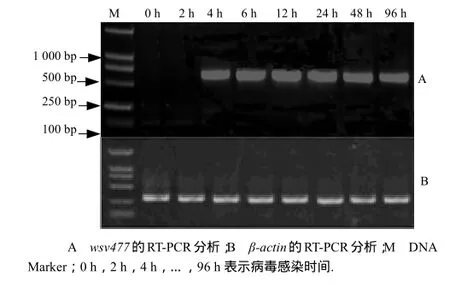
图6 wsv477基因转录时相分析Fig.6 Temporal transcription analysis of the wsv477 gene by RT-PCR in vivo
2.4 WSV477蛋白表达时相的Western blot 分析
采用 Protein A agarose亲和柱分离纯化WSV477蛋白的抗血清,得到 WSV477蛋白的抗体.采用间接ELISA法测定抗体效价,抗体滴度为1 10 000. 对各WSSV感染时间(0、2、4、6、12、24、48 h)的对虾鳃蛋白质进行Western blot分析,检测WSV477蛋白在对虾体内的表达时相. 结果显示,在病毒感染6 h后开始检测到WSV477蛋白(图7),说明wsv477基因编码的WSV477病毒蛋白在WSSV病毒感染6 h后开始表达.

3 结论与讨论
对虾白斑综合征病毒是世界对虾养殖中虾病的主要病原,至今未发现有效的防治方法,有待对病毒分子生物学进行深入研究[10],其中与病毒转录和复制相关的功能基因研究是非常重要的方面.
笔者采用PCR方法首次克隆了wsv477基因,其 ORF长度为 624 bp,预测编码 208个氨基酸.WSSV基因组分析表明,wsv477编码的蛋白质存在Cys2/Cys2型锌指结构域[3].在许多病毒中发现的锌指蛋白,可以作为蛋白质与核酸或蛋白质与蛋白质相互作用参与病毒的转录和复制等过程[11-12]的调控因子.WSV477锌指蛋白序列与锌指蛋白的典型序列并不完全一致,可能是类锌指蛋白,其生物学功能需要通过进一步的试验验证.
本研究中通过转录和表达时相分析,确定wsv477基因在病毒感染对虾4 h后开始转录,6 h
后开始表达,是个典型的病毒感染早期基因[13].目前在 WSSV中已经确认的早期基因主要有参与核苷酸代谢、DNA复制有关的酶类,包括胸腺嘧啶核苷酸合成酶[14]、胸腺嘧啶激酶[9]、核酸内切酶[15]、DNA聚合酶[16]等.病毒早期基因的转录表达与否决定晚期基因的转录,进而影响病毒的复制与增殖,在病毒感染中具有非常重要的地位.通过本研究可确认WSSV的wsv477基因为早期表达基因,为WSSV的早期诊断提供了理论依据.下一步工作需要采用蛋白质互作的方法,寻找对虾中与WSV477相互作用的蛋白质.通过构建WSV477蛋白的原核表达重组载体,诱导重组表达,获得重组蛋白GST-WSV477.
[1] Lightner D V,Redman R M,Morre D W. Development and application of a simple and rapid diagnostic method to studies on hepatopancreatic parvovirus of penaeid shrimp[J]. Aquaculture,1993,116:25-33.
[2] Flegel T W. Major viral diseases of the black tiger prawn (Penaeus monodon) in Thailand[J].World J Microb Biot,1997,13:433-442.
[3] Yang F,He J,Lin X H,et al. Complete genome sequence of the shrimp white spot bacilliform viru[J].J Virol,2001,75:11811-11820.
[4] Sandbrink H,Lankhorst R K. The white spot syndrome virus DNA genome sequence[J]. Virology,2001,286:7-22.
[5] 于洪涛,黄捷,张士璀. 对虾白斑综合征病毒(WSSV)致病相关基因研究进展[J].安徽农业科学,2008,36(18):7712-7715.
[6] 吴文林,戴聪杰,王磊. PCR法分析WSSV在日本对虾体内的感染增殖[J].泉州师范学院学报:自然科学版,2005,23(2):77-80.
[7] 萨姆布鲁克J,拉塞尔D W. 分子克隆实验指南[M].3版. 黄培堂,译.北京:科学出版社,2002:457-471.
[8] 汪家政,范明.蛋白质技术手册[K]. 北京:科学出版社,2000:55-57.
[9] Tzeng H F,Chang Z F,Peng S E,et al. Chimeric polypeptide of thymidine kinase and thymidylate kinase of shrimp white spot syndrome virus:Thymidine kinase activity of the recombinant protein expressed in a baculovirus/insect cell system[J]. Virology, 2004, 299:248-255.
[10] 孙志良,符少辉,陈立祥. 人α-干扰素对中国对虾皮下及造血组织坏死杆状病毒的作用[J].湖南农业大学学报:自然科学版,1999,25(2):124-126.
[11] Joazeiro C A P,Weissman A M.RING finger proteins:Mediators of ubiquitin ligase activity[J]. Cell,2000,102:549- 552.
[12] 朱艳冰,杨丰. 对虾白斑综合征病毒基因组同源重复区结合蛋白的筛选[J]. 台湾海峡,2006,25(3):318-323.
[13] Okano K,Mikhailov V S,Maeda S. Colocalization of baculovirus IE-1 and two DNA-binding proteins,DBP and LEF-3,to viral replication factories[J]. J Virol,1999,73:110-119.
[14] Li Q,Pan D,Zhang J H,et al. Identification of the thymidylate synthase within the genome of white spot syndrome virus[J]. J Gen Virol,2004,85:2035-2044.
[15] Li L,Lin S M,Yang F. Functional identification of the non-specific nuclease from white spot syndrome virus[J]. Virology,2005,337:399-406.
[16] Chen L L,Wang H C,Huang C J,et al. Transcriptional analysis of the DNA polymerase gene of shrimp white spot syndrome virus[J]. Virology,2002,301(1):136-147.
英文编辑:罗文翠
