鸡传染性法氏囊病病毒秦皇岛株的分离鉴定*
2010-03-06鲁改儒张艳英孟立根
鲁改儒,张艳英,孟立根
(1.河北农业大学中兽医学院,河北定州073000;2.河北师范科技学院,河北秦皇岛066000)
鸡传染性法氏囊病(Infectious bursal disease,IBD)于1957年首次在美国特拉华州南部的甘布罗(Gumboro)地区发现(又称甘布罗病)[1]。该病现己呈全球性流行,据调查美国鸡群的血清阳性率近100%,南美为90%,荷兰为88%,意大利为76%,日本约为75%,德国为61.50%[2]。目前IBD在我国已传遍各地,某些地方发病率高达80%以上,病死率在30%~70%或以上[3]。IBDV主要侵害4周龄~6周龄的雏鸡,破坏鸡的体液免疫器官——法氏囊,它主要破坏法氏囊中正在分化成熟的B淋巴细胞,引起鸡的急性发病甚至死亡,亚临床感染鸡和康复鸡可产生免疫抑制和生长抑制[4-5],增加了对新城疫、马立克病和传染性支气管炎等的敏感性[6]。1987年,一种以高发病率和高病死率为特征的IBDV超强度(vvIBDV)或高致病力IBDV(hvIBDV)毒株陆续在荷兰、英国、比利时、德国、日本等国家报道,辛桂香等报道我国也存在着这种vvIBDV[7]。多数学者认为vvIBDV是引起鸡IBD免疫失败的主要因素。近年来由于变异株和超强毒株的不断出现,免疫失败时有发生,给IBD的防控带来了极大的困难[8-10]。IBDV感染火鸡、鸭、雏鹅、鸵鸟、灰天鹅、雉鸡等的病例也相继有报道,因此本病己成为危害世界养禽业最严重的传染病之一。
近年来,IBD流行出现了一些新的特点:病死率比过去增高,过去一般在10%以下,现在一般为13%~50%,超强毒株病死率高者可达94%[11];IBD流行多在使用本病弱毒疫苗4 d~7 d后发病;IBD的流行不仅抑制或降低了雏鸡对多种疫苗(尤其是新城疫疫苗)的免疫应答,而且提高了鸡对某些微生物的易感性[12]。
本病主要是通过发病情况、临床症状、病理剖检进行临床诊断,对流免疫电泳和PCR技术等实验室方法可鉴定毒株的类型,以指导临床正确选择疫苗,进行科学的免疫预防和有效控制。
1 材料与方法
1.1 材料
1.1.1 病料来源 秦皇岛某养鸡场送检的4周龄蛋鸡8只。
1.1.2 试剂 1 000 IU/mL青链霉素,鸡传染性法氏囊病标准抗原(效价1∶64)(哈尔滨兽医研究所),标准阳性血清(效价1∶128)(哈尔滨兽医研究所),PBS缓冲液,巴比妥缓冲液(pH 8.6、离子强度0.05m ol/L),15 g/L琼脂糖、蛋白酶K(北京欣源佳和生物有限公司),100 g/L十二烷基硫酸钠(SDS),饱和酚(批号20081214),氯仿∶异戊醇(24∶1),TE缓冲液(pH 8.0),70%乙醇(天津市凯通化学试剂有限公司,批号20090215),无水乙醇(天津市凯通化学试剂有限公司,批号20081205),RT buffer(反应缓冲液),DTT(二硫苏糖醇,上海前尘生物科技有限公司),dNTP(三磷酸脱氧核糖核苷,上海前尘生物科技有限公司),ddH2O(去离子水),反转录酶M-M uLv(MBI公司),RNA sin(RNA酶抑制剂,华美生物工程公司),Taq DNA聚合酶(宝生物工程(大连)有限公司),琼脂糖(上海Yito企业有限公司)。
1.1.3 实验动物 SPF鸡购于梅里亚维通实验动物中心。易感鸡购自秦皇岛市徳宽种鸡孵化场。
1.2 方法
1.2.1 扩增VP2高变区的引物设计方案 P1:5′-TCACCGTCCTCAGCTTAC-3′,对应于ORFA-1第495位到512位核苷酸,长18 bp;P2:5′-TCAGGATTTGGGATCAGC-3′,互补于ORFA-1第1 120位到1 137位核苷酸,长18 bp;P3:5′-GCCCAGAGTCTACACCATAACTGC-3′,对应于ORFA-1第607位到630位核苷酸,长24 bp;P4:5′-GCGACCGTAACGACAGATCC-3′,互补于ORFA-1第1 081位到1 100位核苷酸,长20 bp;以P3、P4为引物,所得扩增产物应为494 bp。由张艳英老师提供。
1.2.2 病毒分离与筛选
1.2.2.1 病料处理 采集病变典型的法氏囊,以1∶3加入灭菌的PBS缓冲液,匀浆机制成乳剂,经反复冻融3次后以3 000 r/min离心10m in,取上清液备用。
1.2.2.2 病毒筛选分离 用10 g/L琼脂糖凝胶对流免疫电泳(CIE)试验,对1.2.1.1中制备的囊上清液进行筛选分离。将匀浆上清液依次判定结果。
将对流免疫电泳试验阳性的法氏囊上清液,加入1 000单位/mL青、链霉素作用2 h~4 h后,滴鼻、点眼接种4周龄SPF鸡0.2mL/只,接种后72 h取出感染鸡法氏囊,制备上清液(方法同1.2.2.1)。
1.2.3 病毒鉴定
1.2.3.1 套式RT-PCR扩增与氨基酸序列分析
病毒RNA提取。移取1.2.2.1中制备的囊匀浆上清0.5 mL,加入蛋白酶K至终浓度100μg/mL,100 g/L SDS至终浓度5 g/L,50℃消化1 h~2 h。等体积酚(水饱和),氯仿∶异戊醇(24∶1)各抽提1次,上层水相用2.5倍无水乙醇沉淀。沉淀用700mL/L乙醇洗2次,空气干燥后重悬于20μL pH 8.0TE缓冲液。
反转录(RT)。5×反应缓冲液4μL,DTT 2μL,P1 0.5μL(25 pmol),dNTP(10 mmol/L)1μL,病毒RNA 1μL,ddH2O 10μL。混匀,沸水中煮10 min,立即置冰浴冷却至室温,加入M-MuLV(200 U/μL,宝灵曼公司)0.5μL,RNasin(华美公司)1μL。混匀,瞬时离心,42℃保温1 h。95℃5min灭活反转录酶。
PCR扩增与鉴定。10×PCR缓冲液5μL,dNTP(10 mm ol/L)1μL,P1 1μL(50 pmol),P2 1μL(50 pm ol),RT产物5μL,ddH 2 O 36.5μL,Taq酶(5 U/μL)0.5μL(中国农业大学农业生物技术国家重点实验室提供)。混匀,进入PCR循环:94℃30 s;94℃30 s,55℃30 s,72℃30 s,30个循环;72℃延伸10 min。取10μL反应产物,10 g/L琼脂糖凝胶电泳检测。
套式PCR(nested-PCR)扩增与鉴定。以上述RT-PCR扩增的产物为模板,在内部引物P3、P4引导下,对目的产物进行进一步的扩增,反应条件如下:10×PCR缓冲液5μL,dNTP(10mmol/L each)1μL,P3 1μL(50pmo l),P4 1μL(50 pmol),上述PCR产物0.5μL,ddH2O 41.0μL,Taq酶0.5μL(5 U/μL)。混匀,进入PCR循环:94℃30 s;94℃30 s,60℃30 s,72℃30 s,30个循环;72℃延伸10 min。取10μL反应产物,10 g/L琼脂糖凝胶电泳检测。
氨基酸序列分析。将Nested-PCR扩增产物进行测序。根据测定的IBDV VP2高变区cDNA序列,采用GENEman和DNA Star计算机系统推导编码蛋白质的氨基酸序列,并进行分析比较。
1.2.3.2 回归试验 取上述法氏囊上清液,经滴鼻和口服途径感染21日龄~25日龄健康易感鸡8只,对照鸡4只,接种0.5mL/只,在感染后48 h~72 h剖检观察并记录。
2 结果
2.1 对流免疫电泳法
被检抗原(1.2.2.1中制备的囊上清液)8羽份,抗原孔与抗体孔均出现明显沉淀线。结果为阳性。
2.2 套式RT-PCR扩增与氨基酸序列分析
经套式PCR再次扩增后,取5μL反应产物电泳检测。在约490 bp大小处,被检毒株均可见一条与预期的产物大小相符的条带,而且阴性对照和空白对照均没有条带出现,符合预期结果(图1)。
根据高变区内氨基酸同源性,用平均距离法和聚类程序PXD,作出秦皇岛毒株与已发表的国际标准强毒株的亲缘关系树状图谱(图2)。从树状图上比较容易发现,HeB-qhd与超强毒株OKYM,UK 661,DV 86最相近同源性高达100%,具有强毒特征的毒株HeB-qhd与V 3、V 2亲缘关系较近(97.9%~99.3%)。对收集的毒株进行了VP2高变区序列分析,和有关文献报道的超强毒株进行了对照,发现H eB-qhd毒株具备了超强毒的3个典型的特征:①249位和254位的氨基酸分别为Q和G,而非K和S,从而保证其抗原性不发生变异;②七肽区保守SWSASGS不变,且279位和284位氨基酸分别为D和A,而非N和T;③222、294、299位具有3个特征性氨基酸,分别为A、I和S,这3个氨基酸使得超强毒株的亲和性发生变化,从而导致毒力大大增强。通过比较分析待检毒株为超强毒株。
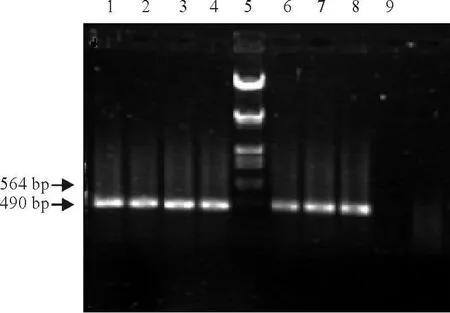
图1 VP2高变区的反转录PCR/套式PCR扩增产物Fig.1 VP2 hypervariab le region of RT-PCR/nest RT-PCR
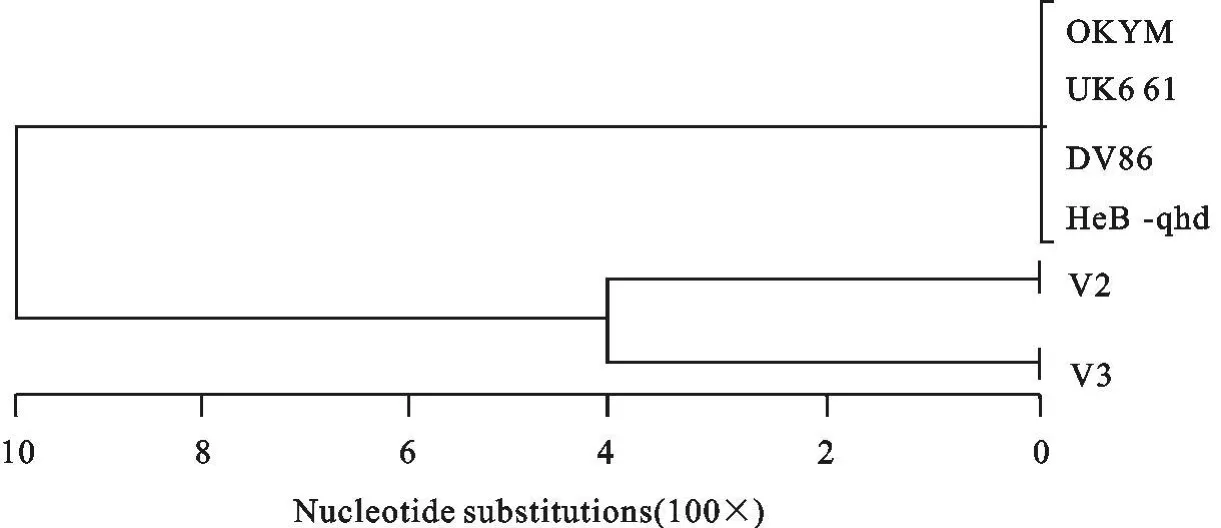
图2 秦皇岛IBDV毒株与已发表的国际标准强毒株的氨基酸序列树状图Fig.2 The am ino acid sequen ce tree of Qinhuangdao IBDV strains and the in ternational standard virulent strains
本试验所测秦皇岛毒株其主要的氨基酸变化同几个国际上标准强毒株的VP2高变区推测的氨基酸序列见表1。
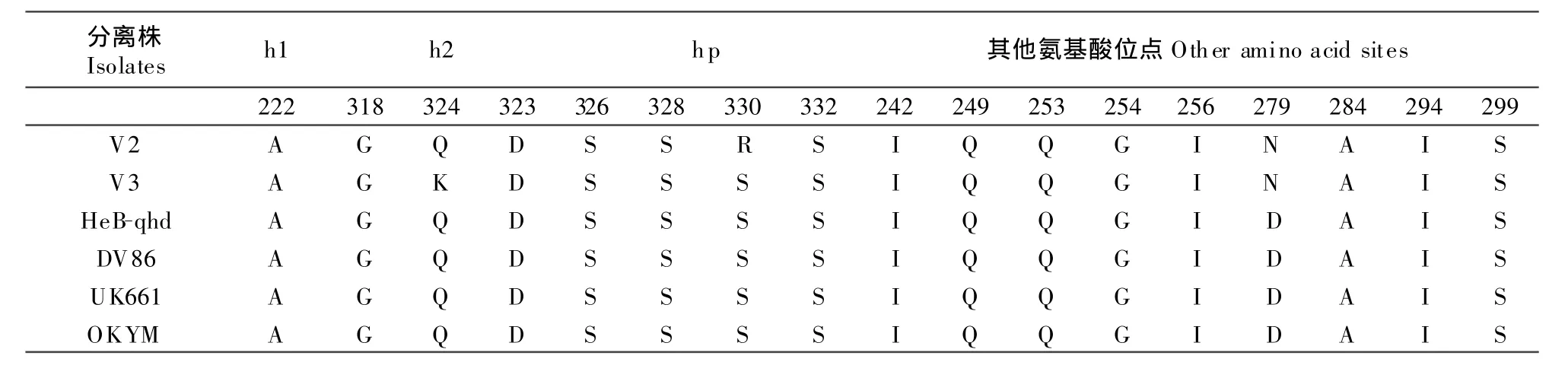
表1 秦皇岛IBDV分离株与参考毒株在VP2高变区的特征性氨基酸Table 2 The characteristic amino acids of Qinhuangdao IBDV isolate and reference strains in the VP2 hypervariable region
2.3 回归试验
人工接种21日龄~25日龄易感鸡36 h开始发病,8只试验易感鸡全部发病,4只对照鸡不发病,发病鸡排出灰白色稀粪,羽毛蓬松、战栗。剖检可见,法氏囊黏膜严重出血,呈“紫葡萄”样外观,剖开可见出血或有淡黄色的胶冻样渗出液。腿部、胸部肌肉有严重出血,腺胃与肌胃交界处出现严重的带状出血。
3 讨论
近年来,IBD的流行出现了新的特点,其临床症状及病变不典型,免疫失败现象较为常见,超强毒(vvIBDV)成为主要流行毒株。因此,对本病的早期确诊就显得尤为重要。目前用于检测IBDV的方法有琼脂扩散试验(AGP)、对流免疫电泳(CIE)、间接血凝试验、ELISA、中和试验和PCR技术等,但由于试验条件和试验成本等因素限制,只有免疫扩散法真正得到推广应用。琼脂扩散法虽然简便易行,但其敏感性和特异性都不高,而且必须在试验后24 h~48 h才能观察结果。
对流免疫电泳(CIE)是将双向免疫扩散与电泳相结合的一种技术。用CIE试验,抗原和抗体分别受电泳力和电渗力的作用呈定向相对泳动,既加速了反应的出现,也限制了抗原和抗体向四周自由扩散的倾向,因而提高了敏感性。用CIE方法只需30 min~60 min就出结果,而且特异性高,重复性好,检测效果明显好于琼扩法。
PCR技术作为RNA病毒的一种特异诊断方法,具有快速、特异、灵敏等特点。RNA酶在环境中无处不在,为防止操作过程中提取RNA不被环境中的RNA酶降解,试验在操作过程中严格无菌,操作人员戴一次性口罩、帽子、手套,实验过程中手套要勤换。本试验在常规PCR的基础上进行优化,扩增效果理想,采用外引物、内引物进行套式RT-PCR,灵敏性和特异性较好。所以可用该方法进行临床样品快速诊断鸡传染性法氏囊病,并对该病的流行病学调查有重大意义。
[1] Jackvood D J,Saif Y M,Hugbes JH.Characteristics and serologic studies of two serotypes of infeetious bursal disease virus intorkeys[J].Avian Dis,1982,20:871-882.
[2] 程安春.鸡病疗治大全[M].北京:中国农业出版社,2000:134-144.
[3] 甘孟候.中国禽病学[M].北京:中国农业出版社,1999:55-66.
[4] 刘高裕,刘秀梵,崔治中.传染性法氏囊病的研究进展[J].动物医学进展,2001,22(3):44-49.
[5] Reddy S K,Silim A.Com parison of neutralizing antigens of recent isolates of infectious bursal disease virus[J].Arch Virol,1991,117:287-296.
[6] Jackwood D J,Saif Y M,H ughes JH.Nucleic acid and structural proteins of infectious bursal disease virus isolates belonging to serotypeⅠandⅡ[J].Avian Dis,1984,28(4):990-1006.
[7] 刘文利,赵德明.应用复合中草药提取物对IBD中等毒力活疫苗免疫增强作用的研究[J].动物医学进展,2008,29(9):35-41.
[8] Hassan M K,Nielsen C K,Ward L A,et al.Antigenicity,pathogenicity,and immunogenicity of small and large plaque infectious bursl disease virus clones[J].Avian Dis,1996(40):832-836.
[9] 马增军,芮 萍,李佩国,等.鸡传染性法氏囊病病毒地方流行毒株的免疫原性[J].中国兽医学报,2007(2):164-167.
[10] 李建荣,周继勇.传染性法氏囊病病毒变异株弱毒的免疫原性研究[J].中国预防兽医学报,2000(5):32-34.
[11] 崔治中,孙淑红,单忠芳,等.鸡传染性法氏囊病病毒超强毒株GXS/99株的致病性[J].病毒学报,2002,18(2):162-166.
[12] Heppell J,Tar rab E,Berthiaume L,et al.Characterization of the small open reading frame on genome segment A of infectious pancreatic necrosis virus[J].J Gen V irol,1995;76:2091-2101.
[13] 孙运高.鸡传染性法氏囊病的预防与控制[J].山东畜牧兽医,2008(8):21.
[14] 杨保收,尤永君.我国今年来鸡传染性法氏囊病的发病特点、控制对策及治疗措施[J].动物科学与动物医学,2004,21(4):1-3.
[15] 张光明,蔺如涛.浅谈中草药在鸡病防治中的应用[J].山东兽药,2002,2(5):18-19.
