臂丛端侧吻合术后供体神经元和运动终板中CGRP的变化
2010-03-02
(江苏省昆山市第一人民医院,江苏昆山,215300)
降钙素基因相关肽(CGRP)作为神经递质广泛存在于中枢和周围神经系统内。研究表明CGRP与神经损伤后的再生可能有密切的关系[1]。端侧吻合修复臂丛神经损伤,轴突的再生、供体神经元重新与靶器官建立联系,其机制十分复杂,本实验通过测定运动终板中的CGRP及供体神经元胞体中CGRPmRNA的变化,从一个侧面观察臂丛端侧吻合后的神经再生过程,探讨端侧吻合修复臂丛神经损伤的可能机制。
1 材料与方法
1.1 动物及分组
雌性 Wister大鼠(由扬州大学动物中心提供)60只,体重为180~200 g,随机分3组(A 、B、C),每组20只,右侧为神经外膜开窗吻合组。左侧不作吻合,为对照组。
1.2 模型的建立[2]
1%硫喷妥钠(40 mg/kg)腹腔注射麻醉,脱毛剂脱毛,磺伏消毒,铺巾,取锁骨下斜向外至胸大肌止点作皮肤切口,长约4.1 cm,掀开皮肤,显露胸大肌,于止点内侧0.15 cm处切断胸大肌、胸小肌,手术显微镜下解剖分离臂丛神经后束并切断。而后于右侧内侧束远端0.15 cm处外侧外膜开窗0.12 cm×0.12 cm,将桡神经于后束分叉远端0.15 cm处切断,远断端移至内侧束外膜开窗处,用11/0无损伤缝合线行两神经外膜端侧吻合4~6针。每只大鼠左侧后束切断后,不作吻合,为对照组。大鼠常规单笼饲养,A、B、C 3组分别于术后4、8、12周麻醉,迅速在手术显微镜下,解剖取出C4~T2脊髓节段,并将脊髓节段于正中矢状面分开,及肱三头肌分别放入液氮中,-70℃冻存,备用。
1.3 肱三头肌CGRP的检测
取出肱三头肌标本,研钵中粉碎组织块,加入RIPA缓冲液(每克组织3m L RIPA),PMSF(每克组织30μL,10 m g/m L PMSF),进一步匀浆(15 000转/分×1分钟)维持4℃。加入PMSF(同上),冰上孵育30 min。移入离心管4℃,约15 000转离心15 min,收集上清-20℃保存。Bradford比色法测定蛋白质浓度。每个样品与等体积的2倍的上样buffer混匀,煮沸5min,12%SDS-PAGE电泳分离后,将蛋白质转移到PVDF膜上,5%脱脂奶粉封闭1 h后,加入一抗(兔抗人CGRP抗体),4℃过夜,加入HRP标记的二抗,孵育1 h,ECL显色,曝光。
1.4 western blotting法检测脊髓CGRP表达同上。
表1 大鼠两侧各时间组肱三头肌CGRP的表达(±s)
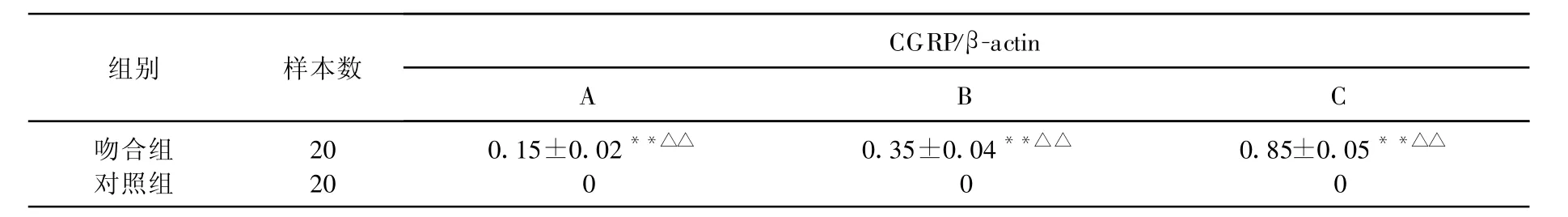
表1 大鼠两侧各时间组肱三头肌CGRP的表达(±s)
注:与其他时间组比较,**P<0.01,*P<0.05;与对照组比较,■■P<0.01,■P<0.05
CGRP/β-actin组别 样本数A B C吻合组 20 0.15±0.02**■■ 0.35±0.04**■■ 0.85±0.05**■■对照组 20 0 0 0
1.5 RT-PCR检测脊髓CGRPmRNA表达水平
取脊髓标本,加入Trizol试剂1m L,在冰浴中迅速匀浆30~60 s,至肉眼无可见组织块为止,依次分别加入氯仿、异丙醇,提取总RNA。紫外分光光度计测定RNA浓度。取2μg RNA随机引物逆转录成cDNA后行PCR反应。β-actin作为参照,引物的正向序列为5′-ATCTGGCACCACACCTTC-3′, 反向序列为 5′-AGCCAGGTCC AGACGCA-3′,扩增片段约 288 bp。CGRP正向引物序列为5′-TCCTGCA-ACACCGCCACCTG-3′, 反向序列为 5′-GGTGGGCACAAAGTTGTCC T-3′,扩增片段约111 bp。按照试剂盒说明完成操作,运用Bio-Red凝胶成像系统摄像。
1.6 统计学处理
实验数据用(s)表示,组间比较采用 t检验,组内比较采用单因素方差分析,运用SPSS 10.0软件进行数据分析。
2 结 果
2.1 大体观察
术后所有动物都存活,术后1个月内大鼠前足趾甲色泽稍暗淡,足部皮毛稀疏,个别动物出现前足溃疡和自噬。3个月后,大鼠右侧趾甲红润,足毛恢复正常,左侧无明显改善。右侧臂丛神经圆润、丰满、光泽度好,与之相连的肌群饱满、有弹性。而左侧臂丛神经菲薄、纤细,与之相连的肌群明显萎缩。
2.2 肱三头肌及脊髓CGRP蛋白的表达
Western blotting方法检测臂丛损伤后吻合组与对照组肱三头肌以及脊髓CGRP蛋白的表达量。结果表明,吻合组术后4周运动终板中CGRP的表达在较低水平,随着时间的增加,实验组CGRP的表达水平显著回升(P<0.01)。而对照组CGRP则不表达(表1,图1)。脊髓中CGRP的表达水平,实验组随时间变化显著回升(P<0.01),对照组则维持较低水平,无显著变化(表2,图2)。
表2 大鼠两侧各时间组脊髓CGRP的表达(±s)
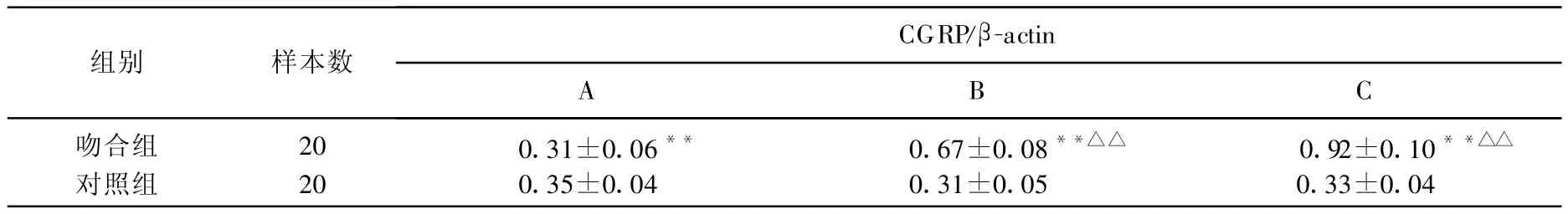
表2 大鼠两侧各时间组脊髓CGRP的表达(±s)
注:与其他时间组比较,**P<0.01;与对照组比较,■■P<0.01
CGRP/β-actin组别 样本数A B C吻合组 20 0.31±0.06** 0.67±0.08**■■ 0.92±0.10**■■对照组 20 0.35±0.04 0.31±0.05 0.33±0.04

图1 大鼠两侧各时间组肱三头肌CGRP的表达A:4周组;B:8周组;C:12周组
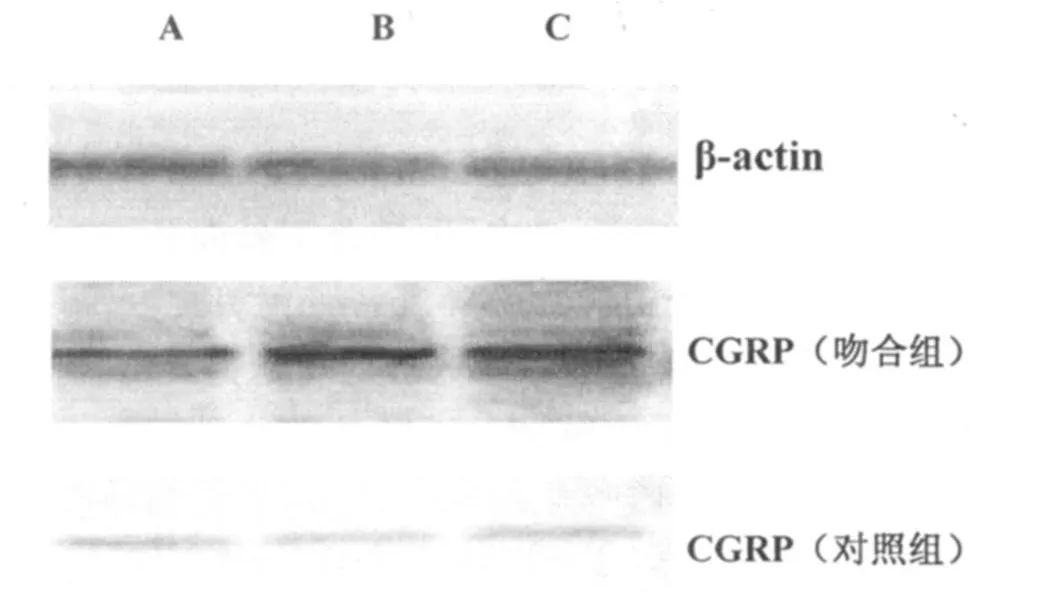
图2 大鼠两侧各时间组脊髓CGRP的表达A:4周组;B:8周组;C:12周组
2.3 脊髓CGRPm RNA的表达
上调(P<0.05),不同时间组之间比较差异性显著(P<0.01)。对照组CGRPmRNA低表达,且各时间组之间呈下降趋势,但差异性不显著。
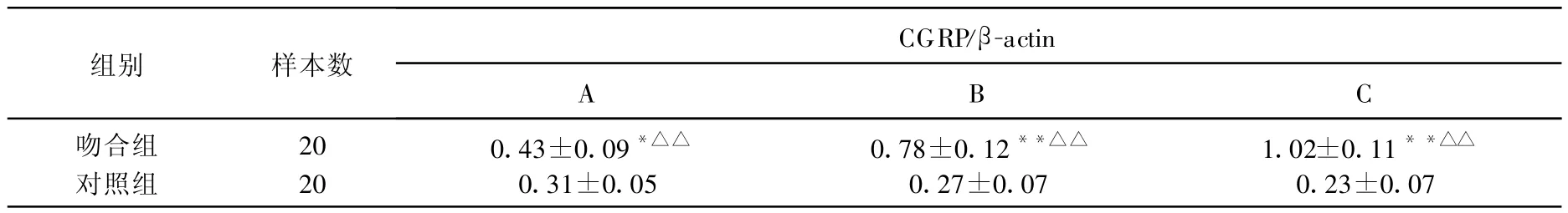
表3 大鼠两侧各时间组脊髓CGRP mRNA的表达( x±s)
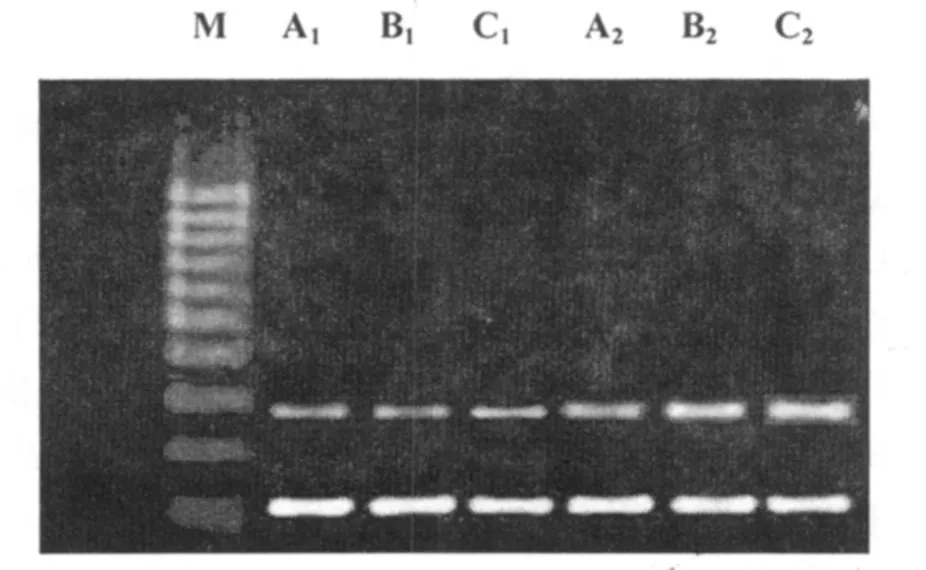
图3 大鼠两侧各时间组脊髓CGRP mRNA的表达M:marker;A1:对照组4周组;B1:对照组8周组;C1:对照组12周组;A 2:吻合组4周组;B2:吻合组8周组;C2:吻合组12周组
3 讨 论
CGRP是一种神经肽类物质,在脊髓神经元及运动终板中均有分布,神经损伤后可引起中枢及外周部位CGRP的表达变化。Wang S等研究提示:CGRP可能通过上调Bcl-2的表达对神经元起保护作用[3]。在大鼠坐骨神经压榨损伤研究中发现:神经损伤 1 d后,在损伤部位近端CGRP阳性产物大量堆积,21 d再生轴突通过压榨部位后CGRP的堆积基本消失[4],Seybold等推测可能是压榨损伤后的轴突轴浆流立即中断引起了早期CGRP在神经内的大量堆积,并且通过某一机制将损伤信息传递给背根节和脊髓,引起CGRP出现次序高峰表达以激活其信号通路中的下游p-CREB和c-fos[5-6],促进神经元再生、存活。
CGRP与运动终板亦有着密切的关系,研究发现:CGRP与乙酰胆碱(AchE)共存于运动终板,可以刺激乙酰胆碱受体的合成和积聚[7-8]。周围神经损伤后CGRP在运动终板中的脱失提示CGRP与运动终板的退变相关,张庆民等[9]实验证明,脊髓横断1周后CGRP在运动终板中的数量、分布即明显减少,着色变浅,而AChE在运动终板中的变化发生在损伤后4周时,即CGRP出现变化的时间早于AchE,但两者均始终未完全消失,且整个变化趋势是一致的,推测CGRP的缺乏很可能是运动终板退变的一个重要因素。王树森等[10]研究发现:坐骨神经损伤 1周后CGRP即在脊髓前角运动神经元中升至最高,并持续4周,8周后恢复正常,而在神经末梢和运动终板中即完全消失,提示CGRP在神经再生和运动终板再次形成过程中很可能是一种“终板分化信号”,它诱导肌肉细胞上的乙酰胆碱受体的合成,同时阻止轴突在肌肉内的继续生长。
本实验通过建立端侧吻合技术修复臂丛神经损伤的大鼠实验模型,研究了端侧吻合后脊髓供体神经元,以及运动终板中CGRP的变化情况。结果显示神经端侧吻合后随时间的延长,脊髓及运动终板中CGRP的表达均显著升高,而不做吻合的对照组中,脊髓CGRP表达维持较低水平,且呈下降趋势,但差异性不显著,运动终板中无CGRP的表达。本课题组前期实验发现臂丛损伤端侧吻合后对失神经肌肉及运动终板具有保护作用,能有效防止失神经肌萎缩。结合本实验研究,提示CGRP在端侧吻合修复臂丛神经损伤,轴突的再生、供体神经元重新与靶器官建立联系的过程中起着重要作用。
综上所述,端侧吻合作为处理臂丛神经损伤的一种可行性方法。其作用机制可能与提高供体神经元CGRP的表达,进而恢复运动终板的功能有关。
[1] 马宏敏,王锦玲,邱建华,等.豚鼠面神经损伤后面神经核中降钙素基因相关肽的变化[J].临床耳鼻咽喉科杂志,1999,(08):123.
[2] 李文军,裴连魁,梁炳生.端侧吻合修复臂丛损伤实验模型的建立[J].实用手外科杂志,2001,15(2):92.
[3] Wang S,Yang D,Lippman M E.Targeting Bcl-2 and Bcl-xl with nonpeptide small molecule antagonists[J].Sem in Oncol,2003,30(5 suppl16):133.
[4] 许愿忠,张建伟,王 瑞,等.大鼠坐骨神经压榨损伤后早期降钙素基因相关肽的变化[J].解剖学杂志,2005,28(2):178.
[5] Seybold V S,M cCarson K E,Mermelstein PG,et al.Calcitonin gene-related peptide regulatesexpression of neurokinin1 receptorsby rat spinal neurons.JNeurosci,2003,23(5):1816.
[6] Anderson L E,Seybold V S.Calcitonin gene-related peptide regulates gene transcription in primary afferent neurons[J].J Neu rochem,2004,91(6):1417.
[7] FernandezH L,Chen M,Nadelhaft I,et al.Calcitonin gene-related peptide:their binding sites and receptor accessory proteins in adult mammalian skeletal muscles[J].Neuroscience,2003,119(2):335.
[8] Fernandez H L,Ross G S,Nadelhaft I.Neurogenic calcitonin gene-related peptide:a neurotrophic factor in themaintenance of acetylcholinesterasemolecular forms in adult skeletalmusc les[J].Brain Res,1999,844(1-2):83.
[9] 张庆民,关 骅,洪 毅.大鼠完全性脊髓损伤后降钙素基因相关肽与运动终板的关系[J].中国康复理论与实践,2005,11(2):89.
[10] 王树森,胡蕴玉,白建萍,等.大鼠坐骨神经损伤后降钙素基因相关肽在脊髓神经元及运动终板中的变化[J].中国临床康复,2004,8(20):48.
