微胶囊固定化混合菌群发酵产氢
——构建一种虚拟“细胞工厂”的尝试
2010-10-11马茜岚林东强姚善泾
马茜岚,林东强,姚善泾
浙江大学化学工程与生物工程学系,杭州 310027
细胞工厂的优化
微胶囊固定化混合菌群发酵产氢
——构建一种虚拟“细胞工厂”的尝试
马茜岚,林东强,姚善泾
浙江大学化学工程与生物工程学系,杭州 310027
采用硫酸纤维素钠 (NaCS)/聚二甲基二烯丙基氯化铵 (PDMDAAC) 微胶囊体系,固定混合产氢菌群,构建成一个能高效产氢的虚拟“细胞工厂”。经过菌群活化预处理,激活了产氢活力,进一步通过NaCS/PDMDAAC微胶囊固定化,形成适宜的内部微环境,有效增强了菌群对温度的适应能力,提高了底物浓度,氢气产量比游离细胞增长30%以上,菌体浓度提高2倍到3.2 g/L。连续15批培养,囊内菌体浓度显著提高,发酵时间缩短,氢气产率保持在1.73~1.81 mol H2/mol glucose,平均产氢速率提高了198.6%。同时还发现发酵产物中有较高比例的丁酸和乙酸,由此可以使该虚拟“细胞工厂”成为一个多产物联产体系。
生物制氢,NaCS/PDMDAAC微胶囊,固定化细胞,虚拟“细胞工厂”
Abstract:Sodium cellulose sulfate (NaCS)/Ploy-dimethyl-dially-ammonium-chloride (PDMDAAC) microcapsules were used as a novel pseudo “Cell Factory” to immobilize mixed bacteria for hydrogen production under anaerobic conditions. Compared to free cells, the hydrogen production was increased more than 30% with NaCS/PDMDAAC microcapsules as the pseudo “Cell Factory”.The biomass was increased from 1.5 g/L in free cell culture to 3.2 g/L in the pseudo “Cell Factory”. This pseudo “Cell Factory”system showed the excellent stability during 15 repeated-batches. The hydrogen yield maintained 1.73−1.81 mol H2/mol glucose. The fermentation cycle was shortened from 48 h to 24 h, resulting in an increase of 198.6% in the hydrogen production rate. There were high percentage of butyric acid and acetic acid in the culture broth, which meant that the pseudo “Cell Factory” established in the present work could be used for the multi-product system.
Keywords:hydrogen, NaCS/PDMDAAC microcapsule, immobilized cells, pseudo “Cell Factory”
氢能作为一种清洁能源受到人们的普遍关注[1-4],生物制氢则是生物炼制的一个重要内容,目前主要有光发酵[5-6]和暗发酵[7-8]。暗发酵表现出显著的优越性[9]:菌种产氢能力强、生长速度快;发酵过程无需光源,不受光照条件制约;可利用不同底物,原料来源广、价格低廉,并可以协同治理环境污染[10-11]。从工业化角度来看,混合菌群发酵比纯菌种发酵培养条件简单,操作方便,且可以利用不同菌群的协同效应扩大底物范围、提高产氢效率[12],但混合菌群发酵的复杂程度显著增加,研究还远远不够。
目前暗发酵研究主要基于游离细胞,但游离细胞的连续培养常由于高稀释率而导致细胞溢出,采用固定化培养是较好的方法,可保持高菌体浓度,降低操作成本。固定化体系本身易于产生厌氧环境,非常适用于对氧气敏感的暗发酵产氢细菌。在众多固定化体系中,微胶囊固定化倍受关注,一层微囊外膜包裹着合适的液体环境,内部各种细胞协调生长和代谢,实现各种生化反应,外膜承担着隔离、保护和物质传递的功能。因此,微胶囊体系就像一个虚拟的“细胞工厂”,从外界吸收营养成分,通过内部复杂的代谢反应,合成特殊产物,最后排放到膜外。硫酸纤维素钠 (Sodium cellulose sulfate,NaCS)/聚二甲基二烯丙基氯化铵 (Ploy-dimethyldially-ammonium-chloride,PDMDAAC) 微胶囊体系具有生物相容性好、制备方法简单、物理化学性质稳定、机械强度好等优点[13-15],前期曾采用该体系进行了多种细胞固定化培养研究[16-21],产物包括乙醇、乳酸、谷氨酸、1,3-丙二醇、苏云金杆菌、溶栓酶等,发现该体系尤其适用于厌氧培养。以上工作均为单菌体系,应用于混菌固定化,构建虚拟“细胞工厂”将是新的突破。
因此,本文将尝试采用NaCS/PDMDAAC微胶囊体系来固定化混合产氢菌群,构建虚拟的“细胞工厂”,利用不同菌群的协同作用,提高产氢性能。作为探索研究,将主要考察菌群改造方法、摇瓶条件下混合菌群的产氢特性,探讨微胶囊固定化混菌“细胞工厂”以及连续产氢的可行性。
1 材料与方法
1.1 材料
混合产氢菌群富集自厌氧活性污泥,厌氧活性污泥取自杭州市四堡污水处理厂的初级厌氧消化池。NaCS的制备参照文献[22]。PDMDAAC,Mw=200 000~300 000。
发酵培养基 (g/L):胰蛋白胨4;牛肉膏2;酵母汁 1;NaCl 2;MgCl20.1;FeSO4·7H2O 0.1;L-半胱氨酸0.5;K2HPO41.5;葡萄糖为碳源,除了考察葡萄糖浓度对产氢影响的部分实验,其余实验的培养基中葡萄糖浓度均为20。添加维生素液 10 mL/L,微量元素液 10 mL/L。调节pH值为7,121℃灭菌20 min。
维生素液 (g/L):谷氨酸0.01;抗坏血酸0.025;核黄素0.025;柠檬酸0.02;叶酸0.01;对氨基苯甲酸0.01;肌酸0.025;吡多醛盐酸盐0.05。
微 量 元 素 液 (g/L): MnSO4·7H2O 0.01 ;ZnSO4·7H2O 0.05;H3BO30.01;CaCl2·2H2O 0.01;NaMnO40.01;CoCl2·6H2O 0.2;KAl(SO4)20.01。
1.2 产氢菌群的活化预处理
首先对厌氧活性污泥进行了高温预处理,蒸汽灭菌锅内121℃高温加热8 min,自然冷却至室温。取高温处理的污泥10 mL于300 mL可密封摇瓶中,添加100 mL培养基,37℃、100 r/min厌氧培养。48 h后,取10 mL发酵液作为种子液,其余条件同上,进行第2批次培养。以此类推,连续5批进行预培养,富集产氢菌群。
1.3 微胶囊固定化
发酵菌群的微胶囊化在无菌环境下进行,具体操作如下:取预培养后的菌液 20 mL,菌体浓度约0.5 g/L,用无菌水稀释至100 mL,添加NaCS配置成 4% (W/V) 的 NaCS溶液;PDMDAAC配制成8% (W/V) 溶液;用注射器针头将配好的含菌NaCS溶液逐滴滴至搅拌中的PDMDAAC溶液,继续温和搅拌;反应约30 min,收集制备好的微胶囊,用无菌水充分洗去微胶囊表面残余的PDMDAAC,即得到包埋了发酵产氢菌的NaCS/PDMDAAC微胶囊,平均直径为2.8 mm。
1.4 培养方法
单批次发酵:300 mL可密封摇瓶中添加100 mL培养基,接种50 mL包埋了发酵产氢菌的微胶囊或10 mL含有等量产氢菌的种子液,通氮气3 min排尽空气后,接氢气收集器,封闭体系,以排水法收集发酵气体。一般情况下,40℃、120 r/min厌氧培养48 h。考察温度对固定化和游离细胞产氢能力影响时,摇瓶发酵分别在25℃、30℃、35℃、37℃、40℃、45℃六个温度下进行。实验过程中,气体体积、组成和液相产物成分根据实验需求定期测定。
多批次发酵:第1批发酵结束后,将摇瓶中的发酵液倒出,保留NaCS/PDMDAAC微胶囊,并添加100 mL新鲜培养基,进行下一批发酵,其余操作同单批次发酵,连续发酵15批。
1.5 分析方法
氢气含量:发酵产生气体收集于氢气收集器中,读取气体体积后矫正为25℃和1 atm时气体体积。从取样口取气相样品检测氢气浓度,使用福立9790气相色谱仪检测,柱长 4 m,填料为 5A分子筛+GDX-50,热导池检测器,高纯氮气作载气,流速为40 mL/min,柱温40℃,热导池和进样器温度为80℃,进样量 1 000 μL。
可溶性发酵产物:使用安捷伦6820气相色谱仪检测,色谱柱型号HP-Innowax 19091N-213 30 m×0.32 mm,氢火焰检测器,高纯氮气作载气,柱流量3 mL/min,分流比 50,进样口和检测器温度均为250℃,进样量 0.4 μL。柱升温程序:50℃保持 3 min,15℃/min升温至200℃,200℃保持2 min。
葡萄糖含量:用DNS法测定。
菌体浓度:取20个微胶囊,破碎,沉降去除并洗涤微胶囊碎片,将释放的内容物适量稀释,用紫外分光光度计在600 nm处测定发酵液的吸光值,用单位体积发酵液干重和吸光度值的对应关系,计算得到菌体浓度。
pH值:Thermo Orion pH计测定发酵液的pH值。
2 结果与分析
2.1 产氢菌群的富集和活化
在我们前期工作中[23],已经采用热处理、酸处理和碱处理等方法,对初始的活性污泥进行了产氢菌群的富集。经平板培养和镜检,不同处理方法得到的菌群很相似。随机选取10个菌落进行16S rRNA序列分析,发现序列完全相同。通过NCBI的blastN序列比对进行同源性分析,发现与肠杆菌属Enterobacter的序列同源性为 99%以上。文献报道的许多产氢微生物是梭菌属Clostridia,这可能与本文活性污泥来源和预处理方法有关。由此说明,本文富集的菌群是以肠杆菌属为主的新产氢菌群,在我们的前期工作中已有详细的说明[23]。
经检测,厌氧活性污泥经高温处理后发酵气体中只含有氢气和二氧化碳,没有检测到甲烷,说明高温处理比较有效,已去除了污泥中的产甲烷菌[23]。
2.2 固定化细胞和游离细胞产氢能力的比较
图1和图2比较了游离细胞和微胶囊固定细胞的氢气产量和菌体浓度随时间的变化曲线。前期研究表明,营养成分可以有效进入微胶囊内,氢气可以排出囊外。微胶囊的机械强度良好,培养过程未发现菌体泄漏。由图 1可知,游离细胞和固定化细胞都在培养8 h左右开始产生氢气,前32 h氢气产量的变化曲线非常相似,然而游离细胞在 32 h后产氢变缓,固定化细胞则持续产氢直至发酵结束,微胶囊固定化后氢气产量比游离细胞增长了30.3%。将产氢速率定义为氢气产量变化曲线的斜率,则固定化细胞和游离细胞的最大产氢速率分别11.32 mL/h和10.86 mL/h,固定化细胞略高于游离细胞。结果表明,微胶囊构成的虚拟“细胞工厂”内,具有合适的微环境,各种产氢菌群的协调生长,提高了产氢活力,延长了产氢时间。从图2的菌体浓度变化曲线可以看出,微囊化固定后的菌体浓度高达3.2 g/L,远远高于游离培养时的1.5 g/L。
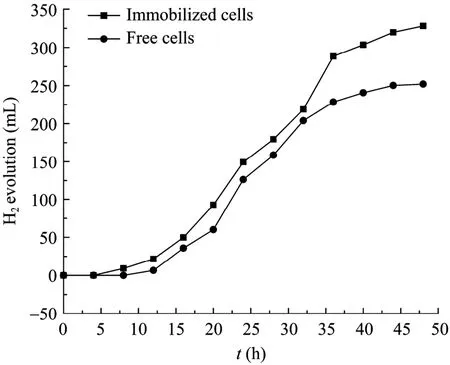
图1 固定化和游离细胞氢气产量的变化曲线Fig.1 Time course of hydrogen evolution by immobilized and free cells.
2.3 培养温度的优化
图3是不同培养温度条件下固定化细胞和游离细胞的氢气产率。在 25℃~37℃范围内,随着温度升高,固定化细胞和游离细胞的氢气产率都逐步提高。从 37℃~45℃,游离细胞的氢气产率随着温度的进一步提高而迅速下降,而固定化细胞的氢气产率在40℃时达到最大值1.45 mol H2/mol glucose。不同培养温度下,固定化细胞的氢气产率均高于游离细胞,尤其在40℃和45℃,固定化细胞的氢气产率比游离细胞分别提高了29.5%和103.6%。

图2 固定化和游离细胞菌体浓度的变化曲线Fig.2 Time course of biomass by immobilized and free cells.
表1列出了不同温度下固定化和游离细胞产氢能力的比较。由表中数据可知,在发酵过程中,氢气含量始终在 40%~50%之间。氢气产量和氢气产率的变化规律一致,随着温度升高而逐渐增长,游离细胞在37℃时达到最大值,而固定化细胞在40℃时达到最大值,可见固定化后菌群的耐受温度有所提高。因此,微胶囊构成的虚拟“细胞工厂”可适应于较高的培养温度,增强了胞内各种酶的活力,氢气产量、氢气产率和葡萄糖转化率都得到了显著提高。
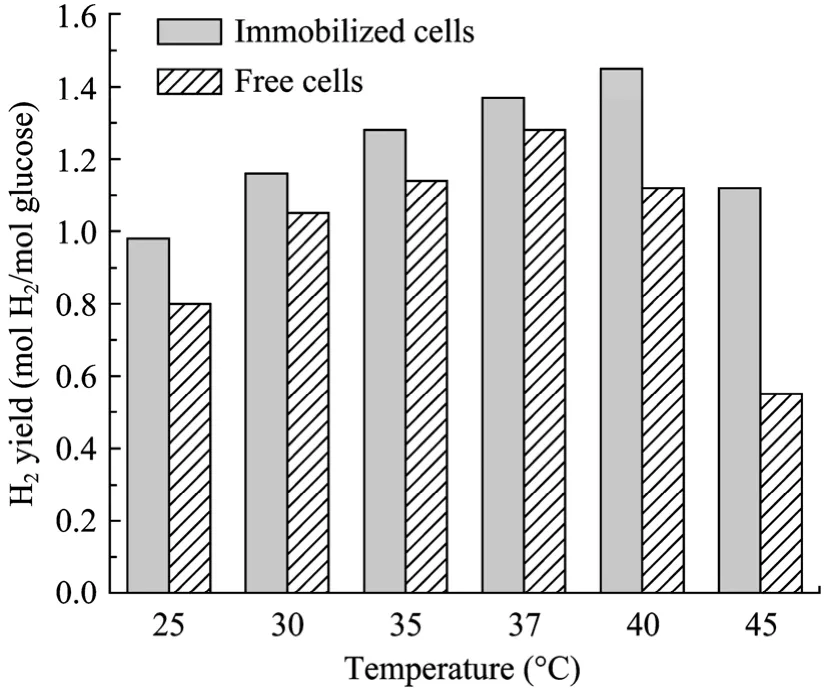
图3 温度对固定化和游离细胞氢气产率的影响Fig.3 Hydrogen yield of immobilized and free cells under different temperatures.
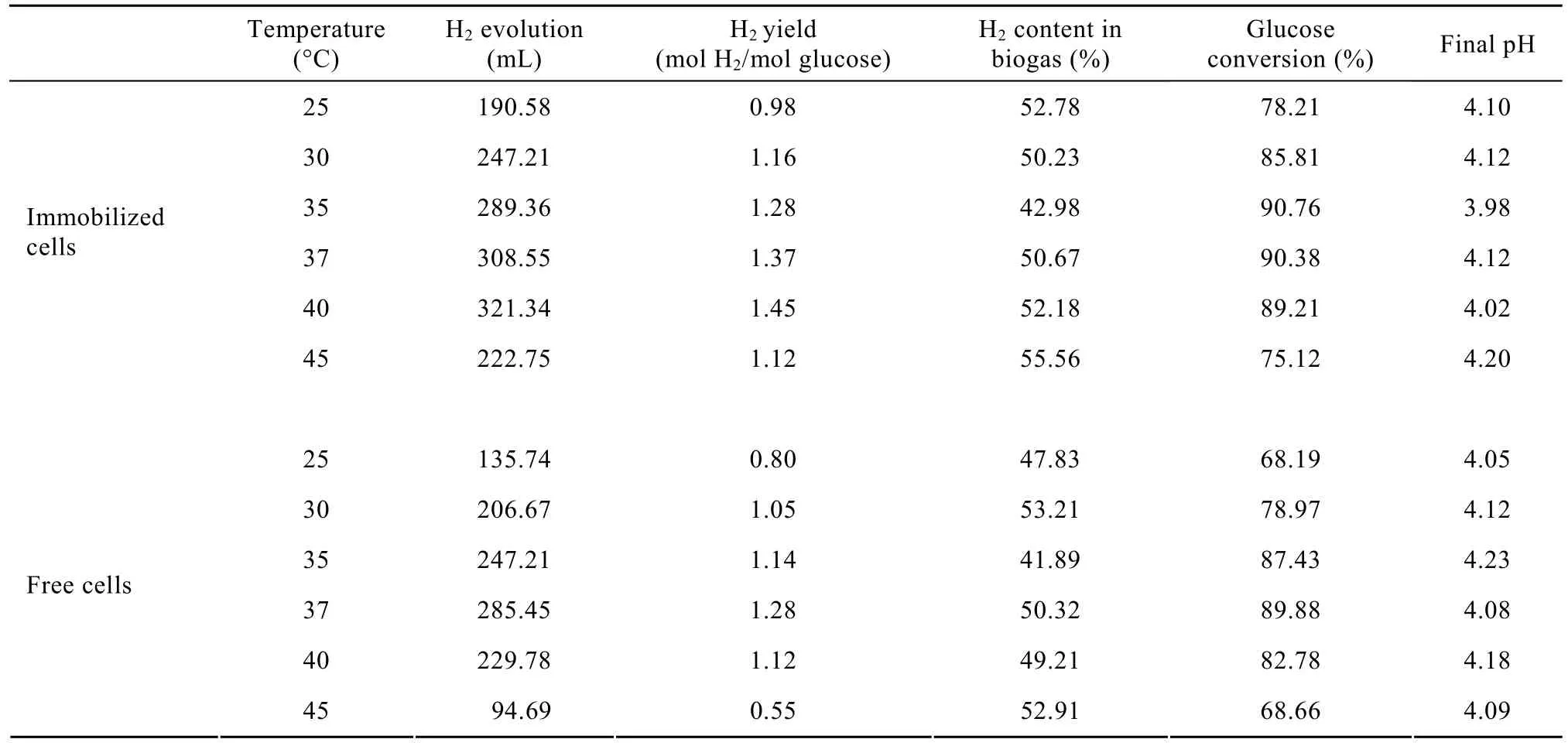
表1 不同温度下对固定化和游离细胞产氢能力的比较Table 1 Hydrogen production performance of immobilized and free cells under different temperatures
2.4 葡萄糖浓度的影响
表2是在不同葡萄糖浓度培养基中,固定化和游离细胞产氢能力的比较。当葡萄糖浓度低于20 g/L时,随着葡萄糖浓度的提高,固定化和游离细胞氢气产量逐步上升,当葡萄糖浓度高于20 g/L时,固定化细胞的氢气产量虽有上升,但增幅变小,而游离细胞的氢气产量有所下降。在相同葡萄糖浓度下,固定化细胞的氢气产量均高于游离细胞。在5~20 g/L的葡萄糖浓度范围内,固定化和游离细胞的底物转化率分别在90%和85%附近,而更高的葡萄糖浓度则导致底物转化率的快速下降。随着葡萄糖浓度的提高,发酵pH值逐步下降,说明混合菌群在产氢的同时产生酸性副产物,抑制了氢气的产生。固定化细胞在葡萄糖浓度低于20 g/L时,氢气产率维持在1.40~1.50 mol H2/mol glucose之间,即使在葡萄糖浓度达到30 g/L时,氢气产率仍可达到1.27 mol H2/mol glucose,高于同等条件下游离细胞的 36.6%。这是由于微胶囊内葡萄糖的消耗速率大于扩散速率,囊内葡萄糖浓度一直保持在较低浓度,可以有效避免发酵过程中的底物抑制,这和陈国等[24]的研究结果一致。由此可见,20 g/L葡萄糖浓度是产氢细菌的较适底物浓度,微胶囊包裹的虚拟“细胞工厂”可以缓解底物抑制,提高氢气产率,在较高葡萄糖浓度条件下保持混合菌群的产氢活性。
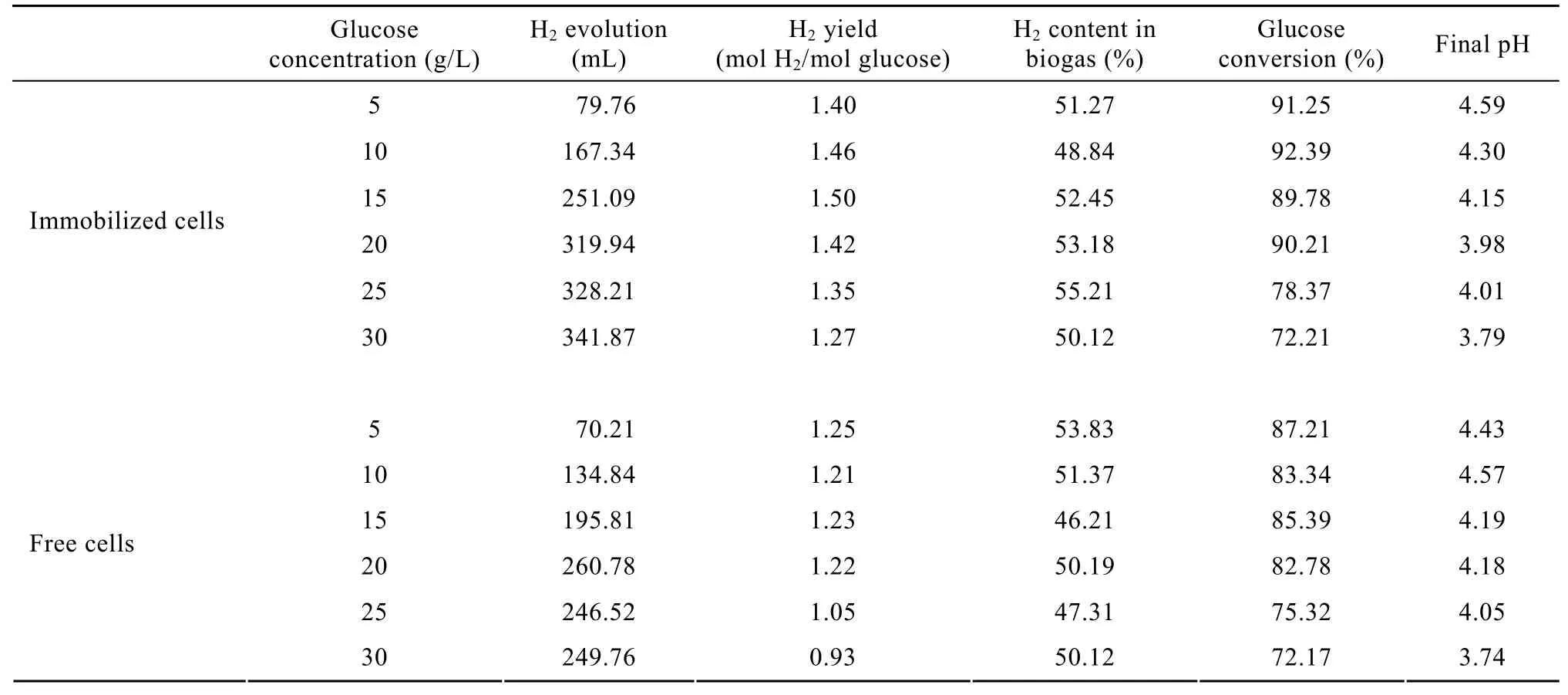
表2 葡萄糖浓度对固定化和游离细胞产氢能力的影响比较Table 2 Hydrogen production performance of immobilized and free cells under different glucose concentrations
2.5 多批次发酵
考察了NaCS/PDMDAAC微胶囊虚拟“细胞工厂”的产氢稳定性和可持续性,进行了多批次摇瓶发酵实验,结果见图 4。由图可知,氢气产量和氢气产率在前5批发酵过程中均逐步上升,在第5批之后分别稳定于 400~420 mL和 1.73~1.81 mol H2/mol glucose。对于前5批发酵,微胶囊中的菌体浓度从约0.5 mg/L上升到约5 g/L,之后稳定在5 g/L左右。由于菌体浓度大幅提高,发酵时间由最初的48 h缩短至24 h,因此平均产氢速率从5.89 mL/h提高至17.59 mL/h,提高了198.6% (图5)。可见,采用微胶囊固定化混合菌群,大大提高了菌体浓度,缩短了发酵时间,提高了单位时间的氢气产量,显示出虚拟“细胞工厂”的优势。
2.6 液相可溶性发酵产物分析
考察微胶囊固定化混菌产氢的同时,还测定了发酵液中的其他产物。表 3列出了固定化多批次摇瓶发酵中主要可溶性发酵产物的种类和含量。在前5批发酵中,可溶性发酵产物产量逐步增加,到第5批后,总产量稳定在4.76~5.45 g/L,主要可溶性产物为丁酸和乙酸,分别占可溶性产物的 37%~45%和 32%~42%。乙醇含量较低,占可溶性产物的14%~27%,产物中没有检测到一般产氢发酵中都存在的丙酸。
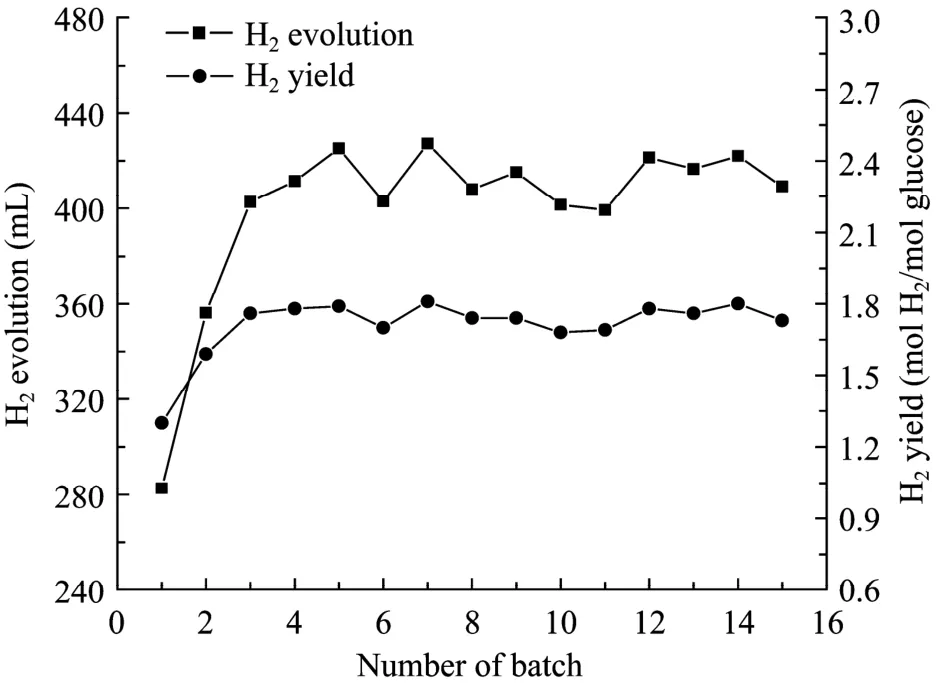
图4 固定化产氢细菌多批次摇瓶发酵的氢气产量和产率Fig.4 Hydrogen evolution and hydrogen yield with immobilized cells during repeated batch operation.
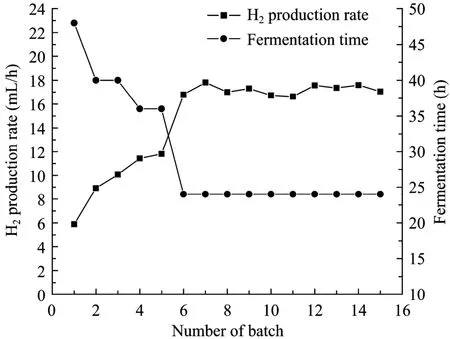
图 5 固定化产氢细菌多批次摇瓶发酵的平均产氢速率和每批发酵时间Fig.5 Average hydrogen production rate and fermentation time with immobilized cells during repeated batch operations.
氢气产生过程中可溶性产物的组成可用于表征菌群的产氢能力,产丁酸和乙酸的过程通常被认为有利于氢气的产生。Yan等[25]研究表明,产乙醇将消耗代谢过程中的自由电子,不利于产氢;产丙酸则直接消耗氢气。对于本文构筑的虚拟“细胞工厂”体系,丁酸和乙酸含量高达 73%~86%,发酵过程有利于氢气的产生。
微胶囊固定化细胞进行发酵,菌群存在于微胶囊内,过滤出微胶囊后,得到澄清的发酵液,便于后期处理,可将各种有价值的副产物进行分离和收集,实现多产物联产,提高经济效益。
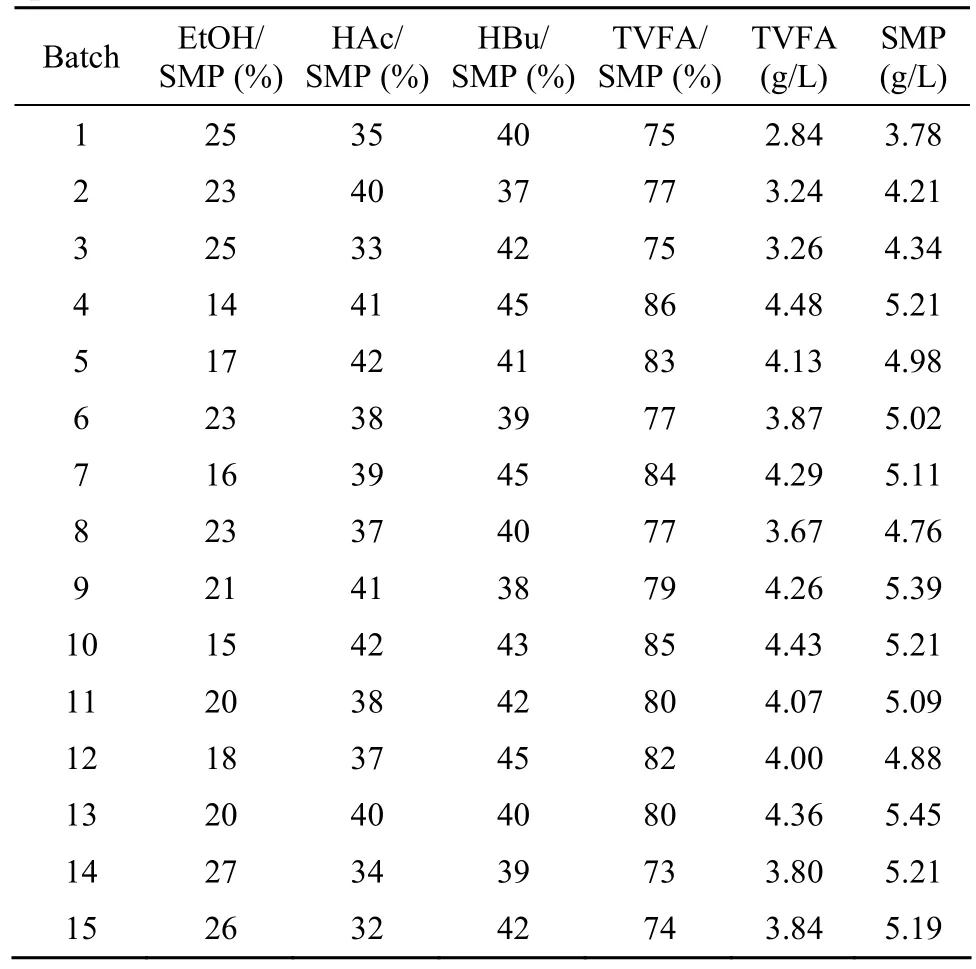
表 3 固定化产氢细菌多批次摇瓶发酵中的可溶性发酵产物Table 3 Soluble metabolite production during hydrogen production with immobilized cells in repeated batch operations
3 结论
本文采用NaCS/PDMDAAC微胶囊体系,固定化混合产氢菌群,构建了虚拟的“细胞工厂”,实现菌群协同作用,提高了氢气产率。结果表明,微胶囊固定化能够很好地保持菌群的产氢能力,同时表现出一定的促进作用。培养温度和底物浓度都对产氢能力有较大影响,微囊固定化后菌群的耐受能力有所提高,表现出高产氢活性,最适发酵温度为40℃,最佳葡萄糖浓度为20 g/L。实现了连续15批培养,微胶囊表现出良好的机械强度和稳定性,实现了细胞的再利用,提高了囊内菌体浓度,缩短了发酵时间,大大提高了产氢速率。同时发现发酵液中存在一定量的丁酸和乙酸,可作为副产物回收。结果证实NaCS/PDMDAAC微胶囊固定化混合产氢菌群可实现高效产氢,具有较好的工业应用潜力,相关深入的机制探讨有待于进一步开展。
REFERENCES
[1] Winter CJ. Hydrogen energy—Abundant, efficient, clean:a debate over the energy-system-of-change.Int J Hydrogen Energ, 2009, 34(14): S1−S52.
[2] Das D. Advances in biohydrogen production processes: an approach towards commercialization.Int J Hydrogen Energ, 2009, 34(17): 7349−7357.
[3] Barbir F. Transition to renewable energy systems with hydrogen as an energy carrier.Energy, 2009, 34(3):308−312.
[4] Halloran JW. Extraction of hydrogen from fossil fuels with production of solid carbon materials.Int J Hydrogen Energ, 2008, 33(9): 2218−2224.
[5] Ren NQ, Liu BF, Zheng QX,et al. Strategy for enhancing photo-hydrogen production yield by repeated fed-batch cultures.Int J Hydrogen Energ, 2009, 34(18): 7579−7584.
[6] Burgess G, Fernández-Velasco JG. Materials, operational energy inputs, and net energy ratio for photobiological hydrogen production.Int J Hydrogen Energ, 2007, 32(9):1225−1234.
[7] Patrick CH. Fermentative hydrogen production: principles,progress, and prognosis.Int J Hydrogen Energ, 2009,34(17): 7379−7389
[8] Argun H, Kargi F. Effects of sludge pre-treatment method on bio-hydrogen production by dark fermentation of waste ground wheat.Int J Hydrogen Energ, 2009, 34(20):8543−8548.
[9] Yang HH, Guo L, Liu F. Enhanced bio-hydrogen production from corncob by a two-step process: dark- and photo-fermentation.Bioresource Technol, 2010, 101(6):2049−2052.
[10] Li M, Zhao YC, Guo Q,et al. Bio-hydrogen production from food waste and sewage sludge in the presence of aged refuse excavated from refuse landfill.Renew Energ,2008, 33(12): 2573−2579.
[11] Kapdan KI, Kargi F. Bio-hydrogen production from waste materials.Enzyme Microb Tech, 2006, 38(5): 569−582.
[12] Wang CH, Lu WB, Chang JS. Feasibility study on fermentative conversion of raw and hydrolyzed starch to hydrogen using anaerobic mixed microflora.Int J Hydrogen Energ, 2007, 32(16): 3849−3859.
[13] Yao SJ. Study on biocompatibility in a new biomicrocapsule system.Chin J Biotech, 1998, 14(2): 193−197.
姚善泾. 新型生物微胶囊体系的生物相容性研究. 生物工程学报, 1998, 14(2): 193−197.
[14] Zhang J, Yao SJ, Guan YX. Preparation of macroporous NaCS-PDADMAC capsule and its characteristics.J Membrane Sci, 2005, 255(1/2): 89−98.
[15] Chen G, Yao SJ, Guan YX,et al. Preparation and characterization of NaCS-CMC/PDMDAAC capsules.Colloid Surface B, 2005, 45: 136−143.
[16] Mei LH, Yao SJ. Cultivation and modeling of encapsulatedSaccharomycescerevisiaein NaCSPDMDAAC polyelectrolyte complexes.J Microencapsul,2002, 19(4): 397−405.
[17] Ye ZJ, Yao SJ. Cultivation oflactobacillusin microcapsule.Acta Microbiol Sin, 2000, 40(5): 507−512.
叶子坚, 姚善泾. 乳杆菌微囊化培养的研究. 微生物学报, 2000, 40(5): 507−512.
[18] Mei LH, Yang JL, Zhong CL,et al. Cultivation ofBrevibacterium flavumin new microcapsule system and production of glutamic acid.J Zhejiang Univ:Eng Sci,2005, 39(9): 1400−1403.
梅乐和, 杨建丽, 钟春龙, 等. 一种新微胶囊固定化黄色短杆菌产谷氨酸研究. 浙江大学学报: 工学版, 2005,39(9): 1400−1403.
[19] Zhao YN, Chen G, Yao SJ. Microbial production of 1,3-propanediol from glycerol by encapsulatedKlebsiella pneumoniae. Biochem Eng J, 2006, 32: 93−99.
[20] Mei LH, Yao SJ, Lin DQ,et al. Biocompatibility of NaCS and PDADMAC microcapsules withBacillus thuringiensis.J Chem Ind Eng, 1999, 50(5): 592−597.
梅乐和, 姚善泾, 林东强, 等. NaCS-PDADMAC生物微胶囊对苏云金杆菌的生物相容性. 化工学报, 1999,50(5): 592−597.
[21] Mei LH, Yao JT, Yao SJ. Immobilized culture ofBacillus subtilisin NaCS-PDMDAAC microcapsules for production of new anti-thrombus enzyme.J Chem Ind Eng, 2000, 51(6): 896−898.
梅乐和, 姚劲挺, 姚善泾. 一株产溶栓酶枯草杆菌的微胶囊固定化培养. 化工学报, 2000, 51(6): 896−898.
[22] Yao SJ. Improved process for preparation of sodium cellulose sulfate.Chem Eng J, 2000, 78: 199−204.
[23] Ma QL. Enrichment and characterization of mixed hydrogen production flora from digested sludge [D]. Hangzhou:Zhejiang University, 2010.
马茜岚. 厌氧活性污泥中混合产氢菌群的富集及产氢特性的研究[D]. 杭州: 浙江大学, 2010.
[24] Chen G, Zhao YN, Huang H,et al. 1,3-propanediol production from glycerol byKlebsiella pneumoniaencapsulated in NaCS/PDMDAAC capsules.J Chem Ind Eng, 2006, 57(12): 2933−2937.
陈国, 赵亚囡, 黄和, 等. 微胶囊固定化克雷伯杆菌生产1,3-丙二醇. 化工学报, 2006, 57(12): 2933−2937.
[25] Yan RT, Zhu CX, Golemboski C,et al. Expression of solvent-forming enzymes and onset of solvent pro-duction in batch culture ofClostridium butyricum.Appl Environ Microb, 1988, 54(3): 642−648.
Immobilization of mixed bacteria by microcapsulation for hydrogen production―a trial of pseudo “Cell Factory”
Qianlan Ma, Dongqiang Lin, and Shanjing Yao
Department of Chemical and Biological Engineering,Zhejiang University,Hangzhou310027,China
Received:May 26, 2010;Accepted:September 25, 2010
Supported by:National Basic Research Program of China (973 Program) (No. 2007CB7707805).
Corresponding author:Shanjing Yao. Tel/Fax: +86-571-87951982; E-mail: yaosj@zju.edu.cn
国家重点基础研究发展计划 (973计划) (No. 2007CB7707805) 资助。
