人皮肤角质形成细胞无血清原代培养方法的建立
2010-02-03狄正鸿孙晓冬王雅坤陈洪铎高兴华
狄正鸿,孙晓冬,王雅坤,陈洪铎,高兴华
(中国医科大学附属第一医院皮肤科,沈阳110001)
人皮肤角质形成细胞无血清原代培养方法的建立
狄正鸿,孙晓冬,王雅坤,陈洪铎,高兴华
(中国医科大学附属第一医院皮肤科,沈阳110001)
目的 建立人皮肤角质形成细胞体外无血清、无牛垂体提取物及无饲养细胞的原代培养方法。方法 应用胰蛋白酶-EDTA冷温两步消化法消化健康青年包皮皮肤,获取角质形成细胞并置于无血清、无牛垂体提取物、成分确定的角质形成细胞培养基中进行原代培养并传代。通过观察细胞形态和采用免疫组织化学方法鉴定及绘制生长曲线,分析、评价细胞质量。结果该方法可稳定获得高纯度、活性好的角质形成细胞。原代角质形成细胞可稳定增殖2周左右,至少可稳定传代增殖5代。经免疫组织化学方法鉴定,99%以上为角质形成细胞。结论 冷温两步消化法及体外无血清原代培养技术可为科研工作提供足量高质量的角质形成细胞,是高效经济的获得人角质形成细胞的方法。
人类;皮肤;角质形成细胞;无血清;无牛垂体提取物;原代培养
以往体外研究中人角质形成细胞(keratinocyte,KC)多采用由KC经人乳头瘤病毒转染诱导形成的具有永生性、与正常角质形成细胞表型特性相似的HaCaT细胞系[1]。尽管作为体外培养及组织工程皮肤的种子细胞得到了广泛应用,但HaCaT细胞与人来源的皮肤原代角质形成细胞(human primary keratinocyte,HPK)在细胞周期及生理、生化等方面具有多种显著差别[2],不能完全等同于HPK。近年来,随着皮肤科学基础研究及临床治疗技术的迅猛发展,HPK逐渐成为重要的研究工具,广泛应用于皮肤生理、病理、药理、组织工程学及皮肤美容整形等多个领域。本研究旨在建立一种快速、高效、经济的HPK培养方法,为皮肤学科研工作提供足量高质量的角质形成细胞。
1 材料与方法
1.1 材料
1.1.1 组织取材:健康无菌包皮组织取自于中国医科大学附属第一医院泌尿外科就诊的、因包皮过长而施行外科手术的健康青年男性,年龄18~35岁,平均30岁。
1.1.2 主要试剂:无血清、无牛垂体提取物的成分确定的角质形成细胞培养液及0.25%胰蛋白酶-0.04%EDTA溶液(美国Gibco公司),青-链霉素溶液及不含钙、镁离子的PBS缓冲液(美国HyClone公司),鼠抗人广谱细胞角蛋白单克隆抗体MAB-0049(福州迈新生物技术开发公司),免疫组织化学S-P试剂盒(北京中杉金桥生物技术有限公司)。
1.1.3 主要实验仪器:CO2培养箱(美国Queue公司);Olympus倒置相差显微镜、光学显微镜(日本Olympus公司);全能型高性能离心机(日本SANYO公司);超净工作台(苏州安泰公司);蒸汽高压消毒箱(德国Eppendorf公司);25cm2斜颈通气盖培养瓶及6孔板(美国BD公司)
1.2 方法
1.2.1 皮肤角质形成细胞的分离及接种:(1)取材:无菌外科手术获得包皮组织放于含1%青-链霉素溶液的PBS缓冲液中冲洗,去除血液。尽可能除净真皮及皮下组织,将标本切成大约5mm×5mm的小块。(2)消化:置于0.25%胰蛋白酶-0.04%EDTA中,4℃过夜。过夜后可容易分离出表皮部分,用剪刀尽量剪成细小的片状,置于更新的0.05%胰蛋白酶-EDTA中37℃再消化5min,及时加适量血清终止消化。100目筛网过滤。滤液于4℃、1000r/min离心5min。PBS清洗细胞3次,去除血清。(3)接种:将获得的细胞重悬于角质形成细胞培养基,以1×106/ml密度接种于25cm2培养瓶中。3d后首次换液,此后根据细胞生长情况每3~5d换液1次。
1.2.2 HPK的传代:出现较大较多HPK细胞岛后可进行首次传代。按常规的0.05%胰蛋白酶-EDTA消化法进行,1×105/ml密度接种。增殖到70%~80%左右融合时可进行再次传代。
1.2.3 细胞质量控制:通过倒置显微镜进行细胞形态学观察,免疫组织化学法鉴定及绘制生长曲线分析、评价细胞质量。免疫组织化学检测:将HPK及首次传代后的KC细胞接种于盖玻片上爬片培养,染色前24h换含10%胎牛血清的DMEM培养基诱导其分化表达角蛋白;取出玻片,室温下用丙酮固定15min,PBS漂洗3次;3%过氧化氢于室温作用10min,PBS漂洗3次;正常羊血清封闭,室温30min;弃去封闭血清不洗,加入广谱小鼠抗人角蛋白抗体工作液,4℃孵育过夜;PBS漂洗3次;加入生物素化兔抗小鼠IgG二抗及S-P复合物,室温孵育各40min,PBS漂洗3次;DAB显色5min;苏木素复染核;常规梯度乙醇脱水,二甲苯透明,中性树脂封片后光镜下观察。阴性对照在鉴定过程中没有加入特异性一抗。生长曲线的绘制:HPK首次传代后的历代KC细胞进行无血清培养,1×105/ml密度接种于6孔板,每孔2ml,每日计数,绘制生长曲线。
2 结果
2.1 KC的分离、接种及传代
接种后1周左右出现明显的HPK细胞岛。倒置显微镜下正常的HPK细胞为椭圆形及多角形,呈铺路石样增殖排列。一般于接种后的2周内形成较大、较多细胞岛时可进行首次传代(图1)。首次传代后的HPK细胞一般在增殖5d后达到80%左右融合,可稳定传代至少5代(图2)。

图1 接种后的HPK细胞形态学Fig.1 Morphology of HPKafter inoculation

图2 传代后的KC细胞的形态学 ×100Fig.2 Morphology of KCafter passage×100
2.2 免疫组织化学法进行HPK细胞的鉴定结果
免疫组织化学显示HPK及其传代细胞以多角形及类椭圆形为主,所有细胞的胞质染色为棕黄色,为角蛋白阳性(图3)。纯度可达99%。
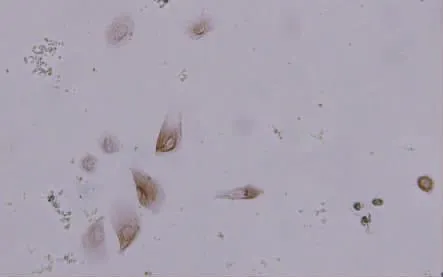
图3 HPK细胞角蛋白免疫组织化学染色 DAB×400Fig.3 Cultured HPKidentified by immunohistochemistry with keratin antibody DAB×400
2.3 生长曲线的绘制
传代KC以1.0×105/ml密度接种于6孔板,每孔2ml,细胞于第5天达到80%左右融合。生长曲线(图4)中潜伏期、指数分裂期和平台期分别为0~3、3~7和7~10d。细胞至少在传代5次内可稳定增殖,细胞形态及生长曲线保持稳定。传代5代以上开始出现明显的增殖速度变慢,细胞形态改变,表现为胞体变大、核模糊、出现空泡、死亡脱落。
2.4 常见污染细胞的形态学鉴别
最常见污染细胞为成纤维细胞,呈长梭状、少分枝的细胞,可呈涡旋状排列(图5A)。其次为黑素细胞,为多角形、多树枝状粗大分枝的细胞(图5B)。

图4 传代后KC的生长曲线Fig.4 Growth curve of KCafter passage

图5 优势生长的成纤维细胞和黑素细胞×200Fig.5 Growth advantage of fibroblasts and melanocytes×200
3 讨论
表皮干细胞(epidermal stem cell,ESC)主要集中于毛囊的隆突部及基底层突入真皮的表皮脚区域。大约1%~10%的皮肤基底层细胞是ESC,具有增殖潜能。正常生理状态下表皮中的多潜能ESC先分化成定向祖细胞,定向祖细胞经过一定分裂次数后进一步定向分化为终末分化细胞[3]。机体内表皮干细胞正常状态下多处于静息状态,在皮肤损伤或体外培养的情况下该细胞分裂、增殖才明显加快。在体外扩增条件下,每个ESC约可进行140次分裂,约产生1040个子代细胞[4],可稳定培养2年左右,然而ESC含量少且提取培养技术复杂,具有分化为多种表皮细胞的潜能。而HPK培养细胞主要来源于ESC分化而来的定向祖细胞,虽体外增殖能力有限,但定向分化为KC细胞,纯度高,可以很好地反映活体状态下的皮肤KC的生理生化功能,因此成为皮肤生理、病理、药理、组织工程学、皮肤美容整形等多领域研究的重要工具。自1967年Briggaman等成功地从人皮肤中分离KC,体外HPK研究一直受到关注,但HPK培养有不易贴壁、易分化以及其他细胞污染等问题较难克服。尽管KC于体外可采用经致死量辐射的小鼠3T3成纤维细胞作为饲养细胞并添加血清的培养基可获良好增殖,然而3T3细胞为异种细胞,可能对KC产生免疫排斥反应。使用异种动物血清的生物学风险也限制了这种培养细胞在临床上的应用,而且在血清的诱导下HPK细胞会加速分化,失去增殖能力。因此血清逐渐被用各种添加成分代替[5],如采用牛垂体提取物作为原发性刺激增殖物质的无血清培养基。但牛垂体提取物作为最初的丝裂原具有较多缺陷:如牛垂体提取物成分复杂,使实验结果不易解释;不同浓度的牛垂体提取物对人KC具有刺激或抑制效应,不利于细胞生理病理下各项调控机制的研究;牛垂体提取物在培养基中只可稳定维持4周。因此无血清、无牛垂体提取物、无需饲养细胞确定成分培养基是最理想的培养基。本实验采用了GIBCO公司成分确定的无血清、无牛垂体成分的培养基,该配方含有胰岛素、表皮生长因子、成纤维细胞生长因子、低浓度的钙离子,无需饲养细胞即可保证HPK的正常贴壁及传代增殖,抑制分化,是目前HPK培养的较好培养基。
由于原代角质形成细胞培养时存在供体之间的差异,经离体打击后恢复分裂功能的能力不同,且可分裂的定向祖细胞存活数目不等,接种时要尽量以高密度进行接种,以保证有较多活性细胞的存在。首次换液时间以接种后2~3d为宜,以保证充分贴壁(图1A)。首次传代前可能需要1~2周(平均10~14d)后能够增殖达到较大、较多的细胞岛,表明细胞较好适应体外培养的环境(图1B)。原代培养的HPK传代后,在单位面积内接种密度一致的情况下,不同的细胞株间可获得较为稳定一致的生长形态(图2)及生长曲线(图4)。KC细胞在2~5代内的细胞生长曲线基本一致。6代以上的细胞形态及生长周期发生明显改变,表现为生长速度变慢、细胞形态变异、出现空泡化现象等。证实原代培养的KC在3~5代内进行实验为最佳。这与既往文献报道原代培养的生命周期在7代以内的结论基本一致[6]。
为抑制HPK分化要注意如下情况:培养过程中要避免接触血清,血清中和胰酶后要用PBS充分清洗;不同于HaCaT细胞系的是,钙离子不仅可诱导KC分化,还能抑制HPK的增殖[7],培养用液体要使用低钙离子浓度培养基(本实验所用培养基钙离子浓度为0.09mmol/L),无钙、镁离子的PBS缓冲液;在细胞增殖及传代过程中要避免细胞过度融合生长,及时传代,以避免接触抑制而导致分化。上述操作可保证细胞处于稳定的增殖状态。
HPK培养中的另一个较为常见的问题是细胞污染的问题。常见的污染细胞为成纤维细胞及黑素细胞。成纤维细胞从形态即可鉴别,为细长少分支的梭状细胞(图5A)。黑素细胞形态上与角质形成细胞在初期相似,不易发现,但随着培养时间的延长,表现为具有典型的较为粗大的树枝样分支(图5B)。但本培养基不适合黑素细胞生长,其增殖速度明显慢于KC,在有大量KC细胞存活的情况下,黑素细胞一般不易成活。发现的黑素细胞污染的个例中一般KC成活率不高,从而形成黑素细胞生长优势。如需进一步鉴定可采用多巴染色,简便易行,如发现胞体内明显的黑素颗粒即为阳性。防止成纤维细胞污染较好的方法是在处理包皮组织时表真皮分离的过程中注意操作细节。如在细胞接种后发现成纤维细胞污染再进行处理,则一般方法较难彻底清除,传统的差速消化以及刮除法效果均不理想。处理包皮组织时要尽量除去皮下及真皮组织,采用锐利剪刀修剪要好于刀片钝性分离。真表皮层分离时采用0.25%胰酶-0.04%EDTA在4℃冷法消化过夜,优于37℃温热消化,细胞存活率高,成纤维细胞污染少。而且EDTA成分可起到抑制成纤维细胞的活性及过度增殖作用。实验中发现不同厂家生产的相同浓度的胰蛋白酶的效价可能相差很多,要注意使用浓度的摸索。过度消化会使HPK细胞不能成活,成纤维细胞污染机会增加。此外,表皮真皮分离亦可采用dispaseⅡ选择性作用于半桥粒结构,消化真皮及表皮的接触层,可以完整的分离出表皮[8],从而较好避免成纤维细胞的污染,但进口dispase价格昂贵,增加实验成本。在进行表真皮分离时采用冷法消化,摸索出适宜的冷消化时间,尽量分离皮下及真皮组织,可较为成功的控制成纤维细胞污染的情况,降低实验成本,操作熟练后成功率较高。
HPK培养的关键在于如何提高细胞分离数量,避免其他细胞污染,维持细胞稳定的生物学活性,操作简便,成本经济。本研究使用胰蛋白酶-EDTA,冷温两步消化法对人包皮皮肤组织进行消化分离,进而进行无血清培养,经用广谱单克隆抗角蛋白抗体免疫组化进行鉴定,99%以上为角质形成细胞,未见成纤维细胞污染,生长曲线可见稳定的指数增生期,可获得较大量满足临床科研需要的角质形成细胞。
[1]Boukamp P,Popp S,Altmeyer S,et al.Sustained nontumorigenic phenotype correlates with a largely stable chromosome content during long-term culture of the human keratinocyte line HaCaT[J].Genes Chromosomes Cancer,1997,19(4):201-214.
[2]Deyrieux AF,Wilson VG.In vitro culture conditions to study keratinocyte differentiation using the HaCaTcell line[J].Cytotechnology,2007,54(2):77-83.
[3]Slack JM.Stem cells in epithelial tissues [J].Science,2000,287(5457):1431-1433.
[4]Akiyama M,Smith LT,Shimizu H.Changing patterns of localization of putative stem cells in developing human hair follicles[J].JInvest Dermatol,2000,114(2):321-327.
[5]Coolen NA,Verkerk M,Reijnen L,et al.Culture of keratinocytes for transplantation without the need of feeder layer cells[J].Cell Transplant,2007,16(6):649-661.
[6]Scbiirer N,Koline A,Schliep V,et al.Lipid composition and synthesis of HaCaTcells,an immortalized human,keratinocyte line,in comparisonwithnormalhumanadultkeratinocytes[J].Exp Dermatol,1993,2(4):179-185.
[7]Micallef L,Belaubre F,Pinon A,et al.Effects of extracellular calcium on the growth-differentiation switch in immortalized keratinocyte HaCaTcells compared with normal human keratinocytes[J].Exp Dermatol,2009,18(2):143-151.
[8]周洪军,胡志奇,谭挺,等.人毛囊外根鞘隆起、真皮鞘和毛乳头细胞高效同步分离培养的方法[J].南方医科大学学报,2008,28(2):193-195.
(编辑 陈 姜,英文编辑 陈 姜)
Serum-free Primary Culture of Human Skin Keratinocytes
DIZheng-hong,SUNXiao-dong,WANGYa-kun,CHENHong-duo,GAOXing-hua
(Department of Dermatology,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo establish a method for the primary culture in vitro of human skin keratinocytes in a serum-,bovine pituitary extract-,and feeder cell-free medium.MethodsThe keratinocytes were isolated from the foreskins of healthy young men by two-step digestion with trypsin-EDTA.The primary culture and passage of keratinocytes was established in the serum-and bovine pituitary extract-free medium.The keratinocytes were identified by morphological observation and immunohistochemistry,and the growth curve was plotted.ResultsPrimary keratinocytes with high purity and activity were obtained in 2weeks and passaged for at least 5consecutive generations.The results of immunohistochemistry showed that 99%of the cultured cells were keratinocytes.ConclusionTwo-step digestion and primary culture in vitro in a serum-and bovine pituitary extract-free medium is an ideal method to obtain enough karatinocytes for research work.
human;skin;keratinocyte;serum-free;bovine pituitary extract-free;primary culture
R322.99;Q343.6
A
0258-4646(2010)12-1037-04
教育部长江学者和创新团队发展计划(IRT0760);辽宁省教育厅高校科研计划项目(L2010697)
狄正鸿(1973-),女,副主任医师,硕士.
高兴华,E-mail:gaobarry@hotmail.com
2010-10-11
