化学助剂协同γ射线辐照制备低分子量壳聚糖
2010-01-26曾虹燕廖凯波吴国忠高文成
曾虹燕,夏 葵,廖凯波,吴国忠,高文成
1.湘潭大学 化工学院 生物技术研究所,湖南 湘潭 411105;2.中国科学院 上海应用物理研究所 辐射技术应用中心,上海 201800
壳聚糖是一种天然生物高分子材料,具有无毒、抗菌保健、良好的生物相容性和可降解等性能,在化工、医药、印染等领域有着广泛的应用[1]。近年来,低分子量壳聚糖的制备得到了许多学者的重视,对壳聚糖的不同降解法得到了深入的研究[2]。由于相对分子质量对壳聚糖的性质有很大影响,因此将壳聚糖降解到需要的相对分子质量是其应用的前提。目前主要使用化学降解法[3],化学试剂双氧水由于其降解成本低、产品无残毒等优点得到广泛应用,但反应时间长,易发生副反应。硼氢化钠易于与壳聚糖中乙酰氨基发生亲和取代反应,生成具有氨基的壳聚糖,但硼氢化钠易产生硼污染。L-α-丙氨酸液中的氨基能提高壳聚糖的氨基含量,改善活性,但降解效果不明显。因此,选择合适的降解方法具有重要意义。
γ射线辐照方法降解壳聚糖工艺,具有操作简单、无污染、易控制、技术附加值高并可在常温下进行等优点,国内外学者已展开了广泛研究[4-6]。本工作拟以化学试剂双氧水、硼氢化钠和L-α-丙氨酸为溶液,采用γ射线辐照新技术,降解制备一系列低相对分子质量的壳聚糖,研究γ射线剂量对不同溶液中壳聚糖的降解、脱乙酰度和白度的影响。
1 实验部分
1.1 试剂和仪器
壳聚糖,自制,相对分子质量2.6×105,脱乙酰度80.5%,白度69%;其余试剂均为分析纯。60Co辐射源,中国科学院上海应用物理研究所;Specrum Qne B型傅立叶变换红外光谱仪,美国PE公司;U-2001紫外-可见分光光度仪,日本HITACHI公司;YQ-Z-48A型白度仪,上海三准仪器设备有限公司。
1.2 试验方法
1.2.1γ射线辐照制备低分子量壳聚糖 准确称取壳聚糖样品若干,分别分散于蒸馏水、w=0.5%硼氢化钠水溶液、w=0.5%L-α-丙氨酸水溶液和w=1.0%双氧水溶液中,配成10%的壳聚糖悬浊液,超声波除去悬浊液空气,通入氮气,进行不同剂量的60Co(0、25、50、100、150、200 kGy)辐照,抽滤。浓缩滤液,无水乙醇检验壳聚糖的水溶性。同时真空干燥滤出物,得低分子量壳聚糖,称重,备用。

1.2.3脱乙酰度(D.D)的测定 电导滴定法参考文献[8]测定。
1.2.4白度测定 参见GB 12097—89测定。
2 结果和讨论
2.1 辐照剂量对不同溶液中壳聚糖的降解
γ射线在大气和真空环境下对壳聚糖的照射都使壳聚糖发生明显的降解反应,如图1(a)所示。壳聚糖相对分子质量随辐照剂量的增加而呈下降趋势,辐照降解效果明显。
w=1.0% H2O2液中,壳聚糖降解速度最快,100 kGy辐照剂量时,样品相对分子质量减小至2.5×104;200 kGy时,降至1.8×104。在水中辐照剂量分别为100 kGy和200 kGy时,样品相对分子质量由2.6×105降至5.3×104和2.8×104。在w=0.5% NaBH4和w=0.5% L-α-丙氨酸液中,小于25 kGy时,壳聚糖相对分子质量降解缓慢;25~100 kGy辐照范围,相对分子质量降解速度加大;100~200 kGy范围,样品相对分子质量均略有减少。100~200 kGy范围,w=0.5% NaBH4和w=0.5%L-α-丙氨酸液中的壳聚糖相对分子质量下降速度与水的几无差异。由图1(a)可知,分散在双氧水中的壳聚糖相对分子质量降解最为剧烈,样品相对分子质量也最低。
0~100 kGy辐照范围,所有样品随辐照剂量的增加,其相对分子质量急剧下降。当辐照剂量继续增大,样品的相对分子质量下降明显减缓,基本上保持在1.8×104~2.8×104范围内,降解效果不明显。其它多糖经过辐照后也得到类似的结果,比如琼脂、海藻酸盐,尤其是卡拉胶溶液。γ射线辐照可以诱导壳聚糖多聚物β(1-4)糖苷键的断裂,从而使聚合物的相对分子质量降低;因此对壳聚糖进行一定剂量的辐照可以使得壳聚糖的粘度迅速降低[9]。γ射线辐照对在H2O2中的壳聚糖相对分子质量降解速率最快,能力最强,可能H2O2经辐照分解出的·OH对壳聚糖的降解有至关重要的作用,·OH引发了壳聚糖的自由基降解,同时,·OH的强氧化作用又引发其氧化降解,两种作用综合结果,使壳聚糖的降解速度大大增加[10]。
2.2 辐照降解对不同溶液中壳聚糖脱乙酰度的影响
辐照剂量对不同溶剂中壳聚糖脱乙酰度的影响示于图1(b)。从图1(b)可知,在未辐照条件下,分散在水中的样品的脱乙酰度保持不变,为80.4%;25 kGy辐照时脱乙酰度略有提高,为84.1%,但并不随辐照剂量继续增大而改变。辐射电离H2O中的OH-离子与乙酰基发生反应,可能取决于两种作用,即酰氨的水解阻力和小分子扩散阻力。反应后期由于分子胶团阻力,使得OH-离子难以扩散进入壳聚糖,而使反应难以进行。这使甲壳素脱乙酰化反应很难达到高脱乙酰度[11]。

图1 辐照剂量对壳聚糖相对分子质量(a)、脱乙酰度(b)和白度(c)的影响Fig.1 Effect of radiation dose on average-molecular weight(a), chitosan deacetylation(b) and the white degree(c) of chitosan■——H2O,○——NaBH4,★——丙氨酸(Alanine),▽——H2O2
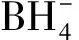
分散在L-α-丙氨酸液中的壳聚糖未辐照时,其脱乙酰度提高到83.4%,25 kGy辐照样品脱乙酰度稍有提高,为87.5%,进一步增大辐照剂量对壳聚糖脱乙酰度几无影响。可能L-α-丙氨酸液中本身已含有氨基整合到壳聚糖的分子中,故未辐照时样品脱乙酰度有所提高。增大辐照剂量为25 kGy,辐射部分氨基酸开链,使得氨基基团进一步整合到壳聚糖的分子中,使得壳聚糖分子中的氨基略微增多。未辐照的H2O2中壳聚糖脱乙酰度也升高到87.5%;与25 kGy辐照强度下的相差无几(87.1%);50 kGy辐照剂量下其脱乙酰度则迅速降至83.7%;100~200 kGy剂量时,其脱乙酰度稳定在80.4%左右。可能当辐照强度大于25 kGy时,增大辐照强度能产生更多的强氧化性基团与部分氨基反应,降低了氨基的含量,使得脱乙酰度降低。
综上可知,所有样品的脱乙酰度几乎均处于80.4%~87.5%的范围内,辐照剂量对壳聚糖脱乙酰度无显著影响,从FTIR分析可知,辐照没有改变壳聚糖的酰胺结构,其酰胺结构保持不变(图2),这与张志亮等[12]报道相符。 综合图1(a)、(b)结果,在一定溶剂环境和辐照剂量下,壳聚糖降解产物的脱乙酰度与其分子量不相关,无章可循。

图2 不同溶液、不同辐照剂量下的壳聚糖的UV图谱Fig.2 UV-VIS spectra of the chitosan under different irradiation自下而上(From bottom to top):0 kGy,H2O;100 kGy,NaBH4;100 kGy,丙氨酸(Alanine);0 kGy,H2O2;25 kGy,H2O2;100 kGy,H2O2
2.3 辐照对不同溶液中壳聚糖白度的影响

2.4 辐照剂量对不同溶液中水溶性壳聚糖的形成
低于25 kGy辐照剂量,所有降解样品的水溶性壳聚糖均无检出。在50~200 kGy辐照剂量下,随着辐照剂量的增加,水溶性壳聚糖含量均有所增加。在相同辐照剂量下,H2O2中的水溶性壳聚糖含量最高,水、NaBH4和L-α-丙氨酸液中的水溶性壳聚糖的含量几无差异。在200 kGy辐照剂量下,H2O2中的水溶性壳聚糖含量为6%;其余三者为4%。
γ射线辐照H2O2中壳聚糖生成的水溶性壳聚糖含量最高,主要是因为γ射线辐照对H2O2中的壳聚糖分子量降解能力最强,使得其产生低分子水溶性的壳聚糖的概率较之其它溶液的大,故产生较多的水溶性壳聚糖。但在本文现有的实验条件下,较难得到高含量水溶性壳聚糖,而低分子量壳聚糖居多。
2.5 UV-VIS分析



2.6 FTIR分析


图3 不同溶液、不同辐照剂量下壳聚糖的 FTIR图谱Fig.3 FTIR spectra of the irradiated chitosan samplesa——0 kGy,H2O;b——100 kGy,H2O;c——0 kGy,H2O2;d——25 kGy,H2O2;e——100 kGy,H2O2;f——100 kGy,丙氨酸(Alanine);g——100 kGy,NaBH4
3 结 论
用γ辐照降解法成功制备了一低相对分子质量的壳聚糖,研究了γ射线剂量对不同溶液中壳聚糖的降解、脱乙酰度和白度的影响。在小于100 kGy辐照范围内,随辐照剂量的增加,所有样品的相对分子质量急剧下降。当辐照剂量继续增大 (>100 kGy),壳聚糖降解效果不明显。辐照降解时壳聚糖酰胺结构基本保持不变,脱乙酰度无显著变化。在低辐照 (<150 kGy) 条件下,NaBH4或L-α-丙氨酸溶液对壳聚糖的白度有一
定的保持效果。
[1] 徐 鑫,王 静.甲壳质和壳聚糖的开发及应用[J].哈尔滨工业大学学报,2002,34(1):95-100.
[2] 朱孔营,渠荣遴,李 方.低分子量壳聚糖制备与应用研究进展[J].高分子通报,2006,(2):41-45.
[3] 陈 巍,罗志刚,李忠彦,等.物理方法在壳聚糖降解中应用[J].酿酒,2006,33(2):57-60.
[4] 赵军旗,邓钢桥,邹朝晖.辐射加工技术在壳聚糖降解中的应用研究[J].湖南农业科学,2007,(1):103-105.
[5] 张卫东,李正魁,朱佳廷,等.壳聚糖电离辐射降解的研究[J].核农学报,2005,19(1):55-57.
[6] 杨 波,赵榆林,杨万明,等.γ射线辐照降解壳聚糖的工艺和机理研究[J].化学世界,2006,47(11):660-662.
[7] 杨国臣.黏度法测定壳聚糖的相对分子质量的研究[J].雁北师范学院学报,2006,22(2):45-46.
[8] 贾之慎,李秀玲.酸碱电导滴定法测定壳聚糖脱乙酰度[J].分析化学,2002,30(7):846-848.
[9] Choi W S, Ahn K J, Lee D W, et a1. Preparation of Chitosan Oligomers by Irradiation[J]. Polym Degrad Stab, 2002, 78 (3): 533-538.
[10] 康 斌,戚志强,伍亚军,等.γ辐射降解法制备小分子水溶性壳聚糖[J].辐射研究与辐射工艺学报,2006,24(2):83-86.
[11] 张子涛,陈东辉,陈 亮,等.甲壳素脱乙酰化及其动力学[J].青岛大学学报(工程技术版),2000,15(4):23-26.
[12] 张志亮,彭 静,黄 凌,等.壳聚糖在水溶液中的辐射降解反应[J].高分子学报,2006,7:841-847.
[13] Qin C Q, Du Y M, Xiao L. Effect of Hydrogen Peroxide Treatment on the Molecular Weight and Structure of Chitosan[J]. Polym Degrad Stab, 2002, 76(2): 211-218.
[14] 李 治,刘晓非,徐怀玉,等.壳聚糖的γ射线辐射降解研究[J].应用化学,2001,(2):104-107.
