抗菌肽对高龋患者口内变异链球菌生长的影响
2010-01-26王丽娜刘启成牛卫东
王丽娜,史 春,刘启成,牛卫东
(大连医科大学 口腔医学院 口腔内科教研室,辽宁 大连 116044)
药物治疗是龋病预防及治疗的方法之一,含氟制剂的使用是目前龋病预防最常用的方法,但长期使用,可以产生具有更高抗酸力的耐氟菌株,更易引起牙体硬组织的酸蚀脱矿[1]。因此,寻找安全而又有效的生态调节制剂已成为口腔常见感染性疾病防治研究的重点。
抗菌肽是多细胞生物体自身防御体系产生的具有高效广谱抗菌活性的小分子肽,具有独特的抗菌机理,是机体赖以对抗微生物感染、在自然界得以生存的重要防御分子,故极有希望开发成为一类新型的广谱高效抗菌药物[2]。但是天然的抗菌肽生物效能低,且具有蛋白水解的不稳定性[3],为了克服这些缺点,模仿抗菌肽的特性,通过较少的改变一些结构人工合成抗菌肽的同型物,为在生物医学领域对抗菌肽的研发应用开辟了广阔的空间[4]。KSL是研究者依据天然抗菌肽的特性,采用分子生物学技术合成的有较强抑菌性能的新型抗菌肽[5]。体外抑菌实验表明,KSL对口腔常见致龋菌的最小抑菌浓度为3~100 μg/mL[6]。目前在国内尚未见到关于抗菌肽KSL对变异链球菌作用的报道,关于KSL对临床分离致龋菌的生长抑制情况的研究亦少见,本文主要研究KSL对高龋患者口内变异链球菌(Streptococcusmutans,S.mutans)的生长抑制情况。
1 材料和方法
1.1 抗菌肽KSL的溶液制备
依据十肽的氨基酸序列:KKVVFKVKFK-NH2[5],由成都诚诺新技术有限公司合成并进行质谱鉴定,质谱分析显示其分子量为1249.958,高效液相色谱分析显示其纯度为98.22%。用双蒸水配制浓度为4 mg/mL的KSL溶液,针孔滤器过滤后备用。
1.2 高龋患者口内变异链球菌的分离与鉴定
选自于大连医科大学附属口腔医院就诊的高龋患者(DMFT≥6)5人,受试者近3个月内未服用抗生素,口腔卫生良好,无全身系统性疾病,无牙齿结构异常,清洗受试者唇或颊侧釉质区,隔湿、干燥,用无菌刮匙刮取釉质光滑面菌斑,置于预先消毒灭菌,盛有1 mL TE缓冲液中的EP管中立即送检。将标本置于漩涡振荡器上震荡1 min,用PBS缓冲液作10倍系列稀释,去原液、10-1、10-2、10-3稀释液各50 μL分别接种于MSB琼脂培养平板,80%N2、10%H2、10%CO2,37℃下兼性厌氧培养48 h,进行菌落检测和镜检细菌形态学鉴定[7]。将具有典型菌落及菌体形态的单个菌落接种于MSB培养平板进行次代培养,菌落和镜检证实为纯培养后,再接种至TPY液体培养基培养18 h,镜检证实无污染后用50%甘油TPY液体保种。将国际标准株与甘油保种变异链球菌临床分离株分别接种于TPY培养平板内,培养条件同细菌初代培养,收集部分菌落用微量生化板法做生化鉴定,若与标准株相同,认定分离细菌为变异链球菌。
1.3 实验菌株及菌悬液的制备
取变异链球菌ATCC 25175(四川大学华西口腔医学院惠赠)及高龋患者临床分离变异链球菌的甘油保存液50 μL,接种于固体培养基上,于80%N2、10%H2、10%CO2,37℃下兼性厌氧培养24 h,恒温培养箱37℃培养24 h进行细菌复苏。挑取部分菌落革兰氏染色后光学显微镜下观察菌落形态,证实无污染后传代培养备用。
无菌接种环挑取经鉴定的纯培养单个细菌菌落置于含2 mL液体培养基的康氏管中进行24 h增菌,用磷酸缓冲液(PBS),使用麦氏比浊管测定细菌浓度,配制成浓度为2×106cfu/mL的细菌菌悬液备用。
1.4 最小抑菌浓度(MIC)及最小杀菌浓度(MBC)测定
实验分组:阴性对照组:不含药物的菌悬液培养基,每组四个平行;阳性对照组:含0.1%洗必泰的菌悬液培养基,每组四个平行;实验组:含不同浓度的KSL菌悬液培养基,每组三个平行。
将浓度为4 mg/mL的KSL按2倍稀释法溶于液体培养基中,使其终浓度为2.0000、 1.0000、0.5000、0.2500、0.1250、0.0625、0.0313、0.0156 mg/mL。浓度为2×106cfu/mL菌悬液与各组药液按比例(v/v),各100 μL分别接种于96孔板中,使菌悬液终浓度为1×106cfu/mL,用微量震荡器震荡1 min后,置于各自的培养环境中培养24~48 h。在黑色背景下,以肉眼观察无浑浊出现的最小抑菌浓度(MIC)值。选择大于MIC浓度的各孔,分别取20 μL涂布于固体培养基上,相同条件下培养,观察菌落数少于5~6个的最低浓度为最低杀菌浓度(MBC)[8]。所有菌种的MIC测定实验重复3次。
1.5 KSL对变异链球菌杀菌曲线的测定
将200 μL的S.mutans标准株菌悬液加入含2×MIC浓度的KSL的TPY液体培养基(实验组1)、S.mutans临床株菌悬液加入含2×MIC浓度的KSL的TPY液体培养基(实验组2)、0.1%洗必泰的TPY液体培养基(阳性对照组)及TPY液体培养基(阴性对照组)中,菌悬液与TPY液体培养基的比例为1∶9(v/v),S.mutans的终浓度为1×106cfu/mL。80%N2、10%H2、10%CO2,37℃下兼性厌氧培养,分别培养0、5、10、20、30、60、120、240 min提取菌液。PBS缓冲液梯度稀释(0、10、100、1000倍)后取50 μL菌液涂布于TPY固体培养基上,用ProtoCOL SR 全自动菌落计数仪计数菌落数。菌落数(cfu/mL)的对数值(log)为纵坐标,时间为横坐标。作图绘制生长曲线。活菌计数减少99.9%即差异>3 log10cfu/mL者视为有杀菌作用,活菌计数下降1~3 log10cfu/mL者视为有抑菌作用[9]。实验重复3次,取平均值。
2 结 果
2.1 高龋患者口内变异链球菌的分离与鉴定
肉眼见MSB琼脂平板上典型变异链球菌菌落为嵌入琼脂、质硬、突起、表面粗糙。经革兰染色,油镜(10×100)下可见变链菌菌落为G+小球菌,呈长链状或短链状,成队或分散排列。细菌生化反应结果与变异链球菌标准株各个生化试剂反应结果相似,见表1。其中5例被检菌斑中有3例分离出变异链球菌,本实验选取其中1例的临床株作为实验菌株。
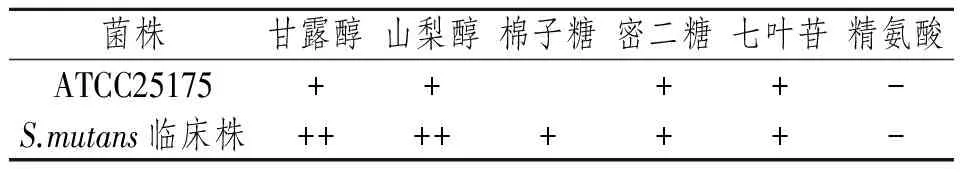
表1 变异链球菌生化鉴定结果Tab 1 Biochemical identification results of S.mutans
2.2 最小抑菌浓度(MIC)及最小杀菌浓度(MBC)值的测定
抗菌肽KSL对变异链球菌标准菌株及高龋患者临床分离株的MIC均为0.0625 mg/mL,MBC值为0.1250 mg/mL及0.2500 mg/mL,表明KSL对标准株及临床分离株的抑菌效果相似,见表2。
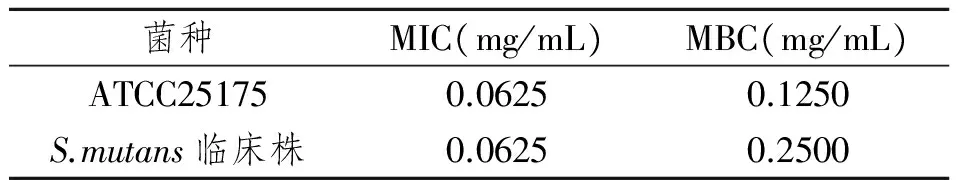
表2 KSL对S.mutans标准株及临床分离株的MIC及MBC值Tab 2 MIC and MBC of KSL on S.mutans standard strains and clinical isolated strains
2.3 KSL对变异链球菌杀菌曲线的测定
阴性对照组在这4 h之内细菌的数量变化不明显,0.1%洗必泰阳性对照组在10 min后完全杀灭细菌。2×MIC浓度的KSL,在5 min内就能够减少S.mutans标准株的数量,20 min可达到杀菌效果,30 min后可完全杀灭细菌;2×MIC浓度的KSL,在10 min能够明显减少S.mutans高龋患者临床株的数量,20 min后亦可达到杀菌效果,1 h之后能完全杀灭细菌,KSL要完全杀灭高龋患者口内的变异链球菌,所需时间要长于标准菌株,见图1。
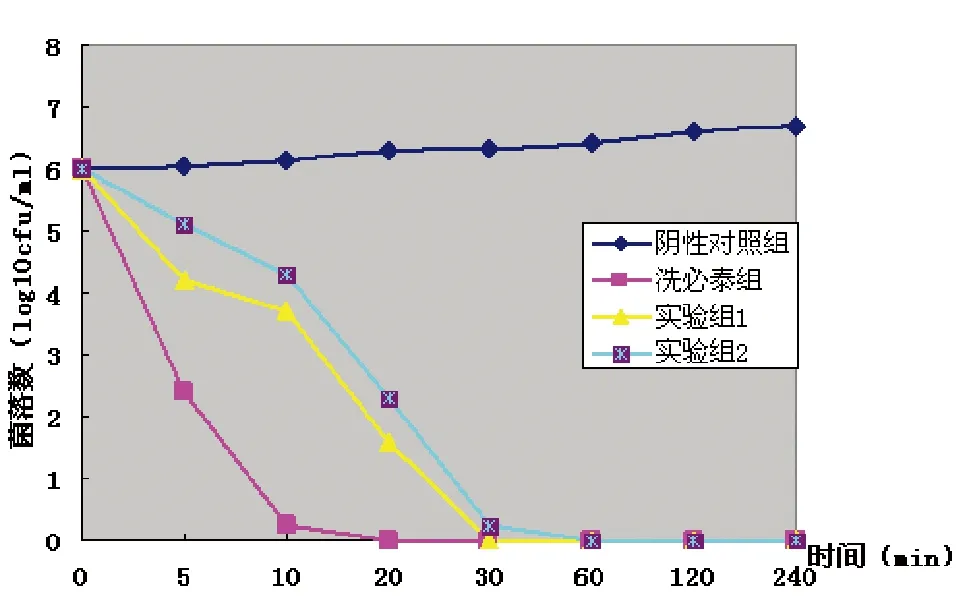
图1 抗菌肽KSL对变异链球菌的杀菌曲线Fig 1 Bacteria kill curve of Antimicrobial peptide KSL on S.mutans
3 讨 论
20世纪90年代末期,有研究者开始探索抗菌肽对口腔微生物的作用,目前有关研究逐渐增多。天然抗菌肽生物效能低,且具有蛋白水解的不稳定性。近年的研究表明,人工合成抗菌肽比天然抗菌肽更显优势。KSL为在人工合成的多肽菌库中,有较强的抑菌作用的新型抗菌肽。体外抑菌实验表明KSL能完全杀死白色念珠菌,同时对金黄色葡萄球菌、表皮葡萄球、大肠杆菌等都有较强的抑菌杀菌作用,对口腔常见致龋菌的最小抑菌浓度为0.03~0.1 mg/mL[6]。KSL的体外细胞毒性实验说明KSL只针对原核生物界,而对哺乳动物细胞并无毒性。
变异链球菌是主要致龋菌,从高龋患者口内分离变异链球菌,研究KSL对临床菌株的抑菌效果,对KSL今后的临床应用有着指导意义。本实验采用经典的培养法及生化鉴定方法,成功的分离出变异链球菌3株,选取其中1株作为实验菌株,保证了实验的顺利进行。实验采用美国国立临床实验室标准化委员会(National Committee for Clinical Laboratory Standards,NCCLS)推荐的药物敏感试验(Antimicrobical Susceptibilitory Testing)液体稀释法测定了KSL对变异链球菌标准菌株及实验菌株的MIC及MBC值,结果显示KSL对S.mutansATCC 25175及临床菌株的MIC相同,MBC临床菌株高于标准株。
通过观察KSL对变异链球菌生长的杀菌曲线发现,阴性对照组在这4 h之内细菌的数量变化不明显,0.1%洗必泰阳性对照组在10 min后完全杀灭细菌。2×MIC浓度的KSL,在5 min内就能够减少S.mutans标准株及临床株的数量,20 min后可达到杀菌效果,30 min之后基本上可完全杀灭细菌,且在4 h之内无细菌生长。说明KSL能在较短时间内杀灭变异链球菌,同时提示KSL可能具有抗生素后效应,即细菌与抗生素或抗菌药物,经短时间接触,将残留抗生素清除后,细菌生长仍受抑制的生物现象。这也表明,可将KSL用于口内局部用药,通过短时间的药物解除后能持续抑制变异链球菌生长,从而达到抑龋目的。从KSL对变异链球菌标准菌株及临床株的杀菌曲线中可以看出,KSL对标准株的抑杀效果优于临床菌株,这可能与临床菌株较强的致龋性及自身结构有关,下一步实验将对临床菌株的血清型及致龋基因等作进一步分析研究。
以往的研究结果表明,KSL的特性为具有阳离子残基及亲水性,表明它的抗菌机制可能主要为通过其双亲性α-螺旋结构上正电荷与细菌细胞膜上负电荷之间的静电吸引而结合聚集在质膜上,打乱了质膜上蛋白质和脂质原有的排列秩序,从而导致细胞膜结构紊乱,达到杀灭细菌的目的。但是其确切的抑菌机制尚不清楚,尤其是对标准株及临床株的抑杀效果尚有不同,下一步研究的重点是研究其对高龋患者口内变异链球菌的抑菌机制,检测KSL作为一种潜在的抗口腔微生物制剂的临床实用性。
[1] Liang Li.The biochemistry and physiology of metallic fluoride:action,mechanism,and implications[J].Crit Rev Oral Biol Med,2003,14(2):100-114.
[2] Parisien A,Allain B.Novel alternatives to antibiotics:bacteriophages,bacterial cell wall hydrolases,and antimicrobial peptides[J].J Applied Microbiol,2008,104(1):1-13.
[3] Hale,JP,Hancock,REW.Alternative mechanisms of action of catianic antimicrobial pepfides on bacteria[J].Expert Rev Anti Infect Ther,2007,5:951-959.
[4] Giuliani A,Pirri G.Antimicrobial peptides:natural templates for synthetic membrane-active compounds[J].Cell Mol Life Sci,2008,65,2450-2460.
[5] Hong SY,Choi M J,Lee J H et al.Identification and characterization of novel antimicrobial decapeptides generated by combinatorial chemistry[J].Antimicrob Agents Chemother,1998,42:2534-2541.
[6] Concannon S P,Crowe T D,Abercrombie J,et al.Susceptibility of oral bacteria to an antimicrobial decapeptide[J].J Med Microbiol,2003,52:1083-1093.
[7] 肖晓蓉.口腔微生物学及实用技术[M].北京:北京医科大学出版社出版,1993.127.
[8] 周学东,肖晓蓉.口腔微生物[M].成都:四川大学出版社,2002.386.
[9] Elippoulos GM,Moellering RC.Antimicrobial combinations[J].Antibiotics Lab Med,1991,3:432-449.
