P57KIP2和PCNA在胃癌组织中的表达及意义
2010-01-26卢书明张竹青刘丽娜王朝晖
卢书明,张竹青,刘丽娜,王朝晖,李 梅,吕 申
研究发现众多癌基因、抑癌基因改变及细胞生命活动异常最终都汇聚到细胞周期的调控上来。细胞周期调控异常与肿瘤发生、发展密切相关,肿瘤被认为可能是一种细胞周期疾病[1]。P57KIP2蛋白与细胞周期依赖激酶复合物(CDKs)结合抑制CDKs的功能,使细胞周期停滞于G1期,从而抑制细胞增殖。增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)是细胞周期正向调控因子,它可促使细胞由G1期向S期转换,是反映细胞增殖活性的良好指标。本研究应用免疫组化SP法检测P57KIP2和PCNA蛋白在胃癌及非癌胃黏膜中的表达,旨在探讨两者在胃癌发生、发展中的作用及其与胃癌临床病理特征之间的关系。
1 材料和方法
1.1 病例资料
收集大连医科大学附属第一医院2008年10月~2009年8月因上消化道症状行胃镜检查的胃癌及非癌胃黏膜共105例。其中,胃癌57例,非癌胃黏膜组48例,均经病理组织学证实。胃癌组男性42例,女性15例,年龄37岁~85岁,平均年龄64.07岁。其中,高中分化腺癌14例,低分化腺癌34例,粘液癌9例。根据国际抗癌联盟1987年公布的胃癌TNM临床病理分期标准进行临床分期。所有对象受检前均未经放疗、化疗等治疗。非癌胃黏膜组男性34例,女性14例,年龄41岁~85岁,平均年龄64.10岁。标本经10%中性福尔马林溶液固定,常规石蜡包埋,4 μm厚连续切片,分别做HE、SP免疫组化染色。
1.2 方 法
HE染色切片用于胃癌分化程度的判断。SP免疫组化染色按试剂盒说明操作,组织抗原经微波修复。抗P57KIP2兔抗人多克隆抗体(RAB-1017)、S-P试剂盒及DAB显色剂试剂盒均购自福州迈新生物技术公司;抗PCNA鼠抗人单克隆抗体购自NEMARER公司。用已知阳性片作阳性对照,PBS代替一抗作阴性对照。
1.3 结果判定
P57KIP2蛋白以细胞核或胞浆染色呈棕黄色为阳性反应细胞。PCNA以细胞核染色呈棕黄色视为阳性细胞。每张切片在400倍镜下均观察整体染色情况,选择5个有代表性的区域,每个区域计算200个细胞。阳性细胞数计分:阳性数<5%为0;阳性数>5%,但≤35%为1;阳性数>35%,但≤70%为2;阳性数>70%为3。着色强度计分:不着色为0,弱着色(呈淡棕黄色)为1,强着色(呈明显的棕黄色)为2。阳性分级:以上两项相加,0分为(-),2分为(±),3分为(+),4分为(++),5分为(+++):+~+++计为阳性,-~±计为阴性。
1.4 统计学方法
采用SPSS 11.5软件中χ2检验、确切概率法统计分析数据,P<0.05为差异有显著性意义。
2 结 果
2.1 P57KIP2蛋白、PCNA在胃癌组织及非癌胃黏膜中的表达情况
P57KIP2蛋白在57例胃癌组织中有25例阳性表达,阳性表达率为43.9%,48例非癌胃黏膜组织中38例表达阳性,阳性表达率为79.2%,两者相比差异有显著性意义(χ2=10.65,P<0.05)。在57例胃癌组织中有46例阳性表达,阳性表达率为80.7%,48例非癌胃黏膜组织中28例表达阳性,阳性表达率为58.3%,两者相比差异有显著性意义(χ2=6.30,P<0.05)。见表1、图1~4。
2.2 P57KIP2蛋白、PCNA与临床及病理特征的关系
P57KIP2蛋白在高中分化腺癌、低分化腺癌、粘液癌组中阳性表达率分别为71.4%、32.4%、44.4%,高中分化腺癌组P57KIP2蛋白阳性表达率明显高于低分化腺癌组,两者相比差异有显著性意义(P<0.05),而高中分化腺癌组与粘液癌组P57KIP2蛋白阳性表达率比较差异无显著性意义(P>0.05)。淋巴结转移组与无淋巴结转移组P57KIP2蛋白阳性表达率分别为41.4%、50%,临床分期为Ⅲ~Ⅳ期与临床分期为Ⅰ~Ⅱ期的P57KIP2蛋白阳性表达率为41.1%、50%,两组组间比较差异无显著性意义(P>0.05);浸润深度未累及浆膜者与累及或穿透浆膜P57KIP2蛋白阳性表达率分别为33.3%、46.6%,肿瘤≥5 cm与肿瘤<5 cm组P57KIP2蛋白阳性表达率分别为54.1%、36.6%,两组组间比较差异均无显著性意义(P>0.05)。结果提示,P57KIP2蛋白表达与胃癌分化程度呈正相关,而与淋巴结转移、浸润深度、临床分期、肿瘤大小无明显相关性。见表2。

表1 P57KIP2、PCNA在胃癌组织及非癌胃黏膜中的表达Tab 1 The expression of P57KIP2,PCNA in gastric carcinoma and peri-carcinoma gastric tissues (n)
1)与非癌胃黏膜相比P<0.05
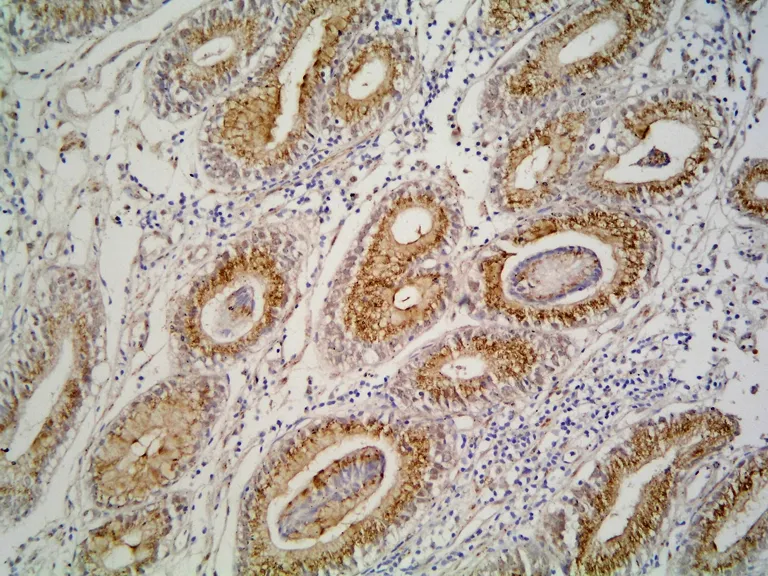
图1 P57KIP2在非癌胃黏膜的表达 (SP×400)Fig 1 P57KIP2 immunohistochemistry staining in peri-carcinoma gastric tissue (SP×400)
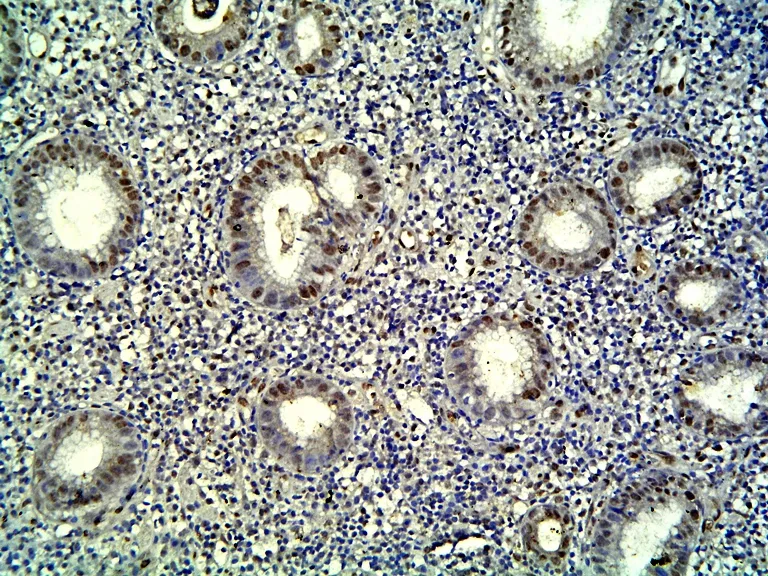
图3 PCNA在非癌胃黏膜的表达 (SP×400)Fig 3 PCNA immunohistochemistry staining in peri-carcinoma gastric tissue (SP ×400)
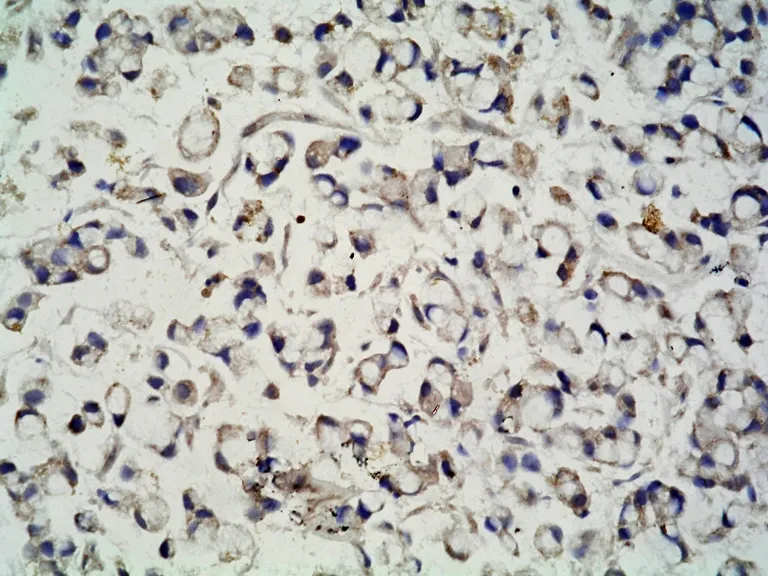
图2 P57KIP2在胃癌黏膜表达明显降低 (SP×400)Fig 2 P57KIP2 immunohistochemistry staining in gastric carcinoma tissue is increased obviously (SP ×400)

图4 PCNA在胃癌黏膜中表达明显增强 (SP×400)Fig 4 PCNA immunohistochemistry staining in peri-carcinoma gastric tissue is increased obviously (SP ×400)
PCNA在高中分化腺癌、低分化腺癌、粘液癌组中阳性表达率分别为57.1%、88.2%、88.8%,高中分化腺癌组PCNA蛋白阳性表达率明显低于低分化腺癌组,差异有显著性意义(P<0.05),高中分化腺癌组与粘液癌组比较差异无显著性意义(P>0.05);淋巴结转移组PCNA阳性表达率为82.9%高于未发生淋巴结转移组的75%,临床分期为Ⅲ~Ⅳ期PCNA的阳性表达率为82.1%,高于临床分期为Ⅰ~Ⅱ期的77.8%,浸润深度未累及浆膜组PCNA阳性表达率为83.3%,高于累及或穿透浆膜组的80.0%,但三组组间比较差异均无显著性意义(P>0.05);肿瘤≥5 cm组与肿瘤<5 cm组PCNA阳性表达率分别为79.2%、81.8%,两者相比差异无显著性意义(P>0.05)。结果提示,PCNA表达与胃癌组织分化程度呈负相关,而与淋巴结转移、浸润深度、临床分期、肿瘤大小无显著相关性。见表2。
3 讨 论
真核生物细胞周期的调控是由一系列细胞周期调控因子参与的复杂过程。细胞周期调节异常是细胞过度增殖及癌变的重要原因[2]。调控细胞周期进程的核心是细胞周期蛋白依赖激酶(CDKs),细胞周期蛋白(Cyclin)可与之结合形成有活性的复合物,促进细胞周期进程,而细胞周期蛋白依赖激酶抑制剂(CKIs)与CDK结合后抑制CDK-Cyclin复合物功能,使细胞周期停滞,阻止细胞增殖。根据CKIs的结构和功能特点,分为INK4家族和CIP/KIP家族。p57KIP2基因定位于11p15.5染色体,其功能与p21、p27相同,是一种抑癌基因,其表达产物P57KIP2蛋白是细胞周期负性调控因子,属于CIP/KIP家族[3,4]。P57KIP2蛋白主要通过抑制CDK复合物的功能,使细胞不能顺利进入S期,而停止于G1期,从而实现对细胞周期的负性调控作用。
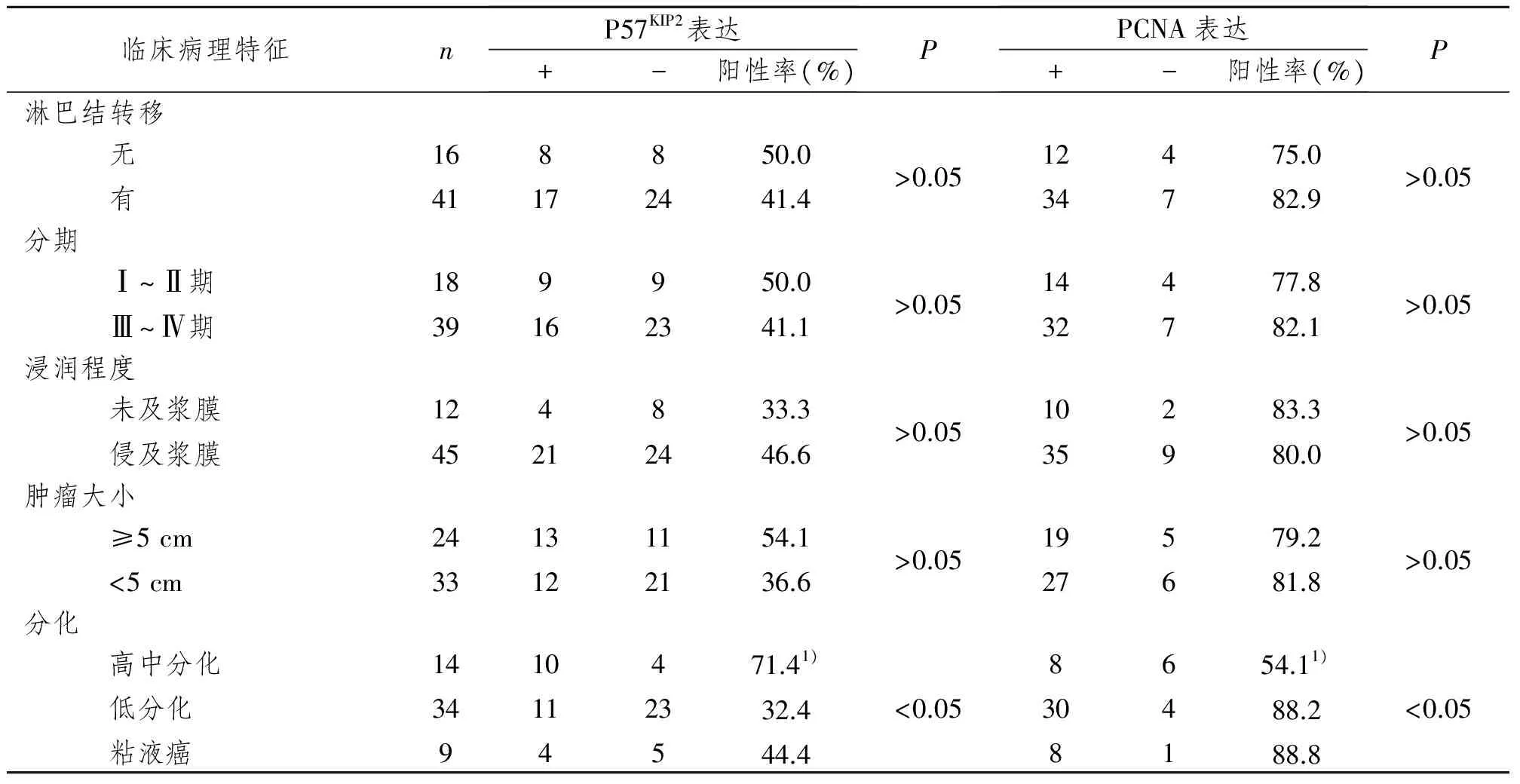
表2 P57KIP2蛋白、PCNA与临床病理特征的关系Tab 2 The relation of P57KIP2,PCNA with the clinical pathological parameters (n)
1)与低分化相比,P<0.05
近年来,国内外对包括肝癌、胰腺癌等多种肿瘤的研究中发现[5-8],P57KIP2表达下降与肿瘤发生、发展及分化相关。本研究发现,P57KIP2蛋白在胃癌中的阳性表达率明显低于非癌胃黏膜组(P<0.05),表明在胃癌组织中存在明显的P57KIP2蛋白表达下降,提示P57KIP2蛋白的低表达可能与胃癌的发生有关。这与Shin等人的报道一致[9]。在胃癌发生过程中可能由于p57KIP2基因的失活导致其蛋白表达缺失,从而使细胞恶性增殖。进一步研究发现,高分化组P57KIP2蛋白阳性表达率明显高于低分化组(P<0.05),表明P57KIP2蛋白与胃癌的分化程度有关,即胃癌分化越低,P57KIP2蛋白表达越少。而Reid 等[10]研究发现,P57KIP2蛋白阳性细胞绝大部分为终末期分化细胞,说明P57KIP2蛋白在细胞增殖及分化中有重要作用,P57KIP2可能参与了癌细胞分化的过程,并在细胞周期转化的过程中起了调节作用。P57KIP2蛋白表达下调,可能使得肿瘤细胞失去了有效抑制,从而引起肿瘤的恶性进展。因此,若能恢复P57KIP2蛋白的正常表达,可能会抑制肿瘤的增殖、侵袭和转移,可为肿瘤的治疗提供新的途径和思路。国内学者报道[11],P57KIP2蛋白表达下降与胃癌淋巴结转移有关,推测P57KIP2蛋白低表达可能在肿瘤浸润转移中起重要作用。本研究发现,发生淋巴结转移、临床分期为Ⅲ~Ⅳ期组的P57KIP2蛋白表达低于未发生转移、临床分期为Ⅰ~Ⅱ期者,但差异无显著性意义(P>0.05),有待于扩大样本量进一步研究。
PCNA是DNA聚合酶δ的辅助蛋白,与DNA合成有密切关系,主要存在于细胞周期的G1期和S期,是反映细胞增殖活性的重要生物学指标。PCNA与恶性肿瘤的增长活性、转移及预后有密切关系,是评价恶性肿瘤增殖活性和预后判断的一个重要指标[12]。本实验发现,胃癌组PCNA阳性表达率明显高于非癌胃黏膜组,而且PCNA与胃癌的分化程度明显相关,低分化及粘液癌组PCNA表达明显高于高中分化组(P<0.05)。发生淋巴结转移、临床分期为Ⅲ~Ⅳ期组PCNA表达高于未发生转移、临床分期为Ⅰ~Ⅱ期者,而统计学分析无显著相关性。以上结果提示,PCNA可客观地反映胃癌组织的分化程度。胃癌分化越差,PCNA表达越强,肿瘤细胞的增殖活性越高、肿瘤的恶性程度越高。
P57KIP2蛋白表达降低、PCNA表达增高参与胃癌的发生,联合检测P57KIP2、PCNA蛋白的表达有助于胃癌发生及恶性程度的判定。但P57KIP2蛋白在胃癌组织中表达降低的机制还需进一步研究。
[1] Hanahan D,Weinberg RA.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[2] Sherr CJ.Cancer cell cycles[J].Science,1996,274:1672-1677.
[3] Lee M-H,Reynisdottir I,Massague J.Cloning of p57KIP2,a cyclin-dependent kinase inhibitor with unique domain structure and tissue distribution[J].Genes Dev,1995,9: 639-649.
[4] Pateras IS,Apostolopoulou K,Niforou K,et al.p57KIP2:“Kip”ing the cell under control[J].Mol Cancer Res,2009,7(12):1902-1919.
[5] Nakai S,Maszki T,Shiratori Y,et al.Expression of p57KIP2in hepatocellular carcinoma:relationship between tumor differentiation and patient survival[J].Int J Oncol,2002,20(4):769-775.
[6] 赵继智,章宗籍,申丽娟,等.肝癌组织中p57kip2基因表达缺失与甲基化的关系[J].中华肝脏病杂志,2009,17(9):703-704.
[7] Sato N,Matsubayashi H,Abe T,et al.Epigenetic down-regulation of CDKN1C/p57KIP2in pancreatic ductal neoplasms identified by gene expression profiling[J].Clin Cancer Res,2005,11(13):4681-4688.
[8] Larson PS,Schlechter BL,King CL,et al.CDKN1C/p57KIP2is a candidate tumor suppressor gene in human breast cancer[J].BMC Cancer,2008,8:68.
[9] Shin JY,Kim HS,Park J,et al.Mechanism for inactivation of the KIP family cyclin-dependent kinase inhibitiorgenes in gastric cancer cell[J].Cancer Res,2000,60 (2):262-265.
[10] Reid LH,Cridermiller SJ,West A,et al.Genomic organization of the human p57KIP2gene and its analysis in the G401 Wilms tumor assay [J].Cancer Res,1996,56 (6):1214-1218.
[11] 张娜,熊永炎.P57KIP2、IGFⅡ、Cyclin E和Caspase-3蛋白在胃腺癌中的表达及其相关性研究[J].武汉大学学报(医学版),2007,28 (1):36-39.
[12] Bantis A,Giannopoulos A,Gonidi M,et al.Expression of p120,Ki-67and PCNA as proliferation biomarkers in imprint smears of prostate carcinoma and their prognostic value[J].Cytopathology,2004,15(1):25-31.
