头颈部鳞状细胞癌细胞系染色体核型的检测和分析
2010-01-26徐尔东杜翠萍姚艺文翟立杰
吕 梅,徐尔东,杜翠萍,姚艺文,翟立杰
(大连医科大学 附属第一医院 耳鼻咽喉科,辽宁 大连 116011)
头颈部肿瘤是国际上发病率最高的癌症之一。据WHO统计,其发生率位居世界第6位,在亚洲国家发生率最高,在北欧相对较低。而95%头颈部恶性肿瘤来源于上皮层,即鳞状细胞癌。它们主要分布于1)上呼吸道,包括鼻腔、副鼻窦、鼻咽部及喉部;2)口腔和下咽部。其他头颈部的恶性肿瘤则主要来源于大、小涎腺[1]。由于组织病理学的一致性,人们往往一起研究及总结这些肿瘤的遗传学规律。
有关头颈部鳞状上皮细胞癌的细胞遗传学研究表明,其染色体畸变的类型不同于像血液肿瘤所表现的简单、特异性、平衡性的染色体重排;主要表现为复杂、多倍体的、非平衡性的染色体重排,然而其畸变的规律却是非任意性的[2]。本实验对18个来源于头颈部不同位置的鳞状细胞癌细胞系进行细胞培养,收集分裂中期细胞,进行染色体“G”带染色,分析核型,并与以往的研究结果进行对照总结,进一步探讨头颈部鳞状细胞癌的染色体变异规律。
1 材料和方法
1.1 实验对象
18例头颈部鳞状细胞癌细胞系(来源于鼻腔、鼻窦5例,鼻咽部3例,口腔部4例,喉部6例)由香港大学解剖教研室Sai-Wah Tsao教授赠给。
2例下鼻甲黏膜上皮(来自鼻整形病人),1例鼻咽部黏膜上皮(来自鼻咽癌患者正常侧活检),1例癌旁组织(来自喉癌患者)短期传代(≤4代)细胞培养作为阴性对照,临床标本均来自大连医科大学附属一院。
1.2 细胞培养
头颈部鳞状细胞癌细胞系在RPMI 1640培养液(含10%小牛血清,100 IU/mL青霉素,0.2 mg/mL链霉素和2.5 μg/mL二性霉素)中培养。正常对照上皮组织剪碎后,经180 U/mL胶原酶Ⅱ,37 ℃孵育过夜;然后放入胶原包被的培养瓶中培养。其培养液为角化细胞培养液(含0.23 mg/mL的L-谷酰胺,100 IU/mL青霉素,0.2 mg/mL链霉素,和2.5 μg/mL二性霉素)。细胞大体生长状态是在倒置显微镜下观察。
1.3 分裂中期细胞染色体“G”带染色
培养细胞在收获之前,培养液中加入秋水仙碱(0.01 μg/mL)作用12 h,0.25%的胰蛋白酶-EDTA消化细胞脱壁。0.06 M KCl低渗处理细胞35 min,再由固定液(甲醇∶冰乙酸=3∶1)固定。将3~4滴细胞悬液滴于一张浸于4 ℃水中备用载玻片上,60 ℃烘烤过夜。然后将玻片浸于2×SSC中,60 ℃作用3 h。最后赖特氏染液(BDH Burr)作用1 min 30 s。
1.4 细胞染色体核型分析
100倍光学显微镜下找到分裂中期细胞,拍摄分散的染色体。利用细胞遗传学影像分析软件(Newcatlte,UK)编排染色体,根据国际人类细胞遗传学命名法(ISCN1995)标准描述细胞染色体核型。
2 结 果
4例对照组上皮细胞均表现为人正常染色体核型(图1)。18例头颈部鳞状细胞癌细胞系核型主要表现为大量复杂的、不平衡性结构重排和染色体数目的改变(图2)。但这种畸变并不是随机的,而是有规律可循的。
2.1 染色体成分/数目的改变
与每个细胞系染色体所接近的整倍体数目比较,主要表现为染色体成分/数目的丢失(15例,83%)。
2.2 染色体/臂成分的失衡
染色体/臂成分的丢失主要表现为:2q,3p,4,8p,9p,13,14,15,17,18,21,22;染色体/臂成分的增加主要表现为:3q,7,8q,11q13,20 (表1)。
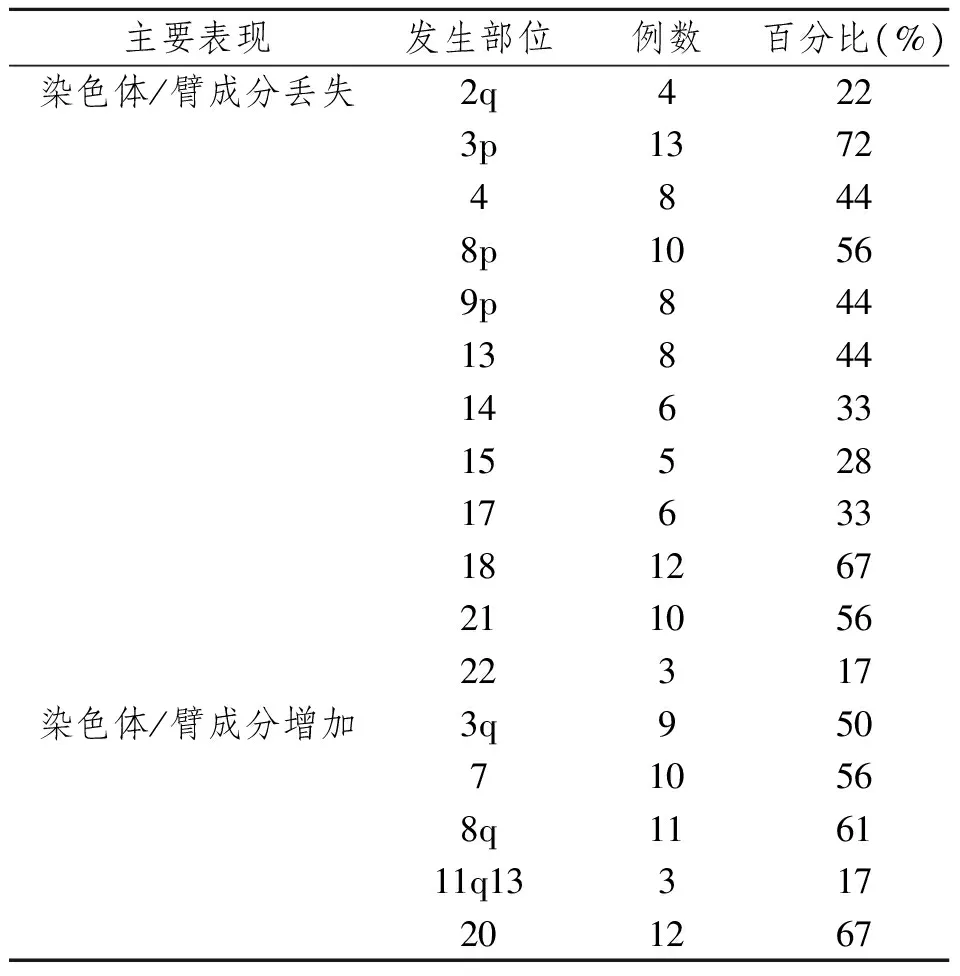
表1 18例头颈部鳞状细胞癌细胞系染色体/臂成分的失衡主要表现Tab 1 Chromosomal imbalances in 18 cases of HNSCC cell lines
2.3 染色体断裂点部位
大量的染色体断裂点位于着丝粒区域,347个断裂点中含位于中心体区域的断裂点208个(58%)。本实验断裂点出现在着丝粒区域,即断裂点出现在着丝粒带p10和q10;或近着丝粒带p11和q11,主要表现为等臂染色体形成,整条染色体臂的易位和丢失;常常涉及到的断裂点主要有1p11-q11,3p11-q11,5p11-q11,7p11-q11,8p11-q11,14p11-q11 (表2)。
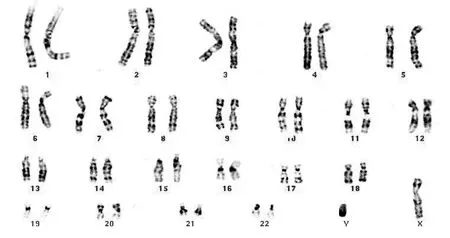
图1 正常对照组细胞染色体为人正常有核细胞染色体核型(×1000)Fig 1 The cellular chromosomes of normal control group showed normal human chromosome karyotype(×1000)

90-101,XXXX,+X,del(X)(p11),del(1)(q31),+der(1)t(1;4)(q11;q11),der(3)t(1;3) (p13;q11) hsr(1;3)(p13;q11) ×2,-4,+6,+7,+7,+9,der(11) add(11) (q13) hsr(11)(q13),-13,-13,-14,?add(14)(q32),-18,-21,-22,mar1,mar2
图2-1 喉鳞状细胞癌
Fig 2-1 Laryngeal squamous cell carcinoma
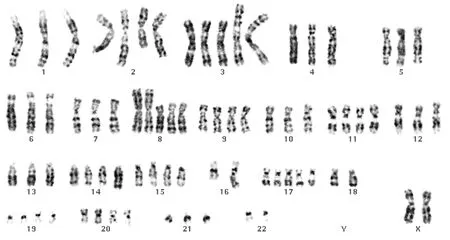
71-81,XX,-Y,+2,t (2;16)(q33;q24),i(3)(q10) ×2,der(3)t(3;7)(p25;q11) ×2,-4,+ i(8)(q10) ×2,+9,+11,+dup(14)(q22q23),+15,+17,-18,+20,+21
图2-2 舌鳞状细胞
Fig 2-2 Glossal squamous cell carcinoma
图2 HNSCC组具有代表性染色体畸变的核型(×1000)
Fig 2 The representative chromosomal karyotype of HNSCC cell lines(×1000)

表2 18例头颈部鳞状细胞癌细胞系染色体着丝粒区域断裂点Tab 2 Chromosomal breakpoints at centromeric regions in 18 cases of HNSCC cell lines
3 讨 论
肿瘤的发生、发展演变过程同时也是基因组不断变化的积累过程。癌基因和抑癌基因是与肿瘤形成密切相关的两类效应基因。癌基因的前体是原癌基因,原癌基因具有调控细胞正常生长和分化的能力。癌基因的激活主要是通过原癌基因的点突变、病毒插入、染色体异位及基因扩增等引起,并将导致细胞无限制的增殖。抑癌基因主要抑制细胞生长、促进细胞死亡。当抑癌基因在突变、缺失、部分或全部染色体丢失的情况下失活后,也会导致细胞的增殖[3]。因此,癌基因活化及抑癌基因失活的逐渐积累促进了肿瘤的恶性发展。而染色体增加、丢失、断裂、重组的过程直接导致了基因组的变异。
在本实验研究中发现头颈部鳞状细胞癌细胞内部分染色体成分扩增,部分染色体成分缺失。这实际上在基因量变上确定了癌基因的激活和扩增,抑癌基因的抑制及缺失。虽然某些机制尚不完全清楚,本文仅以以下已证实了的在头颈部鳞状细胞癌发生机制中起重要作用的基因变化,探讨染色体改变、基因变异及肿瘤发生的辩证关系。
c-myc癌基因定位于染色体8q24带。基因c-myc编码的转录因子通过与生长调节因子内特异DNA序列结合而促进其表达,进而促进细胞的生长、分化。同时研究证明c-myc蛋白又可作用于端粒逆转录酶,促进其表达并增强其酶的活性,间接抑制细胞的衰老及死亡[4]。染色体8q增多,导致c-myc基因的扩增及其所编码蛋白的过度表达,这对肿瘤的形成具有重要作用。大量研究报道8q增多/c-myc基因的扩增与头颈部恶性肿瘤的转移和复发具有明显正相关性。
Hsr(均染区)作为染色体内基因扩增的细胞遗传学标志在本研究中多次出现,并且经常定位于11q13。以往头颈部肿瘤荧光原位杂交研究证实,许多非定位于11q13的hsr的基因序列来源于染色体11q13带[5]。癌基因CCND1定位于11q13,CCND1作为一细胞周期调节蛋白,调节细胞周期从G1期过渡到S期[6]。过度表达CCND1可导致细胞周期G1期的缩短,缩短了基因检测系统对错误DNA序列的修复时间,以致未修复异常基因的逐渐积累,以及带有错误基因细胞的不断分裂和扩增。
9p染色体片段的丢失是头颈部磷状细胞癌最常见的遗传学改变之一。基因P16/CDKN2A定位于9p21-22区域。CDKN2A基因编码G1细胞周期依赖激酶(Cdks)抑制剂,其通过与Cdks蛋白结合,及抑制pRB(视网膜母细胞瘤)蛋白磷酸化,延长细胞周期G1期基因检测修复阶段,阻止进入S期。CDKN2A基因失活必将导致细胞检测系统及细胞增殖的失调[7]。
3P的缺失是头颈部磷状细胞癌染色体最早期改变之一。已发现定位于3p的抑癌基因为FHIT基因。其基因的变异和蛋白功能的失调常发现于早期的头颈部磷状细胞癌和癌前病变的研究中[8,9]。
视网膜母细胞瘤基因——RB基因在调节细胞周期以及细胞分化的过程中起关键的作用。该基因定位于染色体的13q。低磷酸化RB蛋白作为其活化形式,与转录因子E2F家族蛋白结合,发挥阻止转录因子DNA合成和促进细胞分裂的功能。G1晚期,RB蛋白被细胞周期依赖激酶磷酸化,释放E2F转录因子,促使细胞进入S期[10]。染色体13q丢失、RB基因低表达与肿瘤的高恶性度和不良预后密切相关。
本实验研究中,染色体丢失的机率明显高于染色体成分、数目的增加,这说明抑癌基因的功能失调在头颈部鳞状细胞癌发生机制中起相对主要的作用。
另一方面,大量的染色体断裂点出现在着丝粒区域是头颈部鳞状细胞癌的一特殊细胞遗传学改变。一种可能的原因是该区域的基因在染色体断裂时所引起的活化或缺失,是头颈部鳞状细胞癌肿瘤形成的致病因素之一。研究证明,近着丝粒区域的DNA在CpG岛区的甲基化程度明显高于其他区域的DNA。应用甲基转移酶抑制剂5-氮胞甘可引起染色体着丝粒区域的断裂,促进姐妹染色单体的互换、核内复制及染色体臂的易位[11]。因此,虽然染色体某些部位基因CpG岛区的过度甲基化可以抑制某些抑癌基因的作用,但着丝粒区域基因的去甲基化又可促进染色体结构的不稳定性。
头颈部鳞状细胞癌细胞遗传学的研究使大家认识到,头颈部鳞状细胞癌染色体畸变是非任意性的,是有一定规律可循的。染色体数目、结构的不断变异可能造成癌基因扩增、活化,抑癌基因的抑制和缺失;这种多基因改变的不断积累贯穿着肿瘤发生、发展的全部过程。对于头颈部鳞状细胞癌染色体畸变规律的研究和认识,将对头颈部肿瘤的诊断、预后,以及指导临床治疗具有重要意义。
[1] Parkin DM,LääräE,Muir CS.Estimates of the worldwide frequency of sixteen major cancers in 1980[J].Int J Cancer,1988,41:184-197.
[2] Allegra E,Baudi F,La Boria A,et al.Multiple head and neck tumours and their genetic relationship[J].Acta Otorhinolaryngol Ital,2009,29(5):237-241.
[3] Goddard AD,Solomon E.Genetic aspects of cancer[J].Advances in Human Genetics,1993:321-376.
[4] Solé X,Hernández P,de Heredia ML,et al.Genetic and genomic analysis modeling of germline c-MYC overexpression and cancer susceptibility[J].BMC Genomics,2008,11(9):12.
[5] Jin Y,Höglund M,Jin C,et al.FISH characterization of head and neck carcinomas reveals that amplification of band 11q13 is associated with deletion of distal 11q[J].Genes Chromosomes Cancer,1998,22:312-320.
[6] Jin Y,Jin C,Law S,et al.Cytogenetic and fluorescence in situ hybridization characterization of clonal chromosomal aberrations and CCND1 amplification in esophageal carcinomas[J].Cancer Genet Cytogenet,2004,148(1):21-28.
[7] Suzuki N,Onda T,Yamamoto N,et al.Mutation of the p16/CDKN2 gene and loss of heterozygosity in malignant mucosal melanoma and adenoid cystic carcinoma of the head and neck[J].Int J Oncol,2007,31(5):1061-1067.
[8] Virgilio L,Shuster M.FHIT gene alterations in head and neck squamous cell carcinomas[J].Proc Natl Acad Sci USA,1996,93:9770-9775.
[9] Tsui IF,Rosin MP,Zhang L,et al.Multiple aberrations of chromosome 3p detected in oral premalignant lesions[J].Cancer Prev Res (Phila Pa),2008,1(6):424-429.
[10] Viallard JF,Lacombe F,Belloc F,et al.Molecular mechanisms controlling the cell cycle:fundamental aspects and implications for oncology[J].Cancer Radiother,2001,5(2):109-129.
[11] Hoque MO,Prencipe M,Poeta ML,et al.Changes in CpG islands promoter methylation patterns during ductal breast carcinoma progression[J].Cancer Epidemiol Biomarkers Prev,2009,18(10):2694-2700.
