上海部分地区儿童艰难梭菌相关性腹泻的临床分析
2010-01-26冯云王传清金嘉琳张文宏
冯云,王传清,金嘉琳,张文宏
1. 复旦大学附属华山医院感染科,上海 200040; 2. 复旦大学附属儿科医院细菌室,上海 201102
艰难梭菌相关性腹泻(Clostridiumdifficile-associated diarrhea,CDAD)是指粪便艰难梭菌毒素检测阳性、有腹泻或血便等临床症状的疾病[1]。20世纪末,艰难梭菌感染率在美国仍然保持平稳状态(每10万人中30~40例);但21世纪初以来,感染率迅速上升(至2005年每10万人中84例),尤其是严重感染者急剧增加。加拿大2003年艰难梭菌感染率较以前增长了3倍多,且病死率高达6.9%[2]。美国得克萨斯州2005年CDAD死亡例数是1999年的6倍,医院内CDAD相关死亡例数增加了4.5倍,护理院则增加了7倍[3]。而美国2001~2006年对住院儿童CDAD监测显示其发病率也显著升高[4]。艰难梭菌可造成一系列疾病,从自限性腹泻到危及生命的败血症、结肠穿孔、中毒性巨结肠等[5],严重感染者的结局可能是肠道切除,甚至死亡[2]。但我国对CDAD的研究较少,近年来无明确的感染率数据[6]。复旦大学附属华山医院曾在腹泻患者中进行了1年的CDAD监测,但未发现高毒力艰难梭菌菌株的存在[7]。发生CDAD的危险人群主要是长期应用抗生素者,尤其是年老、体弱的住院患者,儿童并不是艰难梭菌感染的危险人群。但最近数据显示,儿童及无抗生素应用史者中CDAD病例数开始增多[8,9]。为了解我国腹泻患儿中艰难梭菌的感染情况,本文对复旦大学附属儿科医院2007年2~9月腹泻患儿的粪便标本进行了艰难梭菌肠道感染的监测,并对数据进行了分析。
1 材料和方法
1.1 材料
纳入标准:有腹泻或血便症状、留取标本前30 d内有抗生素使用史、年龄<14岁患儿的粪便样本。排除标准:确诊其他病原体引起的腹泻。根据以上标准,共入选111例。
1.2 方法
1.2.1送检标本的粪常规镜检用基于酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)的VIDAS CDA2试剂盒(bioMerieux S.A.,法国)检测粪便艰难梭菌毒素A,并做艰难梭菌粪便厌氧培养。所有患儿基本情况见表1。
表1病例基本情况
Tab.1Basicinformationoftherecruitedcases
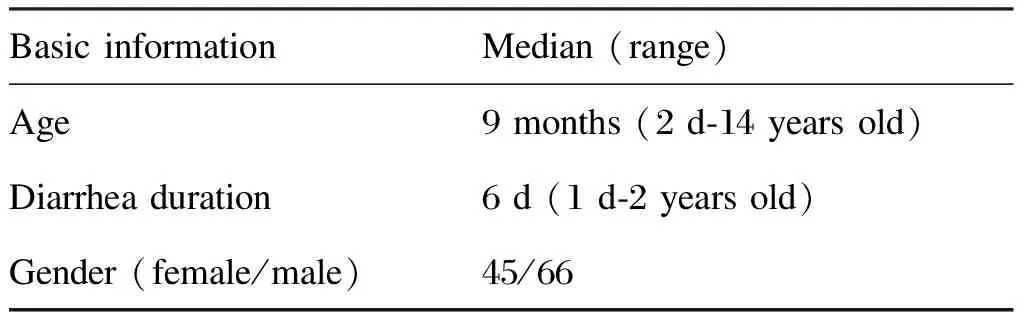
Basic informationMedian (range)Age9 months (2 d-14 years old)Diarrhea duration6 d (1 d-2 years old)Gender (female/male)45/66
1.2.2分组将入院前2 d内发生腹泻的患儿分入院外腹泻组,将入院2 d后发生腹泻的患儿分入院内腹泻组;将腹泻病程2周以内定义为急性腹泻,2周~2个月定义为迁延性腹泻,2个月以上定义为慢性腹泻。比较院外腹泻组与院内腹泻组的急性、迁延性、慢性腹泻患儿中CDAD所占比例。
1.2.3同源性分析对粪便培养出的艰难梭菌,用多位点可变数目串联重复序列分析(multiple-locus variable-number tandem repeat analysis,MLVA)技术进行同源性分析。该法为用7对引物分别对7个重复片段区域(表2)进行聚合酶链反应(polymerase chain reaction,PCR)扩增。扩增条件为95 ℃ 5 min; 然后95 ℃ 1 min,48 ℃ 1 min,72 ℃ 1 min 30 s,共35个循环;最后72 ℃ 5 min[10]。PCR产物送Invitrogen公司进行测序,对测序结果进行重复片段计数。并用SPSS15.0软件中hierarchical cluster法对结果分析,与参考文献[10]中的菌株共同做成树状图,显示同源性关系。
2 结果
2.1 粪便艰难梭菌毒素A检测及培养结果
111名病例中未发现艰难梭菌毒素A检测及艰难梭菌培养均为阳性者,艰难梭菌毒素A检测阳性而艰难梭菌培养阴性者16例(即CDAD 16例),艰难梭菌毒素A检测阴性而艰难梭菌培养阳性者4例,艰难梭菌毒素A检测和艰难梭菌培养均为阴性者91例(表3)。
2.2 病例临床分析
16例CDAD患者(CDAD组)腹泻病程中位数为6.5 d,最短1 d,最长3个月;粪常规检查中,白细胞数超过5个/高倍镜视野者3例;粪便主要以黄稀便为主,另有1例为黏液脓血便,1例为柏油样黑便及黄稀便,1例为绿色稀便伴黏液脓血。在这些患者中,低出生体重早产儿3例,伴中枢神经系统感染者5例,伴呼吸系统感染者3例,伴尿路感染者2例,伴皮肤感染者2例,单纯以腹泻入院最终诊断为假膜性肠炎者1例。
表2MLVA目的VNTR片段及引物[10]
Tab.2ThetargetVNTRsequenceandprimersusedforPCR

VNTR nameRepeated motifPrimers used for PCRCD4TTGCTCCDR4F (5′-ATTAATCATATCCTACAGAACACGA-3′)CDR4R (5′-TAAAACAAATGATATAAACTGAAAAG-3′)CD5TATATTG/AGCDR5F (5′-AATTTTAAGTTAACGTTTTTCTACAT-3′)CDR5R (5′-AGCCATTTTTATCAATCCTTTCTAT-3′)CD9TAAAAGAGCDR9F (5′-TCTGGGATGTAACTAGCGACTTGT-3′)CDR9R (5′-TCTTAGGGAATTTATTGGAGGAA-3′)CD48ATAGATTCDR48F (5′-AGGAGCTTTATATGGACATTCAGGTAG-3′)CDR48R (5′-AATCTCTTTCAAACTCTTCAATCTCAAT-3′)CD49AT/AC/TTTCTCDR49F (5′-AACATATTTAGGCATTTTAGTC-3′)CDR49R (5′-GAGTATTATTTATCATTTGTGGGTATTA-3′)CD59TAAG/ATATA/GGAT/CCDR59F (5′-GTAGAAGGGGCAAATAATGAG-3′)CDR59R (5′-CCTTCTGGCTTCCTTGTAATA-3′)CD60G/ATAAA/GTAGGATG/ATAAAACDR60F (5′-GGTGCACATGCTGGTCCTG-3′)CDR60R (5′-AACGCATTAAATTTCAC-TCCTCATAC-3′)
表4院内、外CDAD发生率的比较
Tab.4ComparisonofincidenceofCDADinchildrenwithhospital-acquiredandcommunity-acquireddiarrhea
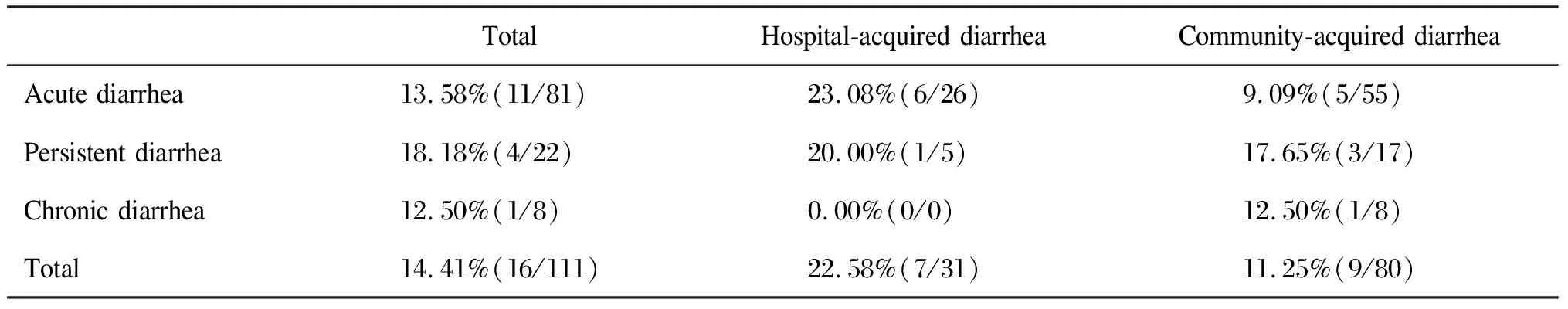
TotalHospital-acquired diarrheaCommunity-acquired diarrheaAcute diarrhea13.58%(11/81)23.08%(6/26)9.09%(5/55)Persistent diarrhea18.18%(4/22)20.00%(1/5)17.65%(3/17)Chronic diarrhea12.50%(1/8)0.00%(0/0)12.50%(1/8)Total14.41%(16/111)22.58%(7/31)11.25%(9/80)
表3粪便艰难梭菌毒素A检测及艰难梭菌培养结果
Tab.3DetectionofClostridiumdifficiletoxinAandcultureofClostridiumdifficile

Number of casesC. difficile culture (+)C. difficileculture (-)C. difficile toxin A (+)016C. difficile toxin A (-)491
The cut-off value forC.difficiletoxin A is 0.40.
比较院内、外组3种不同病程腹泻患儿中CDAD的发生率,均无显著差异(表4)。
4例粪便艰难梭菌培养阳性而艰难梭菌毒素A检测阴性的患者(非CDAD组)均为院外出现腹泻,其中3例为黄稀便,1例为黄稀便带黏液血丝。腹泻病程1~8 d。2例粪便白细胞数超过10个/高倍镜视野,另2例粪便未发现白细胞,但伴有呼吸系统感染。
91例艰难梭菌培养和艰难梭菌毒素A检测均阴性的病例无艰难梭菌感染相关证据,粪便主要以黄稀便为主,腹泻病程1 d~2年;粪常规检查中白细胞数超过5个/高倍镜视野者25例,伴其他部位感染者35例,新生儿5例(其中低出生体重早产儿2例)。
比较CDAD组与非CDAD组患儿腹泻病程、粪便白细胞计数,均无显著差异(结果未列出)。
2.3 临床治疗
16例CDAD患者中,2例加用甲硝唑治疗后腹泻好转,2例加用去甲万古霉素治疗后腹泻好转,1例低出生体重早产儿因合并新生儿坏死性肠炎而行造瘘手术治疗。其他所有患者,均用第3代头孢菌素抗感染和(或)十六角蒙脱石(思密达)、培菲康对症治疗后腹泻好转。
2.4 同源性分析
从入选患者的粪便标本中培养出4株艰难梭菌,分别为EK17、EK18、EK23和EK35,用MLVA对其同源性进行分析 (图1,图中其他菌株来自参考文献[4]中的数据),发现EK17与EK23的亲缘关系较近,与EK35略远,EK18与其余菌株的同源性最远。

图14株培养阳性艰难梭菌同源性关系树状图
Fig.1Dendrogramforthe4isolatedC.difficilestrains
3 讨论
本研究从粪便培养出4株艰难梭菌,艰难梭菌毒素A检测均为阴性。但是由于有少量毒素A阴性而毒素B阳性的艰难梭菌毒株存在,故对仅有毒素A检测阴性者虽考虑CDAD的可能性较低但尚不能完全排除。该4例培养阳性病例均为社区散发病例,急性起病,入院前2周内无住院史。腹泻治疗用药均为普通抗生素,如第3代头孢类抗生素,或用十六角蒙脱石等对症治疗,平均腹泻病程3.25 d。故结合临床,考虑该4例患儿均为不产毒艰难梭菌感染的可能性较大。对该4株艰难梭菌进行MLVA鉴定,结果发现EK17、EK23、EK35间存在一定同源性,而EK18与前3者相差甚远。目前鉴定艰难梭菌同源性的方法有很多,包括MLVA、扩增片段长度多样性分析(amplified fragment length polymorphism,AFLP)、表面蛋白A基因序列分型(surface layer protein A gene sequence typing,slpAST)、核糖分型(PCR-ribotyping)、脉冲场凝胶电泳(pulsed-field gel electrophoresis, PFGE)分型、限制性内切酶分析(restriction endonuclease analysis,REA)等。国外文献报道,这些方法均能检测出CDAD暴发菌株,但只有MLVA和REA能区别不同的CDAD暴发菌株。根据对各方法鉴定效果的评分结果,MLVA得分最高[11],其结果比较可信。根据病史及鉴定结果,可推测上海部分地区腹泻患儿发生的艰难梭菌感染是散发的,但彼此之间存在一定同源性。
在111名腹泻患儿中,14.41%(16/111)为CDAD。国外报道,用组织培养细胞毒性试验检测粪便艰难梭菌毒素,在有抗生素使用史的患者中,阳性率为9%~23%[12]。虽然两者检测手段不同,但阳性率并没有很大差异,而本研究检测艰难梭菌毒素A所用的ELISA比组织培养细胞毒性试验更简便。以前国外研究认为,CDAD主要散发或者暴发于医院、护理院和慢性病诊疗中心,而社区发生率要低很多。在医院或护理院等地,艰难梭菌的传播主要是粪-口途径,通过医疗相关工作者的接触而进行传播。患者在大量使用广谱抗生素后对CDAD易感,CDAD发生率较高[5,13]。但近年来,该认识与许多社区获得性CDAD病例的发生明显不符,且在社区进行抗生素治疗的患者中CDAD发生率亦不低[14]。本研究比较院内、外CDAD的发生率,显示急性、迁延性、慢性腹泻之间无显著差异;分别比较急性、迁延性、慢性腹泻患者中院内与院外CDAD发生率的高低,也未发现统计学差异。说明在本研究入组的患儿中,CDAD的发生与腹泻病程、院内或院外等因素无明显相关性,与以往认为CDAD病程长、好发于院内的观点有所不同。这可能与本研究病例数不够多有关,也可能与本研究病例主要为有抗生素应用史患儿有关,还可能与我国的医院管理模式不同于国外的护理院模式有关。国外研究认为,婴儿的肠道黏膜尚未成熟,艰难梭菌毒素难以与其结合,从而产生一定的保护作用[5,15]。本研究中早产儿占CDAD病例总数的18.75%(3/16),这可能也是CDAD病程没有想象中长的原因之一。
本文为回顾性研究,存在一定的局限性,包括未对粪便进行艰难梭菌毒素B检测,病史收集可能存在一定偏差,但结果可为进一步深入前瞻性研究提供一些依据。另外,本研究对培养出的艰难梭菌进行MLVA可成为今后鉴定CDAD暴发的较好手段。粪便艰难梭菌毒素A检测目前在临床应用尚不普遍,本研究中检出的阳性率较高(16/111),是诊断CDAD的重要标准之一,但未观察到该毒素的阳性结果与临床严重程度的相关性。
[1] McDonald LC, Killgore GE, Thompson A, Owen RC, Kazakova SV, Sambol SP, Johnson S, Gerding DN. An epidemic, toxin gene-variant strain of Clostridium difficile [J]. N Engl J Med, 2005, 353(23): 2433-2441.
[2] Kelly CP, LaMont JT. Clostridium difficile—More difficult than ever [J]. N Engl J Med, 2008, 359(18): 1932-1940.
[3] Salazar M, Baskin L, Garey KW, DuPont HL. Clostridium difficile-related death rates in Taxas 1999-2005 [J]. J Infect, 2009, 59(5): 303-307.
[4] Kim J, Smathers SA, Prasad P, Leckerman KH, Coffin S, Zaoutis T. Epidemiological features of Clostridium difficile-associated disease among inpatients at children’s hospital in the United States, 2001-2006 [J]. Pediatrics, 2008, 122(6): 1266-1270.
[5] Fekety R. Guidelines for the diagnosis and management of Clostridium difficile-associated diarrhea and colitis [J]. Am J Gastroenterol, 1997, 92(5): 739-750.
[6] Pokorn M, Radsel A, Cizman M, Jereb M, Karner P, Kalan G, Grosek S, Andlovic A, Rupnik M. Severe Clostridium difficile-associated disease in children [J]. Pediatric Infect Dis J, 2008, 27(10): 944-946.
[7] Huang H, Wu S, Wang M, Zhang Y, Fang H, Palmgren AC, Weintraub A, Nord CE. Clostridium difficile infections in a Shanghai hospital: antimicrobial resistance, toxin profiles and ribotypes [J]. Int J Antimicrob Agents, 2009, 33(4): 339-342.
[8] Benson L, Song X, Campos J, Singh N. Changing epidemiology of Clostridium difficile-associated disease in children [J]. Infect Control Hosp Epidemiol, 2007, 28(11): 1233-1235.
[9] Rexach CE, Tang-Feldman YJ, Cantrell MC, Cohen SH. Epidemiologic surveillance of Clostridium difficile diarrhea in a freestanding pediatric hospital and a pediatric hospital at a university medical center [J]. Diag Microbiol Infect Dis, 2006, 56(2): 109-114.
[10] Marsh JW, O’Leary MM, Shutt KA, Pasculle AW, Johnson S, Gerding DN, Muto CA, Harrison LH. Multilocus variable-number tandem-repeat analysis for investigation of Clostridium difficile transmission in hospitals [J]. J Clin Microbiol, 2006, 44(7): 2558-2566.
[11] Killgore G, Thompson A, Johnson S, Brazier J, Kuijper Ed, Pepin J, Frost EH, Savelkoul P, Nicholson Brad, Berg RJ, Kato H, Sambol SP, Zukowski W, Woods C, Limbago B, Gerding DN, McDonald LC. Comparison of seven techniques for typing international epidemic strains of Clostridium difficile: restriction endonuclease analysis, pulsed-field gel electrophoresis, PCR-ribotyping, multilocus sequence typing, multilocus variable-number tandem-repeat analysis, amplified fragment length polymorphism, and surface layer protein A gene sequence typing [J]. J Clin Microbiol, 2008, 46(2): 431-437.
[12] Klein EJ, Boster DR, Stapp JR, Wells JG, Qin X, Clause CR, Swerdlow DL, Braden CR, Tarr PI. Diarrhea etiology in a children’s hospital emergency department: a prospective cohort study [J]. Clin Infect Dis, 2006, 43(7): 807-813.
[13] 胡云建. 院内感染艰难梭菌相关性腹泻. 中国医学学报, 2008, 30(5): 618-621.
[14] Pituch H. Clostridium difficile is no longer just a nosocomial infection or an infection of adults [J]. Int J Antimicrob Agents, 2009, 33(Suppl 1): S42-S45.
[15] Deneve C, Janoir C, Poilane I, Fantinato C, Collignon A. New trends in Clostridium difficile virulence and pathogenesis [J]. Int J Antimicrobial Agents, 2009, 33(Suppl 1): S24-S28.
