热水浸提法提取黄精多糖最佳工艺研究*1
2010-01-25孙庭阁赵瑞萌
孙庭阁 赵瑞萌 张 玲
(泰山医学院生物科学系,山东 泰安 271016)
泰山黄精(PolygonatumsibiricumRed)属百合科多年生草本植物,药用部分为根茎。因其独特的生长环境和气候条件在全国多种黄精中被誉为上品[1]。本实验所用的泰山黄精为楼台黄精,又名重楼黄精或鸡头黄精,为泰山正品[2]。黄精以根茎入药,具有补气养阴、健脾、润肺、益肾之功能。临床上用于治疗脾胃虚弱、体倦乏力、口干食少、肺虚燥咳、精血不足及内热消渴等症[3]。研究表明,泰山黄精主要含多糖、低聚糖、黄精皂苷、氨基酸、黄酮及微量元素等,其中黄精多糖是黄精化学组成的一个重要部分[4]。现代药理研究表明, 黄精多糖具有多种生物学功能[5]。由于多糖不溶于60%以上乙醇,也不溶于氯仿和正丁醇,所以传统上用热水提取多糖,乙醇沉淀除去部分醇溶性杂质[6]。考虑到热水浸提多糖影响因素较多,所以本实验采用正交实验比较了不同的提取次数、提取温度、浸提时间、固液比对黄精多糖提取率的影响,以期筛选出一种高效、经济的提取方法,为实际生产提供理论依据。
1 材 料
1.1 仪器
AB265-S 61G/220电子分析天平(瑞士,梅特勒-托利多); DJ-500A电子天平( 亚太公司);旋转蒸发仪(德国BMH);UV=755B紫外-可见分光光度计(江苏省宜兴市仪器仪表总厂);离心机(上海安亭科学仪器厂);KQ-600DB数控大型超声清洗器(昆山市超声仪器有限公司);CHN-86801奥立龙酸度计。
1.2 材料与试剂
黄精采自泰山,经泰山医学院中药教研室鉴定为泰山正品鸡头黄精(PolygonatumsibiricumRed)。苯酚、浓硫酸、葡萄糖、无水乙醇、蒸馏水、氯仿、正丁醇等均为分析纯。
2 方法与结果
2.1 试剂的配制
2.1.1NaOH溶液的配制 用电子分析天平精密称取1.0000 g、2.0000 g、3.0000 g、10.0000 g固体氢氧化钠,用蒸馏水充分溶解后,置容量瓶中定容至100 ml,颠倒混匀,即得1%、2%、3%、10%NaOH溶液。
2.1.2Sevag试剂的配制 氯仿与正丁醇按1︰4比例混合即得(现用现配)。
2.1.3苯酚溶液的配制 取适量苯酚(馏分好的),取此馏分15.00 g,用蒸馏水充分溶解后,置250 ml容量瓶中, 定容至刻度,摇匀,置于棕色瓶中,冷藏备用。
2.1.4葡萄糖标准品溶液的配制 称取105℃干燥至恒重(前后两次质量差小于2 mg)的葡萄糖标准品0.1002 g, 置于100 ml 容量瓶中, 加蒸馏水溶解并稀释至刻度,摇匀,取10 ml稀释到50 ml作为标准使用液备用。
2.2 标准曲线的绘制
精密量取上述配制好的葡萄糖标准溶液0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8 ml,分别置于10 ml具塞试管中,依次加蒸馏水使其总体积均达到2 ml, 然后依次加入6% 苯酚溶液1.0 ml,充分混匀, 迅速加入5.0 ml 浓硫酸(加浓硫酸时, 勿沿壁加入, 应将移液管口悬于试管口, 使浓硫酸垂直冲入液面),混匀,放置5 min,沸水浴加热15 min,取出后冷却至室温。另以2.0 ml蒸馏水作为空白对照,所有操作均与上述相同,测定490 nm 下吸光度。以吸光度为纵坐标, 葡萄糖浓度为横坐标, 绘制标准曲线,得回归方程:A = 0.0136C, R2=0.9842。
2.3 黄精多糖的提取工艺流程
鲜黄精根块洗净烘干至恒重后粉碎,分别过20,60,100目筛→加入适量蒸馏水→适宜温度提取两次→合并提取液→过滤→离心→旋转蒸发浓缩→Sevag试剂脱蛋白→活性炭脱色→浓缩→乙醇沉淀→洗涤沉淀→真空干燥黄精多糖。
2.4 换算因子的测定
准确称取已干燥至恒重的自制黄精多糖0.1000 g,置于50 ml干净烧杯中,用少量蒸馏水溶解,完全转入100 ml容量瓶中,最后用蒸馏水定容,再准确吸取该溶液1 ml于10 ml容量瓶中,蒸馏水定容,混匀用作储备液。精密移取该溶液2.0 ml,按标准曲线的方法测定吸光度,计算多糖中葡萄糖的浓度,按公式计算换算因子:F=W/(C·D)。W为多糖质量(mg),C为多糖中葡萄糖的浓度(mg/ml),D为多糖的稀释倍数。
2.5 多糖含量的测定
精密吸取黄精多糖样品溶液1 ml,按照测定葡萄糖标准溶液同样的方法测吸光度,根据标准曲线和换算因子,按下公式计算样品中多糖的百分含量:多糖含量(%)=C·D·F/W,公式中C为供试液中葡萄糖的浓度(mg/ml),D代表供试液中多糖的稀释倍数,F为换算因子,W为供试品的质量(mg)。
2.6 正交实验设计
为了选取提取黄精多糖的最佳条件,根据预实验结果,选取提取温度、热水浸提时间、固液比和提取次数4项为考察因素,各取3个水平,进行正交实验设计(43),不考虑各因素间的相互影响。因素-水平设计见表1。

表1 水提醇析法提取黄精多糖的正交实验表
2.7 回收率测定
精密称取黄精干粉三份,每份5 g,依次加入10、20、30 mg葡萄糖,按照上述筛选的最佳条件提取多糖,并按照测定标准葡萄糖溶液的方法测定多糖含量,根据公式计算加标回收率:P=(Xi-X0)/m×100%,公式中P为加入的标准物质的回收率,m为加入标准物质的量,Xi为加标样品的测定值,X0为未知样品的测定值。计算得平均回收率97.5%,RSD为2.07%。
2.8 显色稳定性测定
取黄精多糖供试溶液, 依法显色后, 在30、60、90、120 min测定其吸光度,结果表明,在120 min内测定,多糖溶液显色稳定,吸光度变化不大。
2.9 正交实验提取黄精多糖的测定结果 见表2。
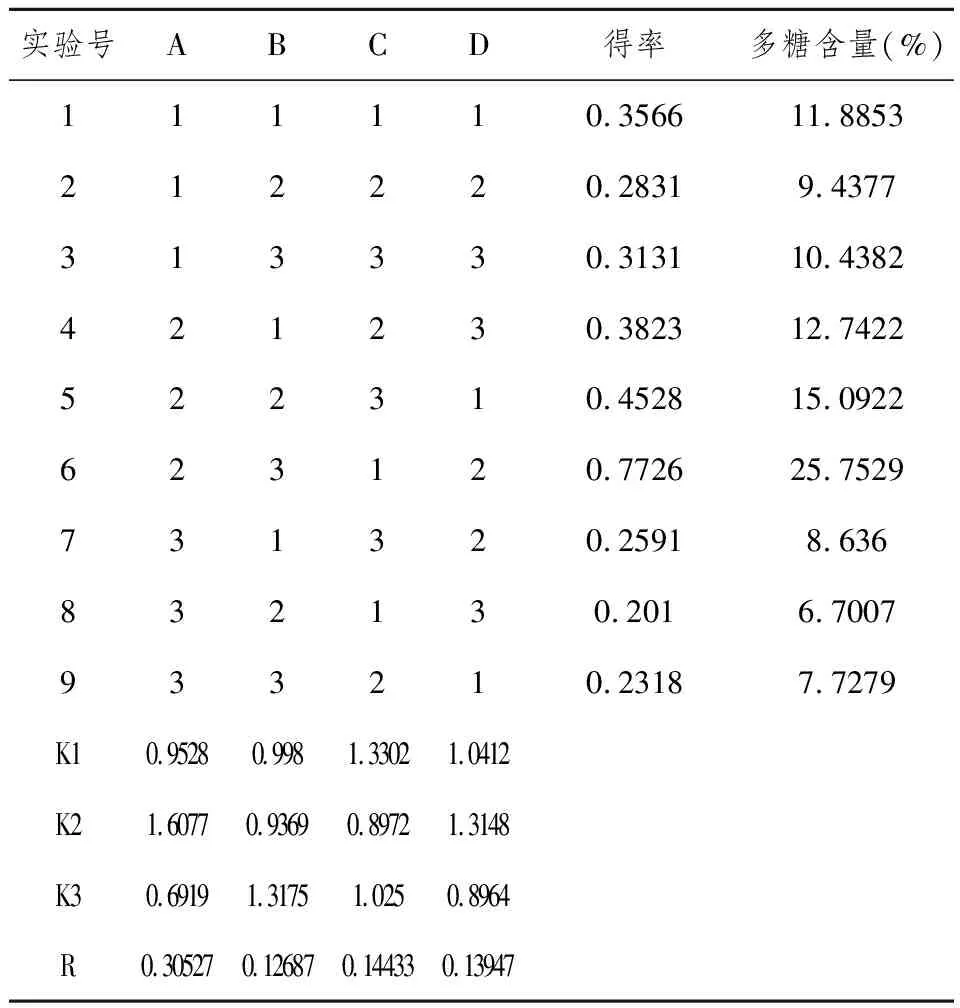
表2 正交实验提取黄精的测定结果
注:因素主次顺序为ACDB,最佳条件为A2B3C1D2
从表2的直观分析可以看出,极值R反应了4个因素对多糖提取含量的影响RA>RC>RD>RB,即热水浸提黄精多糖的因素主次关系为ACDB,最佳条件为A2B3C1D2。即因素主次关系:提取温度>料液比>提取次数>时间,最佳条件为温度80℃,时间120 min, 料液比1︰15, 提取次数2次。
3 讨 论
热水浸提是提取分离黄精多糖的传统方法, 其影响因素较多,主要有提取时间、水提温度、提取次数及固液比等,正交实验结果表明,热水温度和固液比是影响水提醇析法提取黄精多糖的主要因素,分别达到了显著性水平,提取时间影响相对较小,即因素主次关系:提取温度>固液比>提取次数>提取时间。在本实验条件下,热水浸提黄精多糖的最佳条件为温度80℃,时间120 min, 料液比1︰15, 提取次数2次。
[1] 李元富,张义涛,刘道富.泰山药用植物[M].中国医药科技出版社,1996,(10):245.
[2] 毕研文,宫俊华,杨永恒.泰山黄精药用价值和栽培技术[J].安徽农学通报,2006,12(8):86-87.
[3] 国家药典委员会.中国药典2000年版(一部)[S].北京:化学工业出版社, 2000:252.
[4] 中华本草编委会.中华本草第八卷[M].上海:上海科技出版社, 1999:142.
[5] 石林, 蒙义文,李伟.黄精及黄精多糖的药理研究[J].天然产物研究与开发,1999.11(3): 67-71.
[6] 杨文远,郭伟,王天勇.宁夏黄精中黄精多糖的分离提取和测定[J].宁夏大学学报,1997,18 (2):359-360.
