三叉神经痛慢性缩窄环术大鼠动物模型建立的研究*
2010-01-25王延秀
王延秀
(泰山医学院附属泰山医院麻醉科,山东 泰安 271000)
三叉神经痛(Trigeminalneuralgia,TN)是累及面部三叉神经一支或多支感觉分布区的反复发作的阵发性剧烈疼痛,其病因和发病机制目前仍不明确,为了进一步明确三叉神经痛的发病机制,以及探讨更好的治疗方法,我们应用大鼠三叉神经分支眶下神经(infraorbital nerve,ION)慢性缩窄环术(chronic constriction injury,CCI),建立大鼠三叉神经模型,观察其效果。
1 材料和方法
1.1 主要设备
机械阈值测试器:由美国北海岸医疗有限公司制造,刺激强度分为0.16,0.4,0.6,1.0,1.4,2.0,4.0,6.0,8.0,10.0,15.0,26.0 g。
1.2 实验动物和分组
成年雄性Wister大鼠, (山东医科大学实验动物中心提供),200~250g/只。健康活泼者入选。共20只,根据随机区组原则分为两组,手术组:进行右侧三叉神经的ION环扎术;对照组:进行右侧三叉神经的ION假手术,即只分离眶下神经而不进行环扎。
1.3 动物模型的建立
大鼠以2%戊巴比妥钠腹腔注射(按0.23 ml/100 g比例)全身麻醉满意后, 俯卧位固定于木板上, 左侧面部为实验侧,常规消毒后,沿大鼠面鼻沟向上下方向作一纵行切口,约l cm长,逐层钝性剥离,直至暴露ION,分离周围组织,用两根5.0医用肠铬线疏松结扎,两线相距2 mm,结扎松紧度以仅减少ION的直径(肉眼或显微镜下),使其延迟神经传导,但不能完全阻滞其传导,且血液循环必须通畅,术后用3.0丝线缝合切口。所有操作均在无菌条件下进行。术前术后无需应用抗生素。
1.4 观察项目
记录大鼠术前及术后1、2、3、4、6、8、10、12周的机械刺激阈值及行为反应。方法:同适应性训练,但刺激强度需由小至大,当鼠出现以下任何一种行为学变化时,记录所使用的强度,该强度即为其疼痛阈值(根据1999年Juhana J[1]等制定的标准,以下行为在Vos[2]的行为反应积分系统中为最高得分,代表最大伤害行为)。(1)退缩反应;(2)逃跑或攻击行为;(3)非对称性搔脸行为;(4)如果刺激强度为26 g时,大鼠未出现以上任何一种反应,疼痛阈值定为26 g。如果刺激强度为n时大鼠所表现的行为反应不恒定,而刺激强度为n+1时恒定,则疼痛阈值为2n+1/2。
1.5 数据处理和统计学检验
两组动物机械刺激后所测疼痛阈值用平均值±标准差表示,应用SPSS13.0软件的重复测量方差分析和t检验进行数据分析,P≤0.05为具有统计学意义。
2 结 果
2.1 对照组
术前与术后比较,假手术侧与对侧比较,疼痛阈值无明显变化,波动在13.51~14.78之间,P值均大于0.05,在统计学上无差异性(见图1)。
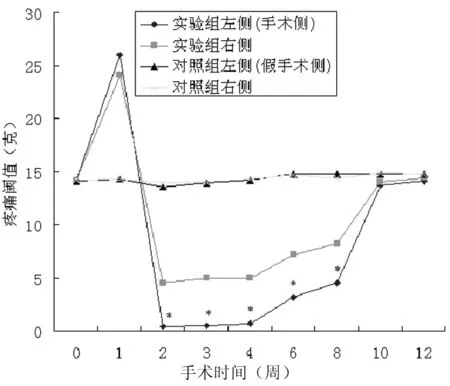
图1 两组动物术后疼痛阈值变化趋势*与术前、手术对侧及对照组比较,P<0.01
2.2 手术组同侧与对侧比较
手术侧在术后第1周,出现低反应期,疼痛阈值明显增高,26 g刺激强度几乎所有动物都无反应,从第2周开始,阈值明显下降,为0.37±0.13 g,动物表现易激惹,极低的刺激即可导致动物出现逃避、攻击或持续搔脸行为,持续至术后4周,此后阈值逐渐上升,术后10~12周恢复至术前水平。手术对侧疼痛阈值变化趋势与手术侧相似,但变化不如手术侧明显,术后第2周达高峰,阈值为4.51±0.37 g。统计学分析显示:术后第10~12周,两侧相比P值大于0.05,在统计学上无显著差异。而在术后第2~8周, 手术组同侧与对侧相比较,P值均小于0.01,在统计学上有显著差异性(见图1)。
2.3 手术组与对照组及术前相比
术前及术后10~12周,两组间左侧(手术侧及假手术侧)无明显差异(P>0.05),术后1周手术组左侧疼痛阈值(>26 g)明显高于对照组左侧及术前(14 g左右),而术后2~8周,手术组左侧阈值明显低于对照组左侧及术前(P<0.01),在统计学上有显著差异(见图1)。
3 讨 论
为了探究三叉神经痛原因,我们建立了三叉神经缩窄环术动物模型,用两根铬线将ION疏松环扎,通过观察大鼠在不同时段的行为反应及对刺激的敏感性来判断疼痛与神经压迫的关系。从目前的研究可见,术前动物需14 g左右刺激强度才出现退缩、非对称性搔脸及攻击行为,术后1周,动物出现低反应现象,最大刺激强度26 g,亦不能诱发行为反应,而从术后第2周始,在受压神经支配区域内,出现了痛觉超敏现象,极轻微的刺激(0.37±0.13 g)即可导致强烈的行为反应,动物表现咬、抓等攻击刺激物行为,手术侧与对侧、术前及对照组比较,在统计学上有显著差异(P<0.01),持续至术后4周,此后动物的痛阈及行为学反应逐渐恢复,约12周左右恢复正常,与Vos[2]等的观察基本一致。有人认为术后早期出现的对机械刺激的敏感性下降可能和有髓鞘轴突的变性有关。Kajander和Bennett[3]对坐骨神经进行环扎后发现术后早期(1~3天),Aβ和Aδ纤维受影响严重,神经冲动不能通过结扎处传导的轴突约占90%;该试验还发现术后早期,存活的有髓鞘初级传入纤维存在自发性放电现象,频率10~50 Hz,而在人类Aδ纤维释放的30 Hz电可引起感觉迟钝[4],三叉神经缩窄环术后两周对机械刺激反应明显增高则可能与神经轴突髓鞘的脱失、再生后出现的“短路或交叉兴奋”有关[5]。Guilband[6]对神经损伤与疼痛行为的时间过程进行研究发现:坐骨神经慢性环扎后第2周,轴突变性达最高峰占90%,神经开始再生,此时动物行为反应也达高峰。考虑三叉神经环扎后,可能由于神经髓鞘的脱失与再生的无规律性,神经纤维间发生也出现短路或交叉兴奋,极低的刺激通过交叉传导,即可引起兴奋迅速扩布,唤起Aδ伤害感受器的放电,从而导致痛觉过敏或超敏。另外,术后两周出现的高反应性也可能和中枢突触前或后的结构、化学、物理改变有关。至于此后动物行为逐渐恢复正常,考虑可能与肠线逐渐吸收、压迫减轻以及神经的再生恢复有关。Guilband的实验证明了这一点,他们发现环扎的神经在术后第4周开始恢复,10~12周基本恢复正常。
对于结扎对侧亦出现三叉神经痛样反应的机制目前尚不完全明确,主要学说有:①引起疼痛反应是一种“交叉兴奋”的结果[7]。②Vos等[8]认为模型大鼠之所以产生痛样反应,是与三叉神经中枢核团内与疼痛有关的P物质及抗氟化物的酸性磷酸酶免疫活性增加有关。③Benoist等[9]在1997年和1999年通过背侧丘脑和主要躯体感觉皮脂的神经电生理测定,发现结扎对侧的刺激亦导致上述神经核团内有异常生物电改变,只是严重程度较结扎侧为轻,可能的解释为慢性压迫所导致的神经干病变亦引起高位神经中枢的病变。
该模型表明压迫与神经痛存在密切关系,其成功地模拟了类似临床三叉神经受压引起的痛觉超敏现象,术式简单,行为观察直观,易掌握。目前已经成功建立的模型所涉及的部位包括三叉神经末梢、神经干、神经根、神经节及神经核。具体方法有以下几种:①用致痛物质(如苦毒素或马钱子碱)[10]或药物刺激(如青霉素G—K[11]等)三叉神经脊束核即复制三叉神经中枢致痛模型。②压迫损伤神经干[12]和神经根[13,14]致水肿,从而复制慢性压迫模型。③在动物面部注射非特异性炎性致痛物质(如福尔马林),造成实验性慢性痛觉过敏即三叉神经末梢致痛模型[15]。④大鼠牙髓灌注模型[16]。复制模型时,最常选用的动物是大鼠,其原因是大鼠的神经系统高度发达,遗传基因最接近于人类,且对镇痛药物引起的行为学反应最敏感和易观察。
本研究选择了眶下神经慢性缩窄环模型,据文献报道该模型手术暴露眶下神经的入路有口内[17]、口外鼻旁[18]和眉弓下法[19],压迫眶下神经的不同部位,其中我们在预实验中观察到口外鼻旁手术入路较为安全和简单易行,因此采用此手术入路。目前我们所建立的该模型,无一例在实验结束前死亡。当然,该模型也存在不足之处,如三叉神经环扎松紧度不易掌握,松紧的不一可造成神经纤维变性程度的不一,另外,虽然动物经过适应性训练,但其行为有时还可能出现随意性,从而影响结果的可靠性,有待进一步改善。
[1] Juhana J, Idnpn-Heikkil, Gisèle Guilbaud.Pharmacological studies on a rat model of trigeminal neuropathic pain: baclofen, but not carbamazepine, morphine or tricyclic antidepressants, attenuates the allodynia-like behaviour[J].Pain,1999,79(2-3):281-290.
[2] Vos BP, Strassman AM, Maciewicz RJ.Behavioral evidence of trigeminal neuropathic pain following chronic constriction injury to the rat's infraorbital nerve[J].J Neurosci,1994,14(5)∶2708-2723.
[3] Kajander KC,Bennett GJ.Onset of a painful peripheral neuropathy in rat:a partial and differential deafferentation and spontaneous discharge in beta and A delta primary afferent neurons[J].J Neurophysiol,1992, 1992,68(3):734-744.
[4] Bennett GJ,Xie YK.A peripheral mononeuropathy in the rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[5] Chaudhary P,Baumann TK.Expression of VPAC2 receptor and PAC1 receptor splice variants in the trigeminal ganglion of the adult rat[J].Brain Res Mol Brain Res,2002,15,104(2):137-142.
[6] Guilbaud G,Gautron M,Jazat F,et al.Time course of degeneration and regeneration of myelinated nerve fibres following chronic loose ligatures of the rat sciatic nerve:can nerve lesions be linked to the abnormal pain-related behaviours[J].Pain,1993,53(2):147-158.
[7] Devor M, Wall PD.Cross-excitation in dorsal root ganglia of nerve-injured and intact rats[J].J Neurophysiol, 1990 Dec,64(6):1733-1746.
[8] Vos BP, Maciewicz RJ.Alterations of peripheral nerve morphology and chances in fluoride resistant acid phosphatase and substance P-immunoreactivity in the trigeminal nucleus caudalis in an experimental model of trigeminal neuropathic pain[J]. Am Pain,1996,9(1):56-58.
[9] Benoist JM, Gautron M, Guilbaud G. Experimental model of trigeminal pain in the rat by constriction of one infraorbital nerve: changes in neuronal activities in the somatosensory cortices corresponding to the infraorbital nerve[J].Exp Brain Res,1999,126(3):383-398.
[10] 张冰,李小明,郭福林,等.秋水仙碱对三叉神经痛治疗作用的实验研究[J].哈尔滨医科大学学报,2003, 37(2): 150-154.
[11] 钱忠明,孙小进,何志娟.脑门下蛛网膜下腔注射微量青霉素G-K引起大白鼠三叉神经痛样反应[J].中国病理生理杂志,1986,2(2):120-122.
[12] Burchiel KJ. Abnormal impulse generation in focally demyelinated trigeminal roots[J]. J Neurosurg, 1980,53(5):674~683.
[13] Imamura Y, Kawamoto H. Characterization of heat-hyperalgesia in an experimental trigeminal neuropathy in rats[J]. Exp Brain Res,1996,116:97-103.
[14] Christensen D,Gautron M,Guilbaud G, et a1.Effect of gabapentin and lamotrigine on mechanical allodynia-like behaviour in a rat model of trigeminal neuropathic pain[J]. Pain,2001,93(2):147-153.
[15] Ng CH, Ong WY. Increased expression of gamma-aminobutyric acid transporters GAT-1 and GAT-3 in the spinal trigeminal nucleus after facial carrageenan injections[J]. Pain,2001,92(1-2):29-40.
[16] Foong FW,Satoh M,Takagi H. A newly devised reliable method for evaluating analgesic potencies of drugs on trigeminal pain[J]. J Pharmaco2 logical Methods,1982,7(4):271-278.
[17] 丁丽华,于生元.实验性三叉神经痛慢性缩窄环术动物模型的建立[J].中国疼痛医学杂志,2004,10(1):15-18.
[18] 姚天华,屠军波,张引成.脂质体阿霉素对大鼠三叉神经形态和功能影响的实验研究[J].实用口腔医学杂志,2004, 20 (4): 447-449.
[19] 周殡,刘玉光,吴承远.建立三叉神经痛动物模型[J].山东医药,2005,45(3):21-22.
