食蟹猴脑纹状体、丘脑磁共振波谱成像正常表现
2010-01-25李传福孙向东张晓明
徐 惠 李传福 孙向东 张晓明
(1. 泰山医学院,山东 泰安 271016; 2.山东大学齐鲁医院,山东 济南 250012; 3. 泰安市计量测试所,山东 泰安 271000)
非人灵长类动物与人类在组织结构、生物化学方面有诸多相似,对其进行生理功能、生化结构、病理生理等方面的研究,对认识人类的生理及疾病有重要意义。磁共振波谱成像(magnetic resonance spectrum,MRS)是利用磁共振的化学位移原理来研究正常或病理组织的生化改变和化合物定量分析的一种无创性的影像技术[1-3]。不同化合物在同一主磁场中的共振频率略有差异,即化学位移,MRS通过各种组织结构化学位移的不同来定量或者半定量地测定化合物的含量,并通过谱线来反映。作为唯一一种无创地测定化合物含量的技术,MRS近年来得到广泛应用,尤其是在人类脑、肝脏、前列腺等器官的正常生理生化及病理研究方面起到重要作用。MRS也用于实验动物研究,有关大鼠、兔的MRS的研究已有较多报道[4-9],但对非人灵长类动物进行MRS的研究相对较少。本课题通过对食蟹猴的MRS扫描,旨在探索MRS在正常非人灵长类动物实验研究中的应用,为今后各种病理状态下的MRS研究提供对照。
1 材料与方法
1.1研究对象
食蟹猴(macaca fascicularis),属于灵长目猴科,猕猴属,又名长尾猕猴、爪哇猴。本研究采用食蟹猴10只,由山东弘立医学动物实验研究有限公司提供,采购于越南,均为雄性,4~5岁,体质量4.75~5.30 kg,平均4.94 kg。六只猴均营养状态良好,精神状态正常,无神经系统病史。
1.2实验设备
山东大学齐鲁医院GE公司产Signa Excite 3. 0 T MR扫描仪,梯度场40 mT/ m ,梯度切换率150 mT/m/ms。
1.3实验方法
食蟹猴磁共振检查前4 h禁食、水。麻醉采用氯胺酮+水合氯醛联合麻醉的方法。5%氯胺酮诱导麻醉,剂量5 mg/kg,下肢肌肉注射,10%水合氯醛灌肠维持麻醉,剂量1 ml/kg。麻醉后仰卧于检查床上,头置于正交膝关节线圈内,听眦线垂直于床面,头周围用软垫充填以减少磁敏感伪影。
磁共振扫描序列包括SE-FLAIR T1序列、T2 FSE序列、MRS扫描。各序列FOV 均为14 mm。T1 FLAIR序列TR/TE:2500/9 ms,矩阵256×256,层厚3 mm,层间隔0.3 mm。T2 FSE序列TR/TE:4 600/100 ms,层厚3 mm,层间隔0.3 mm。均选用标准轴位扫描,用于MRS准确定位。
磁共振波谱扫描采用single voxel PROBE-PRESS点解析波谱成像(point resolved spectroscopy),在轴位像上分别选取双侧纹状体、丘脑感兴趣区,感兴趣区大小15 mm×15 mm×10 mm,尽量避开颅骨和脑脊液,感兴趣区周围从上、下、左、右、前、后六个方向均进行压饱和。接受/发射增益调节、体素内匀场Autoshim,由自动预扫描程序进行水抑制,当半高线宽Lnwdth<10 Hz,水抑制Supp Lvl>90时,进行MRS扫描。MRS扫描TR/TE:1500/144 ms,数据采集次数NEX 8,矩阵64×64,扫描时间3 min。每个部位扫描3次。
每个部位选择保留扫描曲线基线平稳、系统可以准确测值的数据,丢弃扫描基线不稳、系统不能准确测知全部数据的数据。每只动物均测得双侧纹状体、丘脑感兴趣区的N-天门冬氨酸(N-acetylaspartate,NAA)、肌酸(creatine,Cr)、胆碱(choline,Cho)的含量及NAA/Cr、Cho/Cr比值。
1.4统计学处理
应用SPSS13.0软件,对两种组织结构之间的参数的比较采用LSD-t检验进行,P≤0.05为差异有统计学意义。
2 结 果
2.1定位图及MRS波谱 各部位轴位定位图见图1,MRS波谱曲线图见图2。
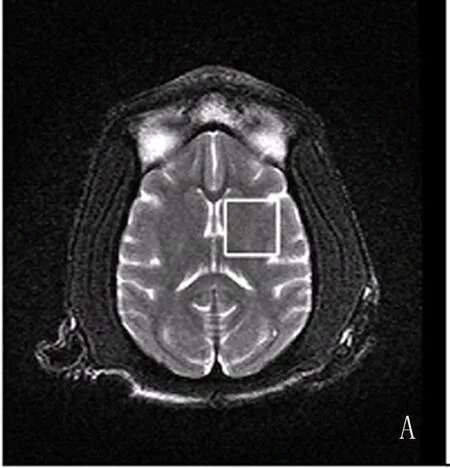
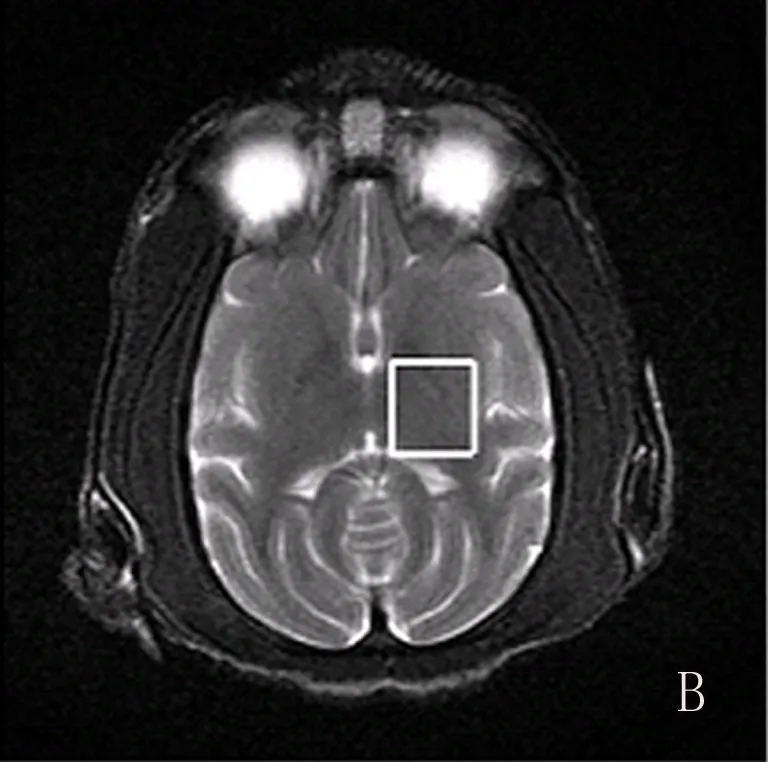
图1 食蟹猴脑各部位MRS轴位定位图


图2 食蟹猴脑各部位MRS曲线图
2.2纹状体、丘脑MRS数据比较 见表1。

表1 食蟹猴纹状体、丘脑MRS数据均值一览表
使用t检验分别进行纹状体和丘脑两种组织结构之间NAA/Cr和Cho/Cr均数的比较,结果NAA/Cr:t=7.12,P<0.05,有统计学差异;Cho/Cr:t=1.30,P>0.05,无统计学差异。认为丘脑NAA/Cr比值高于纹状体,丘脑和纹状体之间Cho/Cr比值无统计学差异。
3 讨 论
MRS曲线上3个主要的峰分别代表局部脑组织NAA、Cho和Cr的含量。NAA是哺乳动物神经系统中普遍存在的化合物之一,在脑内几乎全部位于神经元内,主要存在于神经元线粒体内,其含量多少与神经元及轴突数量有关,是公认的反应神经元功能的内标物,它的浓度多少可反映神经元的功能状况,当神经元或轴突破坏和缺失以及功能异常时,NAA浓度降低[10]。NAA的波谱共振峰位于MRS曲线2.02 ppm处。Cho包括磷酸甘油胆碱、磷酸胆碱和胆碱,反映脑内总的胆碱量,主要存在于细胞膜上,是细胞膜磷脂代谢的组成成分,其含量多少与细胞膜的合成和分解代谢有关,其浓度的改变可反映细胞密度及细胞膜合成和降解的变化。Cho在神经元和神经胶质细胞内均存在,但胶质细胞内Cho的浓度明显高于神经元,故Cho的浓度高低与神经胶质细胞含量变化密切相关[11]。Cho的波谱位于MRS曲线3.23 ppm处。Cr包括肌酸和磷酸肌酶,是能量储存和利用的重要化合物,二者是脑细胞内的一对能量缓冲系统,其总含量在同一个体脑内不同代谢条件下均保持相对稳定,一般不随病理变化而变化,常作为波谱研究的参照物,通过NAA/Cr和Cho/Cr比值反映NAA和Cho浓度的变化。Cr的波谱位于MRS曲线3.02 ppm处。
在轴位MR像上分别选取纹状体、丘脑感兴趣区,因为猴脑外形呈上下扁形,同时为保证满意的匀场和抑水效果,感兴趣区也选取上下稍扁的形状,大小15 mm×15 mm×10 mm,尽量避开颅骨和脑脊液,选取感兴趣区。
丘脑NAA/Cr及Cho/Cr比值均高于纹状体,经统计学分析,认为丘脑NAA/Cr比值高于纹状体,丘脑和纹状体之间Cho/Cr比值无统计学差异。差异与食蟹猴脑组织结构不同有关。丘脑为灰质核团,富含神经元细胞,因此NAA比值较其他脑组织高;纹状体虽然也是灰质核团,但是,内囊从各核团之间穿过,内囊为神经纤维组成,几乎不含NAA,纹状体的感兴趣区测量难免要包含内囊组织,因此降低了NAA含量,NAA/Cr比值与丘脑、小脑均有统计学差异。Cho主要存在于神经胶质细胞的细胞膜上,Cho/Cr比值与神经胶质细胞含量的多少密切相关。纹状体内神经胶质细胞含量虽然稍高于丘脑,但是差异较小,经统计学分析,Cho/Cr比值与丘脑无显著性差异。
本研究结果表明,可以在临床使用的MRI设备上对非人灵长类动物进行脑MRS的检测研究,其数据能准确反映脑组织的结构异同和含量的变化,可以作为生理、病理改变研究的依据之一。丘脑NAA/Cr比值高于纹状体,丘脑和纹状体之间Cho/Cr比值无统计学差异。
[1] Cudalbu C, Beuf O, Cavassila S. In vivo short echo time localized 1H MRS of the rat brain at 7T: Influence of two strategies of background-accommodation on the metabolite concentration estimation using QUEST[J]. Journal of Signal Processing Systems, 2009,55(1-3):25-34.
[2] Rommel D, Bol A, Abarca-Quinones J, et al. Rodent rhabdomyosarcoma: Comparison between total choline concentration at 1H-MRS and 18F-fluoromethylcholine uptake at pet using accurate methods for collecting data[J]. Molecular Imaging and Biology, 2010,29(12),415-423.
[3] McKenzie E J, Jackson M, Sun J, et al. Monitoring the development of hepatocellular carcinoma in woodchucks using 31P-MRS[J]. Magnetic Resonance Materials in Physics, Biology and Medicine, 2005,18(4): 201-205.
[4] Simes R V, Martinez-Aranda A, Martín B, et al. Preliminary characterization of an experimental breast cancer cells brain metastasis mouse model by MRI/MRS[J]. Magnetic Resonance Materials in Physics, Biology and Medicine, 2008,21(4):237-249.
[5] Zhao W D, Guan S, Zhou K R, et al. In vivo detection of metabolic changes by 1H-MRS in the DEN-induced hepatocellular carcinoma in wistar rat[J]. Journal of Cancer Research and Clinical Oncology, 2005, 131(9): 597-602.
[6] Zhu X H, Du F, Zhang N Y, et al. New opportunities for high-field in vivo MRS in studying brain bioenergetics and function[J]. Brain Imaging and Behavior, 2008,2(4):232-241.
[7] McNab J A, Yung A C, Kozlowski P. Tissue oxygen tension measurements in the Shionogi model of prostate cancer using 19F MRS and MRI[J]. Magnetic Resonance Materials in Physics, Biology and Medicine, 2004, 17(3-6):288-295.
[8] Herynek V, Ru?iˇcková K, Jendelová P, et al. Metabolic changes in the rat brain after a photochemical lesion treated by stem cell transplantation assessed by 1H MRS[J]. Magnetic Resonance Materials in Physics, Biology and Medicine, 2009,22(4):211-220.
[9] 颜荣华,肖恩华,梁斌. 1.5T磁共振兔VX2肝癌活体二维多体素1H-MRS应用初探[J]. 临床放射学杂志,2005,24(12):1097-1102.
[10] 叶静,张德胜,祁吉. 31P磁共振波谱在癫痫诊断研究的现状[J]. 国外医学:临床放射学分册, 2000,(3):129-131.
[11] 詹松华,马凤华,杨振燕,等. 急性脑梗死MRS研究模型的建立及病理学评价[J]. 实用放射学杂志, 2006,22(1):5-8.
