研析甘氨酸与二价金属离子配合物的循环伏安行为
2010-01-25廖天录王俊峰董晓宁
赵 强,廖天录,王俊峰,董晓宁
(1.甘肃工业职业技术学院 化学与环境工程系,甘肃 天水 741025;2.西北师范大学 化学化工学院,甘肃 兰州 730000;3.天水师范学院 生命科学与化学学院,甘肃 天水 741001)
循环伏安法(CV)作为一种重要的电化学分析方法,由于它仪器简单、操作方便、图谱解析直观,常被广泛的应用于电化学分析、无机化学分析、有机化学分析、生物化学分析等研究领域[1-2].本实验以小分子配体甘氨酸(Gly)和过渡金属离子M(II)(M=Zn、Cd、Co、Cu)组成的二元体系为对象,研究了各二元体系中配合物的形成及稳定性与CV图谱中特征参数之间的关系.
1 材料与方法
1.1 仪器及试剂
LK98BⅡ型微机电化学分析系统、213型铂片电极、铂盘电极(0360-Φ2)、232型饱和甘汞电极.
甘氨酸(Gly)、CuCl2、ZnCl2、CoCl2、CdCl2、KNO3、氮气等,其余均为实验所需分析纯试剂.
1.2 方法
(1)溶液的配制.待测液均定容为25.00mL,0.20mol/LKNO3做支持电解质,待测液中Gly的浓度为0.001mol/L,调节配比使Gly与金属离子之间的物质的量之比分别为1∶1、2∶1、4∶1、10∶1,再用二次去离子水定容(pH值调至4~5),摇匀、静置、待测.
(2)电极系统及处理.使用铂盘电极为工作电极,铂片电极为对电极,饱和甘汞电极(SCE)为参比电极.电化学测量工作电极表面在每次测试前在浓硝酸中浸泡30min,再用二次去离子水超声波清洗,最后将铂片电极和铂盘电极在0.3mol/L的HNO3溶液中进行电化学处理,即在-0.2~1.3V的电位范围内连续进行CV扫描[1],直至记录的CV扫描曲线重复,其实验结果见图1所示.取出电极用二次去离子水冲洗干净,用滤纸吸干水份,待用.
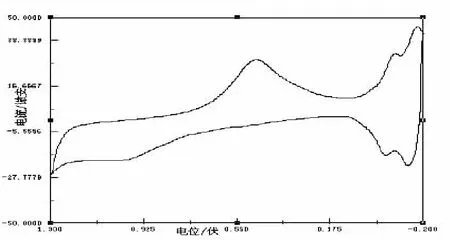
图1 电极系统在HNO3(0.3mol/L)溶液中的电活化图
(3)含金属离子溶液的CV法测定.溶液测定前均用高纯氮气除氧15min,CV法测定电位范围选在-0.2~0.5V[1-2].室温进行、仪器灵敏度为10μA、滤波参数为50Hz、放大倍率为1、电流极性还原为正、采样间隔均为0.0010V、电位增量均为0.0010V.
2 结果与讨论
2.1 配体的CV曲线
(1)支持电解质KNO3的CV曲线
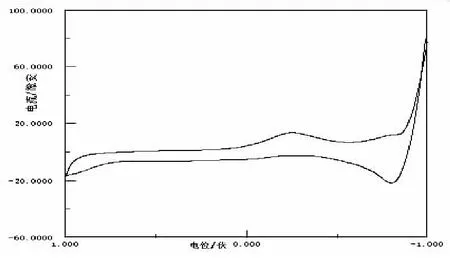
图2 KNO3溶液的CV图
图2曲线为支持电解质KNO3(CKNO3=0.2mol/L,下同)的空白CV图(未通N2的CV图与之基本重合),对于KNO3而言,在CV图中,于-1.0~1.0V电位范围内,在Epc=-0.26V处出现一还原峰,可能为H+得到电子放出H2;Epa=-0.83V处出现一氧化峰,可能为OH-时去电子产生的O2.
(2)Gly配体的CV曲线
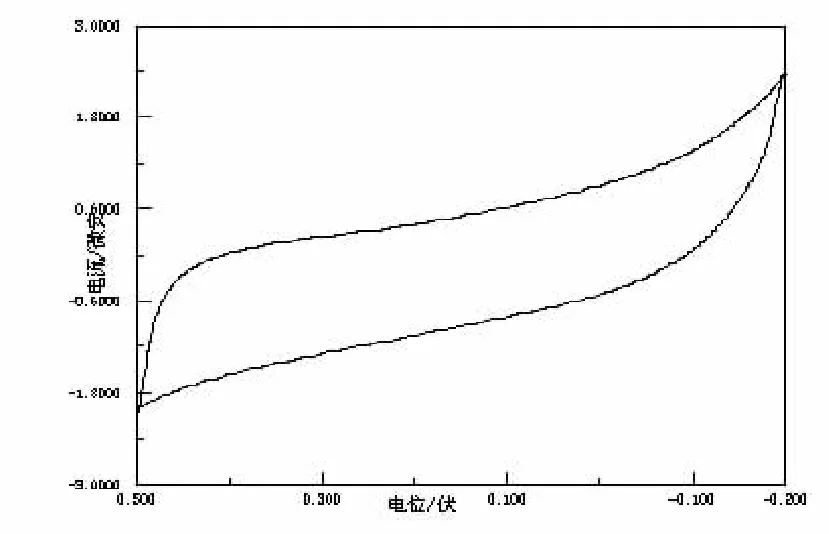
图3 Gly在KNO3溶液中的CV图
在KNO3介质中(pH=4.0),加入10mLGly(=0.001mol/L),于-0.2~0.5V的电位范围进行CV扫描,其结果见图3所示,未能观察到电极反应,说明在此电位范围内,Gly配体为非电化学活性物质.
2.2 金属离子与配体Gly的CV曲线
(1)Zn(Ⅱ)与配体Gly的CV曲线
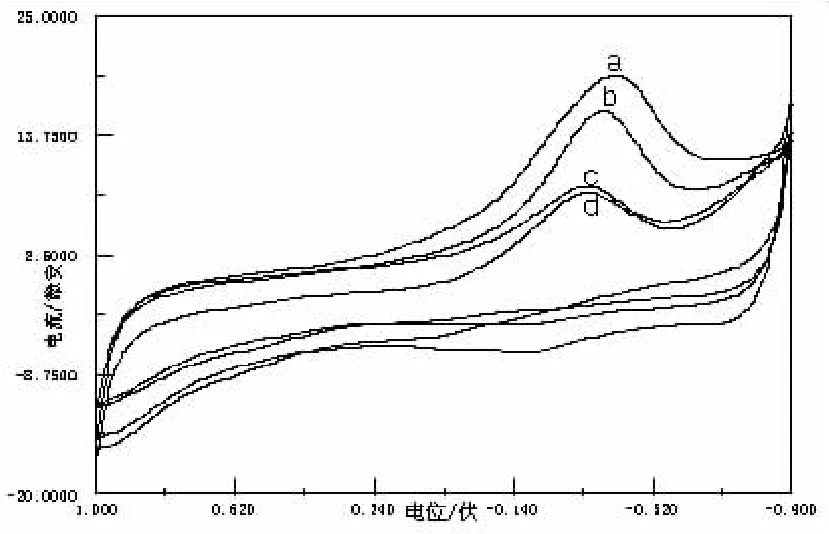
图4 Gly与不同浓度的Zn(II)的CV图
Zn(Ⅱ)与Gly可形成稳定的二元配合物Zn(Gly)2,=9.96,生成和解离的速率常数分别为5.9×107和5.1×107.由图4可以看出,在此体系中,以n(Gly)∶nZn(Ⅱ)=1∶1为例,由于Ipa(8.912μA)与Ipc(无峰)相差较大,可判断电极反应为不可逆过程,随着浓度的变化还原峰呈单峰,且比氧化峰灵敏,因此溶液中可能无Zn(Ⅱ)[4].
(2)Cd(Ⅱ)与配体Gly的CV曲线
图5为在相同参数设置下,不同浓度的Cd(Ⅱ)与Gly的CV叠加图,随着n(Gly)∶nCd(Ⅱ)的比值增大,可以看出由a到e的Ipc逐渐减小,Epc基本保持不变,这是由于体系中游离的Cd(Ⅱ)的浓度逐渐减小,使体系的电化学活性变得越来越小.说明配体Gly降低了金属离子Cd(Ⅱ)在此电位范围内的电化学活性.
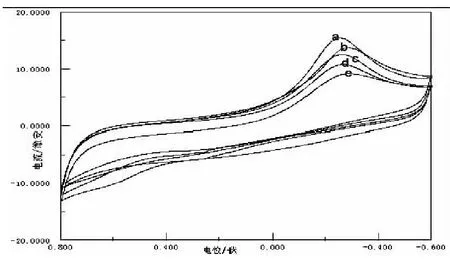
图5 Gly与不同浓度的Cd(Ⅱ)的CV图
(3)Co(Ⅱ)与配体Gly的CV曲线
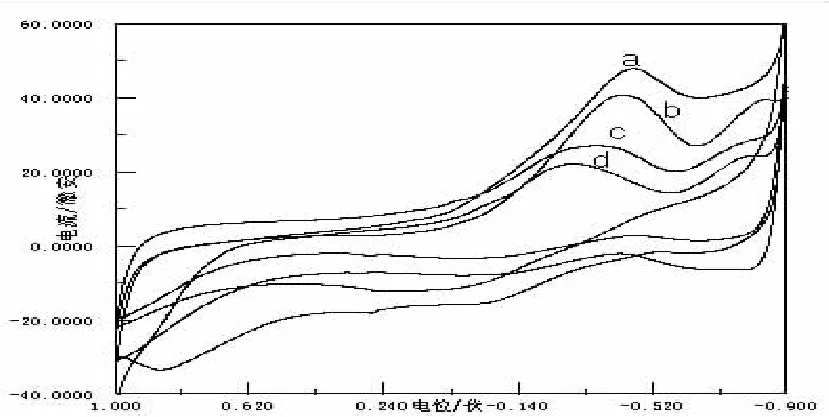
图6 Gly与不同浓度的Co(Ⅱ)的CV图
Epc=-0.18V为Co(Ⅱ)在KNO3做支持电解质时的还原峰电位.由图6观察到,随着Co(Ⅱ)浓度的逐渐减小,还原峰电位有着微弱的正移,还原峰比氧化峰灵敏;而峰电流随Co(Ⅱ)浓度的增加而有减小的趋势,这是由于体系中游离的Co(Ⅱ)的浓度逐渐减小,使体系的电化学活性变得越来越小.
(4)Cu(Ⅱ)与配体Gly的CV曲线

图7 Gly与不同浓度的Cu(Ⅱ)的CV图
随着n(Gly)﹕nCu(Ⅱ)的值越来越大,体系的电化学活性变得越来越小,图7为Gly与不同浓度的Cu(Ⅱ)的CV图,图中e为Cu(Ⅱ)的空白图,a、b、c、d分别为同一条件下n(Gly)﹕nCu(Ⅱ)=1∶1、2∶1、4∶1、10∶1的CV图,明显可以观察到无还原峰出现,氧化峰逐渐减弱,这是由于体系中游离的Cu(Ⅱ)的浓度逐渐减小,使体系的电化学活性越来越小.但a、b两峰电流十分接近,氧化峰比还原峰灵敏,在同一条件下,Cu(Ⅱ)与Gly形成的二元体系比Cu(Ⅰ)与它形成二元体系稳定,同时说明Cu(Ⅱ)配位能力强于Cu(Ⅰ).
3 结论
通过对小分子配体Gly和二价过渡金属离子M(Ⅱ)(M=Zn、Cd、Co、Cu)组成的二元体系的研究,表明该体系中CV图谱的特征参数与配合物的形成及其稳定性之间存在一定关系.比如在Gly-Cu(Ⅱ)的体系中,氧化峰比还原峰灵敏,由于在同一条件下,Cu(Ⅱ)与Gly形成的二元体系比Cu(Ⅰ)与它形成二元体系稳定[5-6].Gly与其它金属离子的体系中,还原峰比氧化峰灵敏,可能是由于M(Ⅱ)被还原为单质而造成的.
参考文献:
[1]杜俊,陆晓晶,张莉,等.铜(Ⅱ)-α-氨基酸配合物溶液在金电极上的电化学行为[J].安徽师范学学报:自然科学版,2004,27(02).
[2]马永林.循环伏安法对铜(Ⅱ)-1,10二氮杂菲配合物电化学性质的研究[J].化学研究与应用,2004,16(04):551-552.
[3]廖钫,何晓英.铜在浓碱溶液中的电化学行为研究[J].四川师范学院学报:自然科学版,1999,20(03):241-244.
[4]Shoji Harzdn, Yozo Uchida, Michinori Hiranhi[J].Inorg.Chem.1978,17(12):3371-3374.
[5]李红,巢晖,将雄,等.四种钌(Ⅱ)配合物的中心离子电化学行为的比较[J].物理化学学报,2001,17(08):728-732.
[6]董晓宁,朱元成,郭永恒,等.Cu(Ⅱ)与甘氨酸二元体系配合物的循环伏安行为探讨[J].天水师范学院学报,2006,26(02):35-38.
