速尿对小鼠螺旋神经节神经元细胞钾、钠通道电流的影响
2010-01-25邓嘉虹杨黎姜鹤群蔡春春
邓嘉虹 杨黎 姜鹤群 蔡春春
速尿是袢利尿剂的代表药物,是临床广泛应用于肾功能和心功能衰竭性水肿、早产儿和支气管、肺发育不良新生儿肺水肿的有效利尿剂。但速尿具有耳毒性,接受较大剂量速尿治疗的患者,可出现暂时性的听阈提高并伴有耳鸣和眩晕,长期使用还可出现永久性的听阈提高。目前研究认为速尿主要引起血管纹的水肿和囊性变、耳蜗内动作电位的幅度下降、抑制K+-Na+-ATP酶、引起Corti器外毛细胞的水肿等[1,2]。耳蜗螺旋神经节细胞(spiral ganglion neuron, SGN)分为两型,Ⅰ型细胞为双极神经元,与内毛细胞形成突触,其中枢突组成听神经;Ⅱ型细胞为假单极神经元,与外毛细胞形成突触。本研究利用全细胞膜片钳技术观察速尿对螺旋神经节神经元细胞钾、钠离子通道电流的影响,以便进一步了解速尿的耳毒性机制,为其耳毒性的预防和治疗提供参考。
1 材料与方法
1.1实验动物 采用出生1~6 d发育正常的昆明种乳小鼠15只30耳,雌雄不分。
1.2螺旋神经节神经元的体外分离 将小鼠耳蜗分离以后,在pH7.4的Hank’s平衡盐溶液中分离并去除骨性耳蜗部分,然后将膜性耳蜗沿螺旋缘处把外侧血管纹、Corti器去除,仅剩余内侧螺旋神经节组织,将神经组织轻柔地分离并切割,用D-Hank’s平衡盐溶液洗涤组织块。然后,用2%的胰蛋白酶对螺旋神经元组织进行酶解,在倒置相差显微镜下观察细胞贴壁满意后,用细胞外液小心置换含血清的培养液,直至细胞外液清澈,获得符合试验条件的SGN细胞(胞膜光滑、胞质透光性好、核完整、有两条突触)。
1.3溶液成分 电极内液:(mmol/L)KCl 112,MgCl22,CaCl20.1,EGTA 11,Hepes 10,用KOH调节pH值为7.4,调节渗透压为310 mmol/L,若记录钠电流则将KCl 112改为CsCl 112。 细胞外液:(mmol/L)NaCl 137,KCl 5,CaCl21.7, MgCl21,葡萄糖17,蔗糖 50,Hepes 10,用NaOH 调节pH值为7.5,调节渗透压为300 mmol/l。终止酶解用细胞培养液:90%杜伯科改良的伊格尔培养基,10%胎牛血清,pH值为7.3~7.4。延迟整流钾通道阻滞剂氯化四乙胺(TEA)的浓度为25 mmol/L,4-氨基吡啶(4-AP) 的浓度为0.15 mmol/L。钠通道阻滞剂河豚毒素(TTX)的浓度为0.05 μmol/L。速尿的细胞外给药浓度为2 500 μg/ml,灌注时间为10分钟左右。
1.4SGN细胞钾、钠离子通道电流的记录
1.4.1全细胞电压钳模式的形成和细胞外给药 采用P-97三步水平拉制仪(Sutter Instrument Co. USA)拉制硅硼玻璃微电极(厚壁、硬质,北京电子所),并在电极尖端涂布硅酮树脂和进行热抛光(MF-900电极热抛光仪),使玻璃微电极尖端直径小于1 μm,充灌电极内液后的阻抗为3~7 mΩ。在MP-285膜片钳微操纵仪(Sutter Instrument Co. USA)的推动下,让玻璃微电极尖端接触SGN细胞膜,并应用负压抽吸使电极尖端和细胞膜形成高阻封接,封接电阻在1.0 GΩ以上,对膜片造成电化学隔离。高阻封接稳定后,通过负压抽吸使吸附于电极尖端的一小片细胞膜破裂,从而形成全细胞的膜片钳记录模式。本实验采用Axopatch 200B膜片钳放大器(Axon Instruments,USA),并使用“Y管”胞外给药装置(Sutter Instrument Co. USA)进行局部细胞外微灌流给药。该给药系统能在20 ms内使目标细胞周边的外液完全被交换。
1.4.2延迟整流钾通道电流和钠通道电流记录参数的设定 延迟整流钾通道电流记录参数的设定:钳制电压(VH)为-80 mV,命令电压由-100 mV至+40 mV,步长10 mV,时程为100 ms。
钠通道电流记录参数的设定:钳制电压(VH)为-80mv,命令电压由-80 mV至+60 mV,步长10 mV,时程为100 ms。
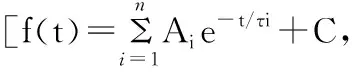
2 结果
2.1SGN的分离 通过机械分离和酶解,成功获得小鼠耳蜗螺旋神经节神经元细胞,在倒置相差显微镜下观察到Ⅰ型螺旋神经节神经元细胞胞体呈椭圆形,边缘光滑,胞质透明,呈亮白色,细胞折光性好,细胞多数有两个突起;个别细胞只有一个突起或者胞体变为类圆形,胞质不透明,胞膜欠光滑,细胞折光性差,这类细胞可能与酶解过度有关,故未纳入实验研究中。
2.2SGN细胞钾、钠离子通道电流的记录
2.2.1SGN细胞延迟整流钾电流的记录 应用全细胞膜片钳技术可以记录到钾钠混合电流图(图1)。应用加入0.05 μmol/L TTX的细胞外液,可以记录到缓慢上升、持续无衰减的外向电流,加入25 mmol/L的TEA和0.15 mmol/L的4-AP后,外向电流绝大多数被抑制,证明其为延迟整流钾电流,活化时间常数(τ)为3.30±0.59 ms(图2)。

图1 电压依赖性钾钠混合电流
2.2.2SGN细胞钠电流的记录 在加入25 mmol/L的TEA和0.15 mmol/L的4-AP的细胞外液中,应用含有CsCl的电极内液,可以基本抑制外向钾电流,试验记录到快速激活的内向离子电流。当在细胞外液中加入0.05 mmol/L的TTX后,内向电流被阻断,证明内向电流是钠通道电流。钠通道的活化发生于膜电位位于-30~ -40 mV时,至-20 mV时钠电流达到峰值,到膜电位位于+20 mV左右时产生内向电流的离子通道失活(图3)。

图2 钾通道抑制剂对钾通道的作用
上图是在细胞外液中加入TTX抑制内向钠电流后的延迟整流钾电流图,下图是在细胞外液中加入钾通道抑制剂TEA和4-AP后外向钾电流被明显抑制

图3 钠通道抑制剂对钠通道的作用
上图是在细胞外液中加入TEA和4-AP、在细胞内液中加入CsCl后外向延迟整流钾电流基本被抑制,可观察到内向钠电流;下图是在细胞外液中加入TTX后内向钠电流被完全阻滞
2.3速尿对SGN细胞钾、钠离子通道电流的作用
2.3.1速尿对SGN细胞钾离子通道电流的作用 当在细胞外液中加入0.05 μmol/L的TTX后,内向的钠电流被完全阻滞,仅剩余外向的延迟整流钾通道电流,通过Y管逐渐在细胞外液中加入2 500 μg/ml的速尿,随着细胞外液中速尿浓度的增加,钾电流幅度逐渐变小,最后一直维持在+200~+300 pA之间不再变化。然后用加入0.05 μmol/L TTX的细胞外液逐渐洗涤含速尿的细胞外液时,外向钾电流逐渐开始恢复。试验观察到在速尿对延迟整流钾通道的作用稳定后1、5、10 min时,用含TTX的细胞外液洗涤速尿,钾电流的峰电流幅值可以分别恢复到速尿作用以前的98%、64%、25%。可见,速尿对钾通道作用时间的长短与其对SGN细胞钾通道活性的损害程度呈正相关(图4)。
2.3.2速尿对SGN细胞钠离子通道电流的作用 当在细胞外液中加入25 mmol/L的TEA和0.15 mmol/L的4-AP,应用含有CsCl的电极内液后,外向的延迟整流钾电流基本被完全阻滞。通过Y管逐渐在细胞外液中加入速尿,内向钠电流随着细胞外液中速尿浓度的增加,和钾电流一样电流幅度逐渐变小,但最后钠电流的峰电流幅值基本稳定在速尿作用前峰电流幅值的30%左右,不再变化。在速尿作用稳定后的1、5、10 min时,用含TEA和4-AP的细胞外液逐渐洗涤细胞外液中的速尿,钠电流的幅值可以分别恢复到作用前的96%、76%和54%左右(图5)。
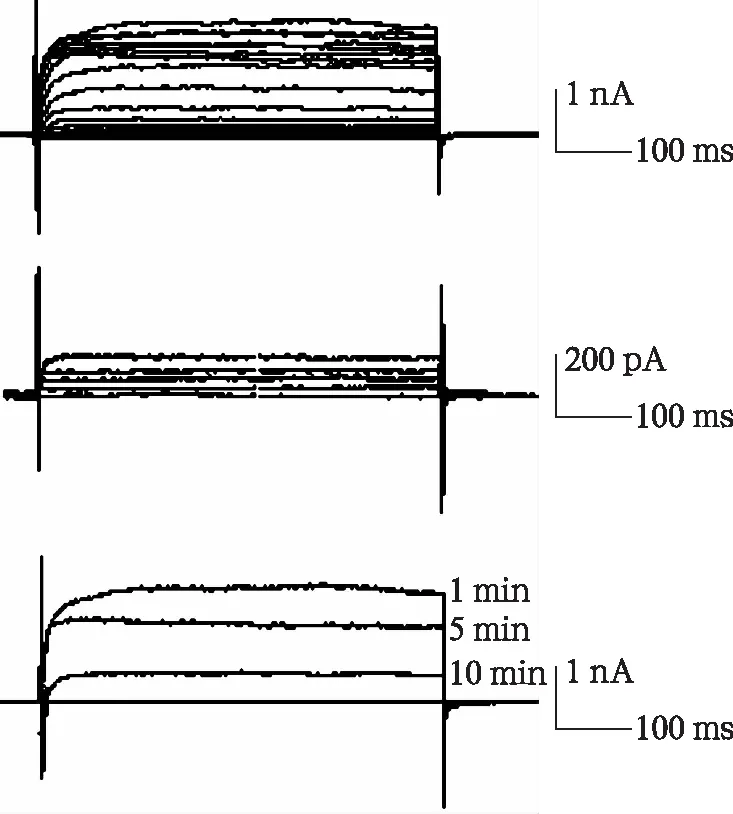
图4 速尿对延迟整流钾通道的作用
上图是在细胞外液中加入TTX抑制内向钠电流后的延迟整流钾电流图;中图是在细胞外液中加入2500μg/ml的速尿以后外向钾电流被明显抑制,仅在+200~+300pA左右;下图由上到下的三条曲线分别表示在速尿对延迟整流钾通道的作用稳定后1、5、10 min洗涤细胞外液中的速尿时,钾电流可以恢复到作用以前的98%、64%、25%。说明速尿作用时间越短,对SGN细胞延迟整流钾通道的损害程度越小

图5 速尿对钠通道的作用
A是在细胞外液中加入TEA和4-AP, 细胞内液中加入CsCl,基本抑制外向钾电流后的内向钠电流。B代表在细胞外液中加入2 500 μg/ml的速尿以后,内向钠电流被抑制到原来峰电流的30%左右。C、D、E分别代表速尿作用稳定后1、5、10 min时,用细胞外液洗脱速尿,内向钠电流可分别恢复到加药前峰电流幅值的96%、76%和54%
3 讨论
速尿主要损害耳蜗的血管纹,引起耳蜗淋巴液中电解质浓度的改变,从而导致听觉障碍。速尿可引起耳蜗内淋巴中Na+浓度增加,而K+浓度明显降低,有学者[3]认为外淋巴中Na+浓度增加是由于速尿的利尿作用引起的体液脱水所致,外淋巴中K+浓度升高起因于内耳中袢利尿剂对电解质的特异性转运作用或由内淋巴中高浓度K+引起的继发性改变。由于袢利尿剂阻滞K+转运系统,减少K+进入内淋巴,致使内淋巴中K+浓度降低,也可能是对血管纹的物理或化学效应降低边缘细胞紧密连接的严密程度,使Na+和H2O从外淋巴和血浆自细胞间隙进入内淋巴,此学说可以解释袢利尿剂为何引起内淋巴中Na+升高和K+降低[4]。本研究表明,速尿可以作用于SGN细胞的外向延迟整流钾通道和内向钠通道,引起通道电流幅度减小,导致SGN细胞内的Na+降低、K+升高,细胞外的Na+升高、K+降低,与内淋巴中的离子浓度变化相同。
孔维佳[5]用豚鼠进行实验研究发现,静脉注射速尿引起的血管纹水肿和蜗内电位幅度的变化(即结构和功能)之间呈很好的相关性。而张运东[2]的研究表明,即使离体培养的血管纹组织周围的速尿浓度达到2 500 μg/ml(相当于动物体内应用剂量625 mg/kg以上),速尿对血管纹组织也无明显的诱导水肿的毒性作用。近年来有学者研究表明,速尿是通过直接抑制血管纹缘细胞的Na+- K+-2Cl-协同转运载体,减少K+、Cl-向内淋巴的分泌,从而影响耳功能。本实验在SGN细胞外同样应用2 500 μg/ml的速尿,观察到外向的延迟整流钾通道电流被明显抑制,说明速尿可以抑制K+从细胞内向细胞外的流动,使细胞内的K+增加,这可能影响SGN细胞超极化后电位的产生,影响动作电位的不应期及复极化过程,速尿通过影响细胞膜的电生理特性而产生耳毒性。
SGN细胞是听觉传导的一级神经元,对于听觉信息的神经编码起着至关重要的作用,Hurley[6]的研究表明速尿可引起SGN细胞脱髓鞘,影响动作电位的产生。本研究利用全细胞膜片钳的研究方法证实在细胞外液中加入速尿以后,SGN细胞外向延迟整流钾电流和内向钠电流峰电流幅值均减小,其中延迟整流钾电流可被阻滞到仅+200~+300 pA左右,钠电流可被阻滞到速尿作用前峰电流幅值的30%左右,相对延迟整流钾通道,速尿对钠通道的阻滞作用更大。同时,还观察到在速尿作用稳定后的1、5、10 min时开始洗脱速尿,延迟整流钾电流和钠电流分别可以恢复到速尿作用前峰电流幅值的98%、64%、25%和96%、76%和54%。说明如果在速尿对SGN细胞离子通道作用的初期,尽快地洗脱SGN细胞周围的速尿成分,可以使SGN细胞的钾、钠离子通道的功能得到更大程度的恢复,减少速尿的耳毒性。提示临床上使用速尿治疗相关疾病时,可以短期或间断用药,保证内耳速尿的尽快代谢,减少其蓄积作用,从而预防速尿的耳毒性发生。
4 参考文献
1 Henly CM, Rybak LP. Ototoxicity in developing mammals[J]. Brain Res, 1995,20:68.
2 张运东,孔维佳. 速尿对离体培养豚鼠血管纹毒性作用的观察[J]. 听力学及言语疾病杂志,2002,10:174.
3 Kanoh N. The effect of furosemide on sodium and potassium concertration in guinea pig perilymph[J]. Arch Otorhinolaryngol,1984,240:21.
4 杨藻宸,主编. 药理学与药物治疗学[M]. 北京:人民卫生出版社,2000.157~162.
5 孔维佳,汪吉宝. 速尿对耳蜗侧壁血流量的影响[J]. 中华耳鼻咽喉科杂志,1992,27:51.
6 Hurley PA, Crook JM, Shepherd RK. Schwann cells revert to non-myelinating phenotypes in the deafened rat cochlea[J]. Eur J of Neurosci,2007,26:1 813.
