猪流感 H1N1亚型 NP基因杆状病毒表达载体构建及其在昆虫细胞中的表达*
2010-01-24段博芳张利仙叶玲玲周晓黎徐志斌
段博芳,张利仙,段 纲,董 俊,叶玲玲,周晓黎,徐志斌,艾 军
猪流感 H1N1亚型 NP基因杆状病毒表达载体构建及其在昆虫细胞中的表达*
段博芳1,张利仙2,段 纲1,董 俊3,叶玲玲3,周晓黎3,徐志斌4,艾 军3
目的 获得研发A型猪流感病毒EL ISA检测试剂盒和制备NP蛋白单克隆抗体的抗原物质。方法根据已报道的猪流感病毒 H1N1亚型NP基因序列(GenBank登录号:GQ422386)人工合成NP基因,通过 XbaⅠ和 Eco RⅠ特异性酶切,将NP基因克隆于昆虫杆状病毒表达载体p FastBacHTB,经PCR、酶切、测序鉴定后,获得携带NP基因的重组质粒p Fast-BacHTB-NP。该重组质粒转化含有杆状病毒穿梭载体的DH10Bac感受态细胞,经抗生素、PCR筛选,获得转座的杆粒Bacmid-NP。在脂质体介导下转染sf9昆虫细胞,获得重组杆状病毒,再感染细胞,收获目的蛋白。结果通过SDS-PAGE和Western blotting分析表明该蛋白得到表达,且具有良好的生物活性,大小约为57KD。结论实验结果表明已成功构建了携带NP基因的重组质粒p FastBacHTB-NP和转座的杆粒Bacmid-NP,转染后在sf9昆虫细胞上成功的表达。
H1N1;NP基因;杆状病毒表达载体;昆虫细胞
猪流感(Sw ine influenza,SI)是由正粘病毒科A型流感病毒引起的,临床上以突发、高热、咳嗽、呼吸困难、衰竭和死亡为特征的呼吸道传染病,是猪的主要免疫抑制病之一〔1〕。1918年美国首次报道了SI的暴发,1930年Shope从猪体中首次分离到了H1N1亚型猪流感病毒(Sw ine influenza virus,SIV)。迄今为止,已发现的 SIV包括 H1N 1、H1N2、H1N 7、H3N 2、H3N1、H4N 6、H5N1 和H9N2等亚型〔2-6〕。2009年甲型 HlN1流感引发的全世界流感疫情再次证明控制猪流感的重要性。因此,开发诊断和预防猪流感的制剂显得尤为迫切。
流感病毒亚型众多,但其核蛋白相对保守,具有型和种属的特异性,不仅是病毒特异性细胞毒 T淋巴细胞(cytotoxic T lymphocytes,CTL)的重要靶标〔7〕,而且最新研究表明针对NP的抗体有助于抵抗流感病毒感染〔8〕,据文献报道〔9-10〕,重组表达的NP蛋白作为抗原,均能检测A型流感病毒对应各亚型血清抗体。这也是流感病毒型分类和诊断的基础。
流感病毒抗体检测中,最重要的是抗原的制备,传统制备流感病毒抗原的方法是活病毒接种鸡胚或细胞,此法不仅费时费力,且易引起病毒泄漏和实验操作者的感染。本研究参照2009年分离株在NCB I上传的A型流感病毒NP基因序列,利用人工合成基因,在sf-9昆虫细胞上获得了高活性NP蛋白,此重组蛋白较传统制备病毒抗原安全便捷,可作为替代全病毒研制A型猪流感病间接EL ISA检测试剂盒和制备NP蛋白单克隆抗体理想的抗原物质。
1 材料和方法
1.1 质粒和菌种 pBluescrip tsk-NP重组质粒(携带人工合成的猪流感H 1N 1亚型NP基因)其中NP基因参照序列来自 GenBank(登录号:GQ422386),由大连宝生物工程有限公司合成。p FastBacH TB质粒、E.coil.Top10和DH10Bac菌株,为云南出入境检验检疫局动检实验室保存。
1.2 主要试剂 质粒小量提取试剂盒、凝胶回收试剂盒购于 AxyGEN公司,限制性内切酶 EcoR I和Xba I、DNA M arker、T4连接酶购于 TaKaRa公司;Cellfectin转染试剂盒购自Invitrogen公司;胎牛血清、Grace’s细胞培养基购自 GB ICO公司;抗 His单抗购自天根生化科技有限公司,山羊抗小鼠IgG/辣根酶(HRP)标记购自Southern Biotech公司。1.3 设计引物与合成碱基 根据NP基因序列设计了一对引物用于扩增NP基因,下划线部分分别为 E.coR I和 Xba I酶切位点 N 1:5′-gggGAA TTCAAA TGGCGTCTCAAGGCACC-3′和 N 2:5′-ggg TCTAGA TTAA TTGTCA TACTCCTCTG-3′,跨幅1 497bp。通用引物(M 13)序列参照Bac-to-Bac杆状病毒表达系统使用手册,引物均由 Invitrogen公司合成。
1.4 目的基因扩增及鉴定 用设计的特异性引物N1/N2对重组质粒pBluescrip tsk-NP进行 PCR扩增。PCR反应条件:94℃3min;94℃30s,52℃35s,72℃1min 40s,共30个循环;72℃7min;4℃保温。反应结束后,琼脂糖凝胶电泳鉴定。同时,重组质粒用 EcoRI和Xba I双酶切鉴定。
1.5 p FastBacH TB-NP重组质粒的构建 用E.coR I和 Xba I酶切pBluescrip tsk-NP重组质粒,回收NP片段,与经过相同处理的p FastBacH TB相连。连接产物转化入 TOP10感受态细胞,提取质粒,对重组质粒进行PCR扩增、酶切和测序鉴定。
1.6 重组杆状病毒转移载体的构建 将阳性质粒p FastBacH TB-NP转化于含有杆状病毒穿梭载体的DH10Bac感受态细胞,构建杆状病毒表达载体,通过卡那霉素、四环素和庆大霉素筛选重组转座子Bacm id-NP,提取杆粒,分别用M 13引物和NP引物进行PCR鉴定。
1.7 重组杆粒在昆虫细胞中的表达 按照 Invitrogen Bac-to-Bac Baculovirus Exp ression System使用说明手册进行,将重组转座子Bacmid-NP的DNA在脂质体介导下转染对数期生长的sf9昆虫细胞,设荧光蛋白转染为对照。盲传后,经3轮纯化,收获含有NP基因的重组杆状病毒。
1.8 重组表达蛋白的SDS-PA GE和Western blot分析 参照文献〔11〕,取重组病毒感染细胞裂解物上清用12%的分离胶进行SDS-PAGE。将电泳后的凝胶进行转印硝酸纤维膜,一抗为抗 His标记的小鼠抗体(1∶3 000),二抗为山羊抗鼠 IgG/辣根酶(HRP)标记(1∶3 000),以正常细胞上清为阴性对照,按常规步骤做Western blot。
1.9 重组表达蛋白的纯化浓缩 按照 His·Bind Purification Kit的说明书进行。
2 结 果
2.1 目的基因鉴定 用引物N 1/N 2对重组质粒pBluescrip tsk-NP进行扩增,扩增产物为1 497bp,见图1,双酶切结果见图2,均与理论值相符。

图1 pBluescriptsk-NP PCR鉴定1:N1/N 2扩增片段;2:阴性对照M 1:DL 2 000 DNA MarkerFig.1 PCR amplified of pBluescriptsk-NP 1:Amplified product of pBluescrip tsk-NP with the N1/N2 p rime;2:negative control;M 1:DL2 000

图2 pBluescriptsk-NP酶切鉴定1:Xba I&Eco RⅠ酶切片段;M 1:DL 5 000DNA Marker;M 2:DL 2 000 DNA MarkerFig.2 Enzyme digestion of p Bluescriptsk-NP 1.Xba I&Eco RⅠenzyme digestion of pBluescrip tsk-NP;M 1:DL50 000;M 2:DL2 000
2.2 重组质粒p FastBacH TB-NP的鉴定 重组质粒pBluescrip tsk-NP和质粒p FastBacH TB经Eco RI和 Xba I酶切处理后,连接,转化构建的重组质粒p FastBacHTB-NP。用引物N1/N2对其进行PCR鉴定,扩增产物为1 497bp,与理论值相符。经Eco RI和 Xba I双酶切,酶切产物分别为1 497bp和4 805bp见图3,均与理论值相符。经进一步序列分析验证插入的基因含有猪流感 H 1N 1亚型NP基因的完整开放阅读框架,鉴定结果表明:成功构建了昆虫杆状病毒表达质粒p FastBacH TB-NP。
2.3 转座杆粒的PCR鉴定 p FastBac H TB-NP转化DH10Bac感受态细胞,经庆大霉素、卡那霉素、四环素筛选后,提取其DNA,用M 13正向和反向引物进行 PCR鉴定,扩增产物为3 927bp见图4,表明NP基因已经转座成功。
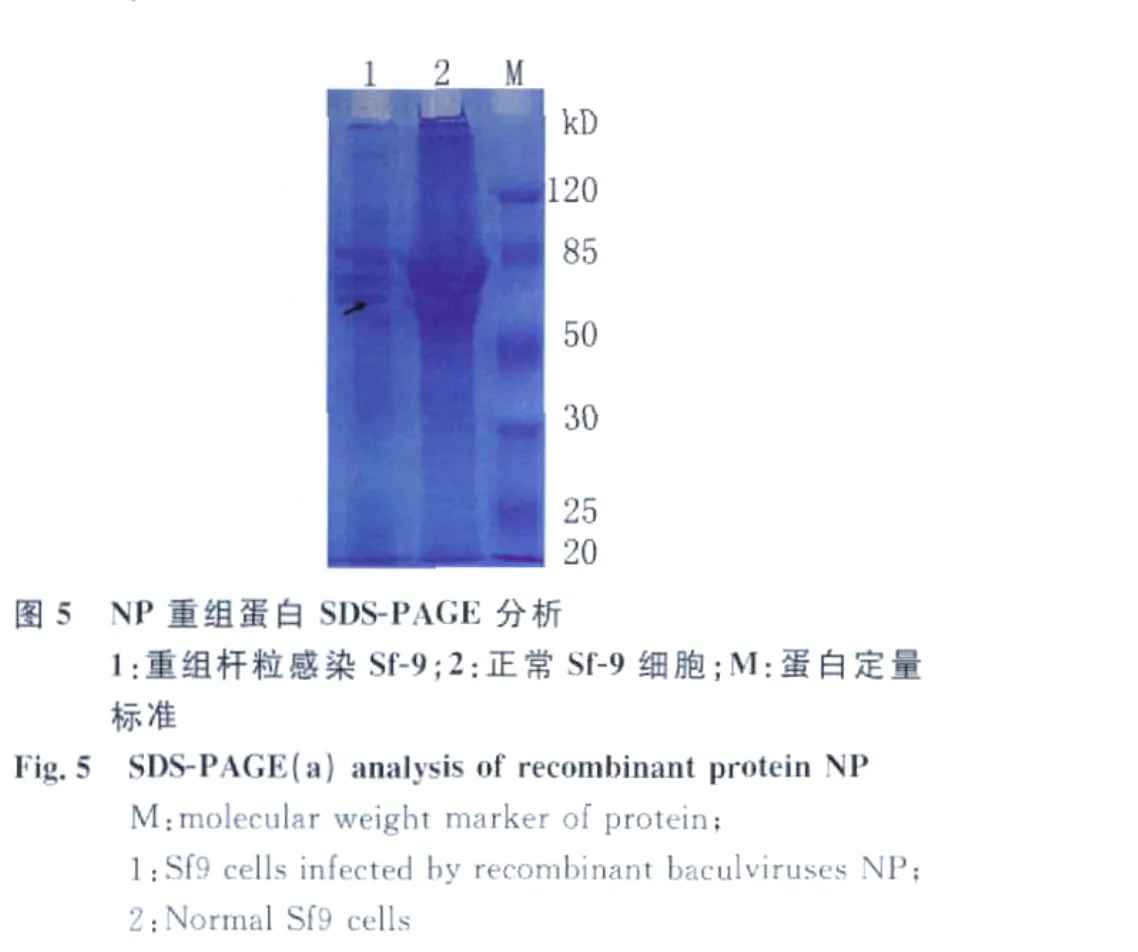
2.4 重组表达蛋白的SDS-PAGE和Western blot
将重组病毒感染细胞裂解上清用12%的分离胶进行SDS-PAGE,结果在57kD左右可见表达产物,和预期大小一致,见图5。Western blot检测,在约57kD处出现特异性印迹,而正常细胞上清中在此位置没有出现特异性印迹,见图6。
2.5 重组表达蛋白的纯化 采用 His·Bind Purification多聚组胺酸融合蛋白纯化柱子进行小量纯化,经 SDS-PAGE分析,可见在57kD处几乎只有一条蛋白条带见图7,分子大小与直接用细胞裂解上清进行SDS-PAGE出现的重组表达产物的质量大小一致,Western blot检测,在约57kD处出现特异性印迹,证实了重组目的蛋白得到了很好的纯化。
3 讨 论



自2009年4月甲型 H1N 1在全世界大流行以来,国内外各界对SIV越来越关注,一是由于猪呼吸道上皮细胞表面同时存在人流感病毒受体SA-a-2、6Gal、禽流感病毒(avian influenza virus,A IV)受体SA-a-2和3Gal,这样猪既可感染人流感病毒又可感染A IV,从而成为人-禽流感病毒重组的理想“混合器”〔12〕,另一方面历史上每次人流感的大流行都与猪流感密切相关,致使猪流感在公共卫生学上具有重要的意义。
本试验人工合成NP基因,通过克隆将其插入p FastBacH TB,成功构建了杆状病毒表达系统的转移载体p FastBacH TB-NP,在脂质体介导下在昆虫细胞中成功表达,这为NP蛋白进一步应用奠定了基础。本试验克隆的核蛋白是流感病毒的保守蛋白,具有种群和型的特异性,是琼脂扩散实验抗原的主要成分,也是流感病毒诊断最具代表性的蛋白。郭利敏〔13〕等通过原核表达系统获得了 H3N 2亚型猪流感核蛋白并对其进行抗原性分析结果显示,表达的NP蛋白能与其他亚型的SIV阳性血清发生特异性反应,证明了表达蛋白的反应原性、交叉反应性和免疫原性。倪建强〔14〕等亦通过构建p ET-NP原核表达载体成功表达了NP蛋白并将其初步应用于诊断中。然而,原核表达系统缺少表达蛋白的后加工,使得表达蛋白与病毒所表达的蛋白同源性差,直接将其应用于诊断特异性差,易引起误诊。本试验中选用的杆状病毒表达系统,能对表达产物进行糖基化、磷酸化等一系列蛋白质翻译加工修饰,表达产量高,而且昆虫细胞与脊椎动物亲缘关系远,抗原交叉反应低,这为制备高活性、高产量抗原创造了有利条件。有文献报道〔15-19〕:使用重组表达NP蛋白进行的EL ISA结果提示,真核重组表达的NP蛋白具有很好的特异性和敏感性,可以作为全病毒的替代抗原,用于开发诊断抗原有较好的代表性和较大的实用价值,作为流感的型诊断抗原具有很广泛的应用前景,并能摒弃传统诊断猪流感费时费力,对活病毒进行直接操做危险和不易推广的不足。
据 Chitra Upadhyay 等〔9-10,20〕报道 :利用重组表达蛋白建立的NP-EL ISA检测方法能检测所有A型流感病毒感染的血清抗体,在大规模流感血清抗体监测中,EL ISA检测方法优于血凝试验(H I)等检测方法。本研究中,利用杆状病毒表达载体构建表达的重组NP蛋白参照A型猪流感病毒株设计,根据相关的理论报道提示,此表达的蛋白将可作为A型猪流感的诊断抗原,为研制A型猪流感病间接EL ISA快速检测试剂盒和制备NP蛋白单克隆抗体提供了抗原物质,对猪流感的预防控制、诊断治疗具有重要现实意义。
〔1〕殷震,刘景华.动物病毒学〔M〕.2版.北京:科学出版社,1997:704-735.
〔2〕Qi X,Lu CP.Genetic characterizationg of novel reassortant H1N2 influenza A viruses isolated from pigs in southeastern China〔J〕.A rch Virol,2006,151(11):2289-2299.
〔3〕Brown IH,Hill ML,Harris PA,et al.Genetic characterization of an influenza A virus of unusual subtype(H1N7)isolated from pigs in Englang〔J〕.A rch Virol,1997,142(6):1045-1050.
〔4〕Karasin A I,Brow n IH,Carman S,et al.Isolation and characterization of H 4N6 avian influenza viruses from pigswith pneumonia in Canada〔J〕.J Virol,2000,74(19):9322-9327.
〔5〕Xu C,Fan W,Wei R,et al,Isolation and identification of swine influenza recombinant A/Swine/Shangdong/1/2003(H9N2)virus〔J〕.Microbes Infect,2004,6(10):919-925.
〔6〕李海燕,于康震,杨焕良,等.中国猪源 H5N1和 H9N2亚型流感病毒的分离鉴定〔J〕.中国预防兽医学报,2004,26(1):1-6.
〔7〕Heiny A T,Miotto O,Srinivasan K N,et al.Evolutionarily conserved protein squences of influenza a viruses,avian and human,as vaccine targets〔J〕.PLos ONE,2007,2(11):1190.
〔8〕Carragher DM,Kaminski DA,Moquin A,et al.A novel role for nonneutralizing antibodies against nuclcoprotein in facilitating resistance to influenza virus〔J〕.J Immunol,2008,181(6):4168-4176.
〔9〕Shafer A L,Katz JB,Eernisse K A.Development and validation of acompetitive enzyme-linked immusorbent assay for detection of type-A influenza antibodies in avian Sera〔J〕.Avian Dis,1998,42:28-34.
〔10〕Voeten J T M,Groen J,Van Alphen D,et a1.Use of recombinant nucleoprotein in enzyme-linked immunosorbgent assays for detection of virus-specific immunoglobulin A(IgA)and IgG antibodies in influenza virus A-o r B-infected patients〔J〕.JClin Microbiol,1998,36(12):3527-3531.
〔11〕sambrook J,russel DW,Molecular Cloning A Labo rato ry M anual〔M〕.3rded.New York:Cold sp ring Harbor Laboratory Press,2001.
〔12〕Ito T,Couceiro J,Kelm S,et al.Molecular basis for the generation in pigsof influenza viruswith pandemic potential〔J〕.J Virol,1998,72:7367-7373.
〔13〕郭利敏,乔传玲,陈艳,等.H3N2亚型猪流感病毒核蛋白基因的优化表达及抗原性分析〔J〕.中国兽医科学,2010,40(03):231-235.
〔14〕倪建强,张春玲,李海燕,等.猪流感病毒核蛋白的原核表达及其在诊断中的初步应用〔J〕.中国预防兽医学报,2004,26(1):18-21.
〔15〕Wu R,Hu S,Xiao Y,et al.Development of indirect enzymelinked immunosorbent assay with nucleoprotein as antigen for detection and quantification of antibodies against avian influenza virus〔J〕.Vet Res Commun 2007,31:631-641.
〔16〕Starick E,Werner O,Schirrmeier H,et al.Establishment of a competitive EL ISA(cEL ISA)system for the detection of influenza A virus nucleoprotein antibodies and its app lication to field sera from different species〔J〕.J VetM ed B Infect Dis Vet Public Health 2006,53:370-375.
〔17〕Jin M,Wang G,Zhang R,et al.Developmentof enzyme-linked immunosorbent assay with nucleoprotein as antigen for detection of antibodies to avian influenza virus〔J〕.Avian Dis 2004,48:870-878.
〔18〕Yang M,Berhane Y,Salo T,et al.Development and application of monoclonal antibodies against avian influenza virus nucleoprotein〔J〕.J Virol Methods 2008,147:265-274.
〔19〕Lee BW,Bey R F,BaarsehM J,et al.EL ISA method for detection of influenza A infection in swine〔J〕.J Vet Diagn Invest,1993,(4):510-515.
〔20〕Upadhyay C,Ammayappan A,Vakharia V N.Detection of NP,N 3 and N 7 antibodies to avian influenza virus by indirect EL ISA using yeast-expressed antigens〔J〕,Virology Journal,2009,6:158.
Construction of baculovirus transfer vector NP gene of swine influenza virus(H1N1)and its expression in insect cells
DUAN Bo-fang,ZHANG Li-xian,DUAN Gang,DONG Jun,YE Ling-ling,ZHOU Xiao-li,XU Zhi-bing,A IJun
(Yunnan A gricultural University,Kunm ing 650201,China)
In order to gain antigenic p roperties thatwas used to construct an EL ISA kit to test SIV antibody and to p repare monoclonal antibody,NP gene of A/Sw ine/Influenza Virus/2009(H1N 1)was syntheticed acco rding to the repo rted SIV virus NP gene(GenBank accession number:GQ422386).The NP gene fragment was cloned into the vector p FastBacHTB.The recombinant plasmid p FastBacHTB-NPwas constructed and identified by PCR and enzyme digestion and sequenced.Then the plasmid p FastHTB-NPwas transformed into DH10Bac complement cellsand identified by antibioticsand PCR.It is showed the baculovirus expression vecto r to NP gene was constructed.On this basis,transposition bacmid DNA was extracted to transfect sf9 insect cells.After 96 hours,baculovirus was harvested.Then the SDS-PAGE and western blotting showed that the NP protein was expressed in insect cells.It has a good biological activity and isapp roximate 57kDa.It isa base to construct an EL ISA kit to test SIV antibody and to p reparemonoclonal antibody.The result showed that the recombinant plasmid p Fast-BacHTB-NP and baculovirus expression vector to NP gene were constructed,and the NP gene was expressed in insect cells.
swine influenza virus(H1N1);NP Gene;baculovirus expression vecto r;insect cells
R373.1
A
1002-2694(2010)12-1118-05
*云南省社会发展科技计划(2009ZC189M)资助
艾军,Email:ajun915@tom.com;duanbofang@126.com
1.云南农业大学,昆明 650201;2.昆明理工大学,昆明 650224;3.云南出入境检验检疫局,昆明 650228;4.澄江县动物疫病预防控制中心,玉溪 652500
2010-06-15;
2010-09-20
