野生曲茎石斛的离体培养及再生体系研究
2010-01-15余晓丽王世茹曾万勇
余晓丽,王世茹,曾万勇,李 佳
(1.武汉工业学院生物与制药工程学院,湖北武汉 430023;2.河南南阳农校园艺系,河南南阳 473000)
野生曲茎石斛的离体培养及再生体系研究
余晓丽1,王世茹2,曾万勇1,李 佳1
(1.武汉工业学院生物与制药工程学院,湖北武汉 430023;2.河南南阳农校园艺系,河南南阳 473000)
以野生的曲茎石斛茎段为试材,探讨了不同生长调节剂对其不定芽诱导、增殖和生根的影响,并建立了野生曲茎石斛的高效再生体系。结果表明,利于野生曲茎石斛分化的诱导培养基为M(B5)+6-BA 2.0 mg/L+NAA 0.8 mg/L+3.0%蔗糖;以 MS+6-BA 2.0 mg/L+NAA 1.2mg/L+3.0%蔗糖为增殖培养基时的增殖效果较佳,增殖倍数为 5.6;野生曲茎石斛的高效再生体系为MS+KT 1.5 mg/L+NAA 1.0 mg/L+ IBA 1.0 mg/L+2.0%蔗糖,其生根率可达 94%;移栽基质以小树皮 +碎火山石 +椰壳粉 (1.2∶1.2∶1)为佳,移栽成活率可达到 94%。
曲茎石斛;组织培养;快速繁殖;植物生长调节剂
曲茎石斛 (Dendrobium flexicaule),为兰科(Orchidaceae)植物石斛属 (Dendrobium Sw.),是1986年在伏牛山发现的新种,属地道药材,是常用的名贵中药中药西枫斗的原植物之一[1-2]。石斛以茎入药,性寒,味甘,有滋阴助阳、补心生血、养肝肾的作用,神话有起死回生之功。因其生长在悬崖峭壁上,采挖十分困难,采收时连根拔起,使自然资源日益减少,我国已将其列为濒于绝灭的受保护的中药品种之一[3-4]。国内外对多种石斛植物进行了组织研究[5-10],而对曲茎石斛茎段的组织培养及快繁技术尚未见报道。本试验利用河南省西峡县细莘沟野生的曲茎石斛茎段作试材,建立曲茎石斛的再生体系,为进一步的研究提供可靠的基础,并培育出曲茎石斛苗数千株,生长良好。
1 材料与方法
1.1 试验材料
河南省西峡县细莘沟野生的曲茎石斛茎段。
1.2 试验方法
1.2.1 外植体的灭菌方法
将嫩茎去掉叶片,用镊子轻轻将膜质叶鞘剥去,切取带有芽眼的嫩茎段 (长约 (1—2 cm)。分别用A、B、C、D四种方法进行表面消毒。
A:用 75%的酒精浸泡 10 s,然后用 2%的次氯酸钠处理 18 min,再用无菌水冲洗 4—5次。
B:用 75%的酒精浸泡 10 s,然后用 0.1%的升汞处理 10 min,再用无菌水冲洗 4—5次。
C:用 1.5%的次氯酸钠处理 20 min,然后用无菌水冲洗 4—5次,接种到无糖培养基上培养 10 d后,再用方法 B消毒。
D:用 0.1%的升汞处理 10 min,然后用无菌水冲洗 4—5次,接种到无糖培养基上培养 10 d后,再用方法A消毒。
把消毒的曲茎石斛茎段接种到预先准备的启动培养基上,一瓶接种一个茎段,在 23℃±2℃,光照12 h/d,光照强度 15000 Lx的条件下培养。
1.2.2 诱导培养基的筛选
A-1:MS+6-BA 2.0 mg/L+NAA 0.8 mg/L+3.0%蔗糖
A-2:MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+3.0%蔗糖
A-3:B5+6-BA 2.0 mg/L+NAA 0.8 mg/L+3.0%蔗糖
A-4:B5+6-BA 2.0 mg/L+NAA 0.5 mg/L+3.0%蔗糖
1.2.3 增殖培养基的筛选
B-1:MS+6-BA 2.0 mg/L+ IBA 0.5 mg/L+3.0%蔗糖
B-2:MS+6-BA 2.0 mg/L+ IBA 0.8 mg/L+3.0%蔗糖
B-3:MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+3.0%蔗糖
B-4:MS+6-BA 2.0 mg/L+NAA 0.8 mg/L+3.0%蔗糖
B-5:MS+6-BA 2.0 mg/L+NAA 1.2 mg/L+3.0%蔗糖
B-6:B5+6-BA 2.0 mg/L+ IBA 0.5 mg/L+3.0%蔗糖
B-7:B5+6-BA 2.0 mg/L+ IBA 0.8 mg/L+3.0%蔗糖
B-8:B5+6-BA 2.0 mg/L+NAA 0.5 mg/L+3.0%蔗糖
B-9:B5+6-BA 2.0 mg/L+NAA 0.8 mg/L+3.0%蔗糖
B-10:B5+6-BA 2.0 mg/L+NAA 1.2 mg/L+3.0%蔗糖
1.2.4 生根培养基的筛选
C-1:MS+KT 1.5 mg/L+ IBA 1.0 mg/L+2.0%蔗糖
C-2:MS+KT 1.5 mg/L+NAA 1.0 mg/L+2.0%蔗糖
C-3:MS+KT 1.5 mg/L+NAA 1.0+mg/LI
BA 1.0 mg/L+2.0%蔗糖1.2.5 移栽基质的筛选
D-1:小树皮 +碎火山石 +椰壳粉 (1.2∶1.2∶1)
D-2:小树皮 +椰壳粉 (1.2∶1)
D-3:小树皮 +碎火山石 (1∶1.2)
D-4:碎火山石 +椰壳粉 (1∶1)
2 结果与分析
2.1 外植体的灭菌
曲茎石斛幼茎经四种不同方法灭菌后接种,15 d后观察结果如表1所示。
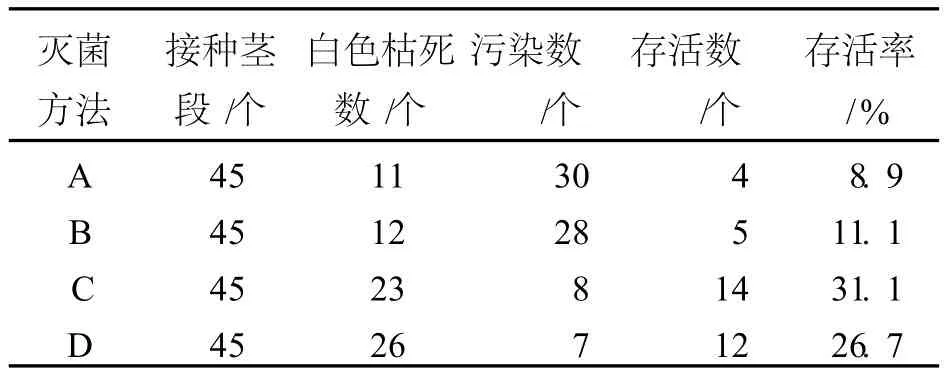
表1 不同灭菌方法对曲茎石斛茎段存活率的影响
从表1中可以看出,不同的灭菌方法茎段存活率差异较大;方法 C和 D灭菌后茎段存活率分别达到 31.1%和 26.7%,较为理想,但方法 D使用的灭菌剂是升汞,不宜彻底清洗,对环境污染严重,因此方法 C灭菌较为适宜。
2.2 初代诱导培养
将消毒后的曲茎石斛幼茎切成 0.5—1.0 cm,分别接种到启动培养基上,激素配比单位为 mg/L,观察结果见表2所示。
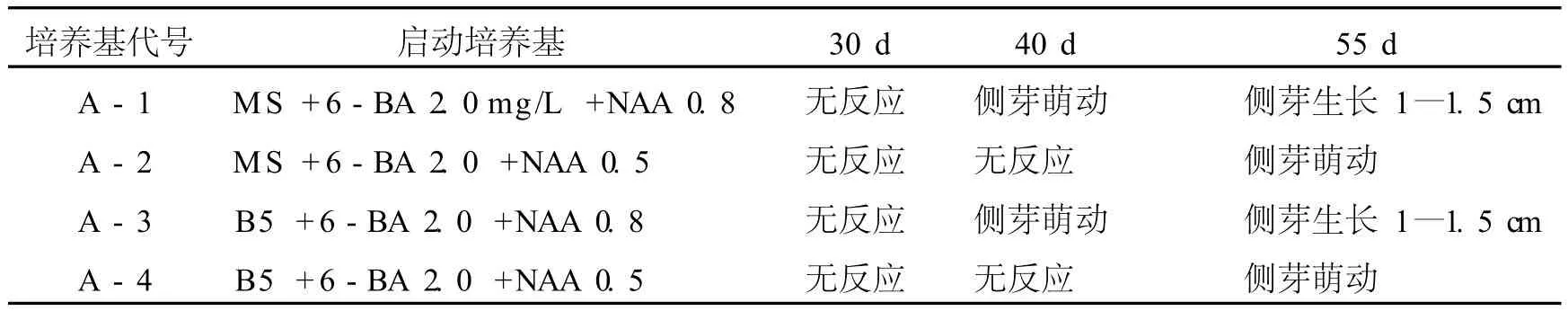
表2 不同生长调节物质组合对野生曲茎石斛不定芽诱导的影响
从表2可以看出,曲茎石斛幼茎启动培养基MS、B5基本无差异,激素配比以 6-BA 2.0 mg/L+NAA 0.8 mg/L较为适宜。
2.3 增殖培养
将生长旺盛的试管苗单芽茎段转接到增殖培养基上,每瓶 4株,各接 20瓶进行培养,激素配比单位为 mg/L,观察结果见表3。
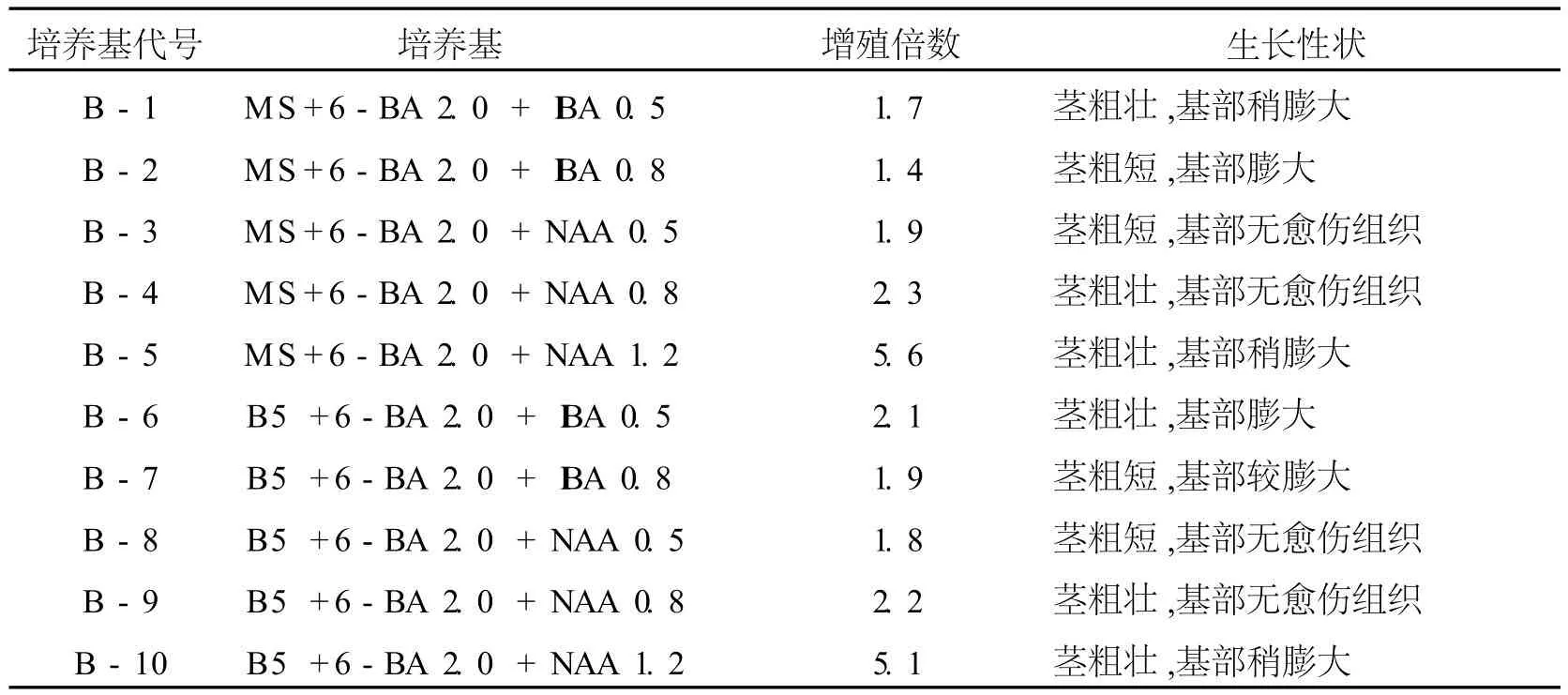
表3 不同生长调节物质组合对野生曲茎石斛不定芽增殖的影响
从表3可以看出:曲茎石斛幼茎继代培养基MS、B5均无差异,MS稍好于 B5,激素配比以 6-BA 2.0 mg/L+NAA1.2mg/L较为适宜。B-1和 B-6、B-2和 B-7号在 6-BA、 IBA浓度相同的条件下,MS、B5培养基增殖均不理想,但基部形成较大的愈伤组织,可以诱导形成原球茎。
2.4 生根培养
将曲茎石斛茎段,转入生根培养基内诱导生根,每瓶接种 4株,各接种 20瓶,激素配比单位为 mg/L,30 d观察结果见表4。
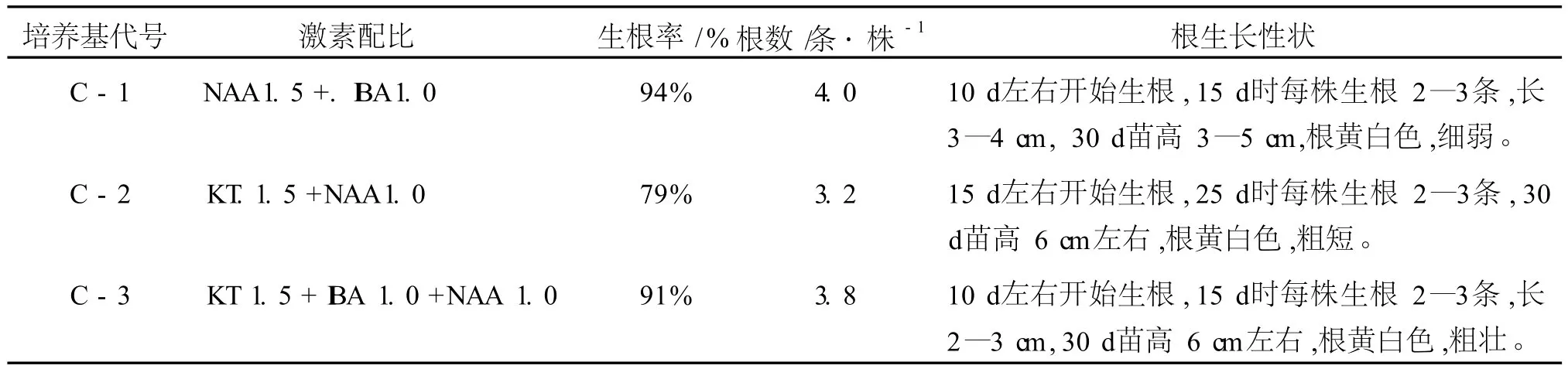
表4 不同生长调节物质组合对野生黄木香不定芽生根的影响
从表4可以看出,C-1培养基生根率、每株根数、根长略高于 C-3培养基,但根较细弱,苗生长缓慢,C-3培养基在生根率、每株根数、根长、苗生长速度等方面较为理想,试验表明:曲茎石斛生根培养基以MS+KT 1.5 mg/L+ IBA 1.0mg/L+NAA 1.0mg/L为最佳。
2.5 移栽基质
将高 5—8 cm、根系完好的试管苗,洗去培养基,经高锰酸钾消毒后,移栽到 4-1至 4-4基质中,每种处理 30株苗,分 6行,移栽 30 d后上盆 ,同时计算幼苗成活率。观察结果如表5所示。
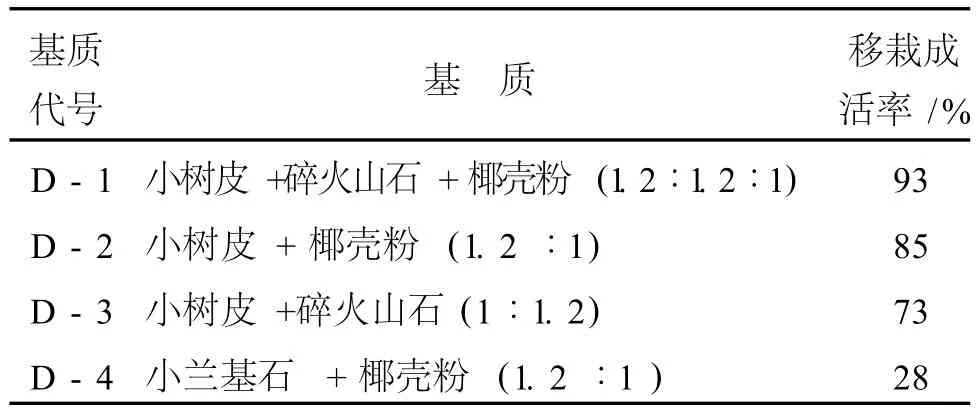
表5 不同基质对曲茎石斛试管苗移栽成活率的影响
从表5试验结果可以看出:D-1基质移栽成活率可达到 93%,D-4基质最低,只有 30%,可能是曲茎石斛的根系生长需要较湿润且透气的环境,而D-1基质:小树皮 +碎火山石 +椰壳粉 (1.2∶1.2∶1)的特性及组合满足了这一需要,既能透气又能排水保水。
3 结论与讨论
有关植物生长调节剂对石斛组织培养特性的研究已有大量报道。本研究表明,不同的植物生长调节剂配比及其他诱导因子对野生曲茎石斛的组培有很大影响,曲茎石斛起动培养的适宜培养基为 M(B5)+6-BA 2.0 mg/L+NAA 0.8 mg/L+3.0%蔗糖;以 MS+6-BA 2.0 mg/L+NAA 1.2 mg/L+3.0%蔗糖作继代培养基效果最好,增殖倍数5.6;利于生根的培养基为 MS+KT 1.5 mg/L +IBA 1.0 mg/L+NAA 1.0 mg/L+2.0%蔗糖,生根率为 91%;移栽基质以小树皮 +碎火山石 +椰壳粉 (1.2∶1.2∶1)为佳,移栽成活率可达到 94%。
野生的曲茎石斛幼茎消毒后存活率较低,污染率较高,合适的消毒方法有待进一步试验。初代培养启动时间较长,需要进一步试验。继代培养中,基部膨大形成愈伤组织,愈伤组织可形成原球茎,再生出小植株,增大繁殖系数,适宜的培养基及激素配比需要进一步试验,组培曲茎石斛与野生曲茎石斛的生物碱含量及药用等方面需要进一步研究。
[1] 冉懋雄.石斛〔M〕.北京:科学技术文献出版社,2002.
[2] 《中国中药资源从书》编委会.中国常用中药材〔M〕.北京:科学出版社,1995.
[3] 李满飞,徐国钧.商品石斛的调查及鉴定 (Ⅱ)[J].中草药 ,1991,22(4):173.
[4] 陈心启,吉占和.中国兰花全书 [M].北京:中国林业出版社,1998.
[5] 张明,夏鸿西,朱利泉,等.石斛组织培养研究进展[J].中国中药杂志,2000,25(6):323-326.
[6] Lam Chan L T,Lee Sm.Inflorescence.Culture of some tropical orchid varidties singapore[J].Journal of Primary Industries.1996,24:35.
[7] 叶秀嶙,程式君,王伏雄.黑节草未成熟种子的形态发育及其在离体培养时的表现[J].云南植物研究,1988,10(30):285.
[8] 徐云鹃,于力文.霍山石斛种子试管苗的培养[J].植物生理学通讯,1984(4):35.
[9] Devi J,Borthakur B,Deka P C.Clonal.Propagationofdenelrobium moschatum and cymbidium aloifolium through shoot-tip culture[J].Journal of the Orchid Society of India,1997,11(1—2):19.
[10] 王康正,高文远.石斛属药用植物研究进展[J].中草药,1997,28(10):633-635.
Culturing of wild Dendrobium flexicaule and studing of regeneration system
YU Xiao-li1,Wang Shi-ru2,Zeng Wang-yong1,Li Jia1
(1.School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China;2.Horticulture Department of Nang Yang Agriculture School,Nanyang 473000,China)
By taking wild Dendrobium flexicaule as exp l ants,we studied the influence of different growth regulating substances on adventitious buds induction,multiplication and rooting,and established regeneration system of high efficiency on Dendrobium flexicaule.The results suggested that the best medium for induce wasM(B5)+6-BA 2.0 mg/l+NAA 0.8 mg/l+3.0%sucrose;the best medium for the multiplication of medium was the best with MS+6-BA 2.0 mg/l+NAA 1.2 mg/l+3.0%sucrose,the multiplication multiple was 5.6;the regeneration system of high efficiency on Dendrobium flexicaule was MS+KT 1.5 mg/l+NAA 1.0 mg/l+ IBA 1.0 mg/l+2.0%sucrose,and the rooting rate was 94%.The optimum transplantation medium is little brak+volcanic rocks+coconut shell powder(1.5∶1.5∶1)and the survival rate is over 94%.
Dendrobium flexicaule;tissue culture;rapid propagation;plant growth regulator(PGR)
S 567
A
1009-4881(2010)01-0021-04
10.3969/j.issn.1009-4881.2010.01.007
2009-10-11.
余晓丽 (1963-),女,副教授 ,E-mail:yxlL268@126.com.
武汉工业学院校立科研项目(07Y03). .
