硫酸亚铁铵盐弱酸性体系电镀锌铁合金的研究
2010-01-15周晓荣刘小波李永明张开诚
周晓荣,刘小波,胡 宇,王 伟,李永明,方 华,张开诚
(武汉工业学院化学与环境工程学院,湖北武汉 430023)
硫酸亚铁铵盐弱酸性体系电镀锌铁合金的研究
周晓荣,刘小波,胡 宇,王 伟,李永明,方 华,张开诚
(武汉工业学院化学与环境工程学院,湖北武汉 430023)
以硫酸亚铁铵盐和氯化锌为主盐的弱酸性体系电镀锌铁合金,镀液静置 15 d,仍稳定、无沉淀。研究了添加剂、电流密度、温度和 pH对镀层的外观以及镀层组成的影响。结果表明,增加添加剂的用量,降低温度或者电流密度,会使镀层变得光亮。pH对镀层光亮度的影响有一个最佳范围为 4.5—5.5。添加剂用量为 15—17 mL/L,温度为 30℃,pH为 4.5—5.5,电流密度为 0.5—1.0 A/dm2时,镀层光亮且铁含量在 0.2%—0.8%。SEM图显示,添加剂用量的增加使得镀层的结构更加紧密。
电镀;锌铁合金;SEM;硫酸亚铁铵
为了延长钢铁材质的仪器设备的使用寿命而又达到保护环境的要求,采用在钢铁表面覆盖金属锌的方法,此工艺在几十年前就开始应用[1]。此后,研究者们着力于寻找新的成本低廉、耐蚀性更好的镀层金属,关注热点主要为锌为主体的锌合金镀层,如 Zn-Ni、Zn-Co、Zn-Fe等[2-3]。由于铁资源丰富、成本较低,锌铁合金电镀成为电镀工作者们孜孜不倦地研究对象,期望通过工艺的改进,代替 Zn-Ni合金,在电子设备和汽车工业上得到应用。
在锌铁合金电镀工艺研究中,镀液稳定性是研究重点之一,这是因为镀液中的亚铁盐不稳定,易氧化成三价铁离子或生成氢氧化物沉淀。本研究选择硫酸亚铁铵盐为镀液中二价铁离子的来源物,增加镀液稳定性,有利于获得表面光亮、结晶更细致,耐腐蚀性更好的锌铁合金镀层。
2 材料与方法
2.1 药品与仪器
药品:氯化锌、硫酸亚铁铵 、氯化钾、硼酸、柠檬酸钠、碳酸钠、氢氧化钠、OP-10、硫酸、稳定剂 (由多种有机羧酸和氟化物复配组成)、复合型添加剂。所用的化学试剂均为化学纯。铜片、锌片。
仪器:酸度计、恒温水浴槽、电解电源、磁力搅拌器、电子天平、分光光度计、电化学工作站、电子扫描显微镜。
2.2 实验方法
2.2.1 镀液的配制
参考硫酸盐体系电镀锌铁合金的文献[4]确定本研究的镀液组成:ZnCl220 g/L;(NH4)2Fe(SO4)2·6H2O 14 g/L;KCl 100 g/L;H3BO310 g/L;柠檬酸钠 10 g/L;稳定剂 (由多种有机羧酸和氟化物复配组成)5g/L;复合型添加剂适量 (自制,主要为芳香族酮与胺的复合物)。所用的化学试剂均为化学纯。
称取所需的试剂,分别溶解后混合在一起,最后加入添加剂。电镀时温度范围 30—70℃,pH控制在 3.0—6.0之间,电流密度范围为 0.5—5 A/dm2,时间为 15—30 min.
2.2.2 镀前预处理
在实验中我们采用以下预处理工艺:化学除油→流水清洗→盐酸浸蚀活化→流水清洗→电镀→清洗→吹干。
2.2.3 电镀
作镀层分析时用的电镀基体为铜片 (含量不少于 99.5%),阳极材料为纯锌;电镀时间为 15 min.电镀完毕之后立即用流水清洗,晾干,编号。通过检测镀液中亚铁离子的浓度,及时添加铁盐以维持镀液中铁离子浓度不变。
2.3 镀层的分析[5]
2.3.1 镀层铁含量的分析
Fe(Ⅱ)在 pH=3—9之间的溶液中与邻菲罗啉生成稳定的橙红色络合物[(C12H8N2)3Fe]2+,本课题组在镀层含铁量的测定上采用分析周期短,试样消耗量小,显色灵敏且稳定的邻菲罗啉分光光度法。通过对亚铁离子标准溶液及锌铁离子混合溶液进行测定,得到此方法所用的各试剂的最佳用量及显色时间。
分析时,截取面积约 1 cm2大小的阴极电镀试片,用 5 mL10%稀硫酸溶解镀层,往所得溶液中加入醋酸钠,使溶液 pH为 5,定容至 50 mL。取 1 mL镀层稀释液,加入 2 mL10%盐酸羟胺溶液,再加入3 mL 0.5%邻二氮菲溶液,定容至 10 mL。显色15 min后,测定其吸光度,用来计算镀层中铁的质量mFe.另取 5 mL镀层稀释液,加入 50 mL蒸馏水,5 mL1.0 mol/L的氯化铵溶液,加入紫脲酸胺作指示剂,用 0.1 mol/L的标准 EDTA溶液滴定,得到镀层中的锌铁总量m.
镀层中铁的质量分数 wFe=(mFe/m)×100%.
仪器型号:721型分光光度计,尤尼柯仪器公司生产。本文图中纵轴量的单位均为镀层中铁的质量分数。
2.3.2 镀层外观和微观结构分析
外观:用目测或 5倍放大镜观察,要求镀层结晶细致,光滑平整,色泽正常。
微观结构:用日本 H ITACH I公司生产的s-3000N型扫描电子显微镜观察镀层的表面微观结构。
3 结果与讨论
3.1 镀液的稳定性
按照前文中 2.1所示的镀液组成配制锌铁合金镀液,不加入添加剂,在室温 25℃下静置,15 d后仍然无沉淀产生,镀液为暗紫色。而按照相同的锌离子和亚铁离子浓度配制的氯化物锌铁合金镀液体系,5d就出现沉淀,溶液为暗紫红色。
3.2 温度对镀层的影响
3.2.1 镀层外观
温度对所得锌铁合金镀层外观的影响如表1所示。从表1可以看出,在低电流密度下电镀时,获得外观光亮的镀层的温度范围宽。这说明添加剂在低温下成分稳定且在电极上吸附量较多,对电极过程影响较大。同时,也说明电流密度小时,阴极因为外电场而引起的过电位小,虽然温度升高,也可以增加电极反应速率,但添加剂的作用体现得较明显,避免了氢离子的还原,镀层仍可平整、光亮。反之,当电流密度增大到 2 A/dm2时,因为超电势增大使得电极反应速率增大程度较多,溶液中的金属离子还原电流达到极限电流密度,电极上积累了大量的自由电子,虽然添加剂可吸附在电极表面,但氢离子体积小,仍能“钻”到电极表面,造成了溶液中的氢离子还原,大量氢气从电极表面析出,使得镀层与基体的结合力受到影响,因此镀层变得粗糙,不再光亮。本研究中,电流密度为 0.5 A/dm2时,温度范围为30—40℃;电流密度为 1.0 A/dm2时,温度范围为30—35℃;电流密度为 1.5 A/dm2时,温度为 30℃;而电流密度为 2.0 A/dm2时,在 30—70℃的温度范围内所得镀层均不光亮。
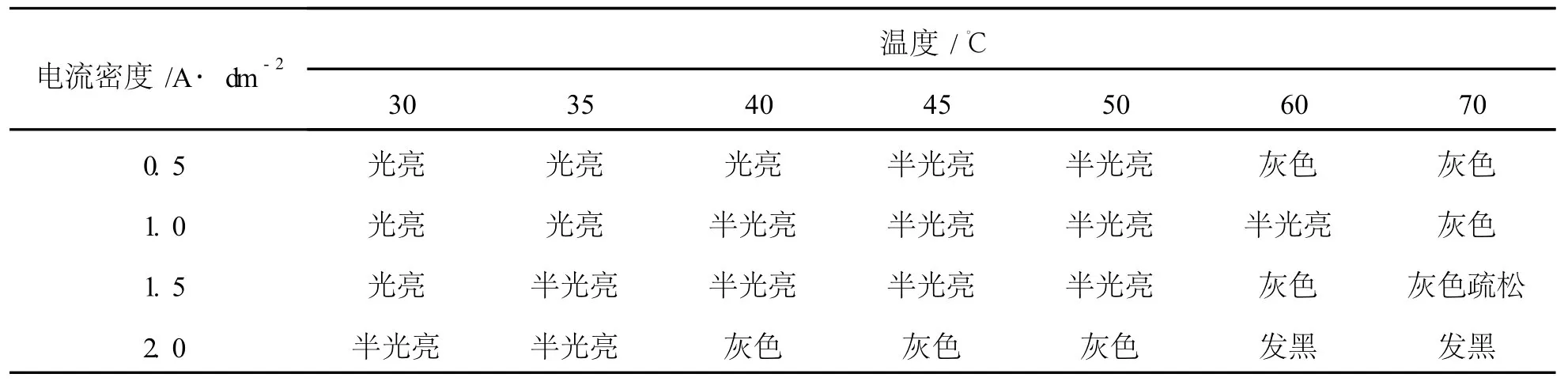
表1 温度对镀层外观的影响
3.2.2 镀层铁含量
图1是温度对镀层铁含量的影响曲线。从图1可以看出,电流密度为 0.5 A/dm2时,随着温度的升高,镀层铁质量分数先不变,后增大。而电流密度为1.0,1.5和 2.0 A/dm2时,随着温度的升高,镀层铁含量下降。这说明在低电流密度时,温度的增加对亚铁离子的还原反应速率影响较大,使得亚铁离子的还原速率高于锌离子的还原速率,使得镀层中亚铁离子的含量增加。在较高的电流密度时,过电位增大,温度的增加使得锌离子的沉积速率增大的速率高于亚铁离子,使得镀层铁含量相对下降。本研究中,要获得含铁量为 0.2—0.8%的 Zn—Fe合金镀层,电流密度为 0.5 A/dm2时,温度范围为 30—60℃;电流密度为 1.0 A/dm2时,温度范围为 55—70℃。
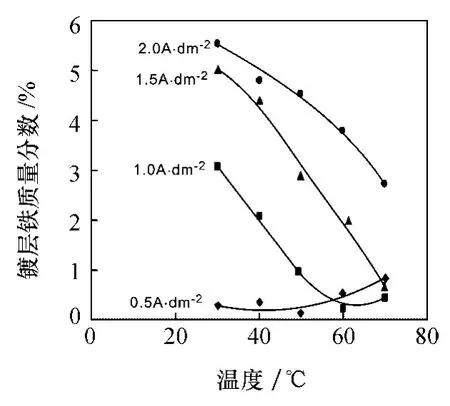
图1 温度对镀层铁质量分数的影响
3.3 pH对镀层的影响
3.3.1 镀层外观
pH对锌铁合金镀层外观的影响情况如表2所示。镀液 pH越低,说明镀液中的氢离子浓度越大,电镀时,在阴极上还原产生的氢气析出量增多,使得金属沉积颗粒之间的结合程度变差,光亮度变差。镀液的 pH越高,金属离子水解程度增强,产生了氢氧化物,使得镀液变浑浊,也会使得金属镀层光亮度变差。因此,镀液 pH存在一个最佳范围。从表中可看出,要获得外观光亮的镀层,pH应控制在4.5—5.5。
3.3.2 镀层铁含量
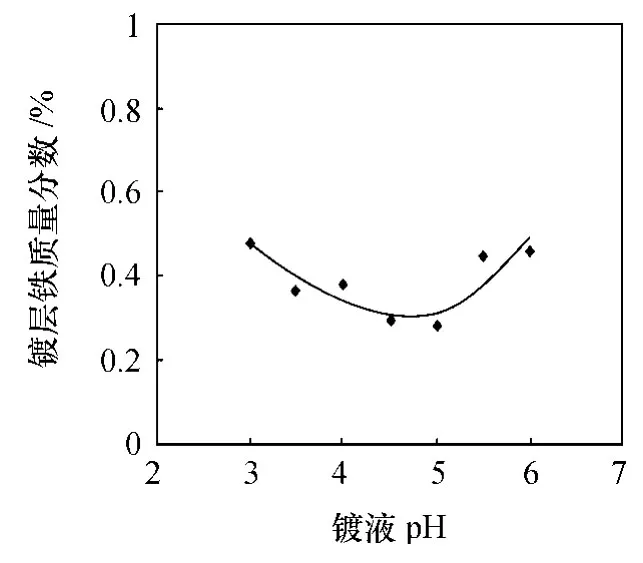
图2 镀液 pH对镀层铁质量分数的影响
控制镀液温度为 30℃,电液密度为 0.5 A·dm-2,镀液 pH对锌铁合金镀层铁含量的影响情况如图2所示。镀液 pH上升,镀液中金属离子水解生成氢氧化物的程度增大,遵循这个规律,镀层中铁含量应逐步减小。从图2可以看出,随着镀液pH的升高,镀层铁含量先减小后增大,pH大于 5时,镀层铁含量反而上升,这个现象说明锌离子同样会生成氢氧化物,也受到 pH的影响。本研究中,在pH为 3—6的范围内,镀层铁含量均在 0.2—0.8%范围内。
3.4 电流密度对镀层的影响
3.4.1 镀层外观
控制温度为 30℃,pH为 5.0,电流密度对锌铁合金镀层外观的影响如表3所示。从表中可以看出,在不加添加剂的情况下,不能获得光亮的镀层;而添加了 15 mL/L添加剂之后,在电流密度为0.5—1.0 A/dm2范围内可获得全光亮且与基体结合紧密的镀层。这是因为无添加剂时,金属离子在阴极表面的沉积表现为晶粒生长控制机理,晶核的生成速率低于晶粒的尺寸生长速率,金属沉积层表现出粗颗粒的堆积,表面凸凹不平,表现为不光亮。镀液中加入适量添加剂后,因为抑制了金属离子的沉积速率,晶核的生成速率高于晶核的生长速率,晶粒细化,表面平整,光亮度增强。

表3 电流密度对镀层外观的影响
3.4.2 镀层铁含量
温度为 30℃,pH为 5.0时,电流密度对镀层铁含量的影响如图3所示。从图3可知,镀液中不含添加剂时,随着电流密度的增加,镀层铁含量先增大,后减小。镀液中有添加剂时,镀层中铁含量随着电流密度的增加而增大。总的来说,加入添加剂后,镀层铁含量远低于没有添加剂时。这是因为电流密度增大,单位时间里到达阴极的自由电子数量增加,可在电极表面沉积的金属粒子数增加,比较锌离子和亚铁离子的平衡沉积电势,前者的更负,即常规沉积条件下,单质铁的生成速率大于锌的沉积。无添加剂的情况下,电流密度大于 3 A/dm2时,镀层中铁含量又下降,应该归因于氢离子的还原引起了阴极附近 pH的升高,生成了铁的氢氧化物。在本研究中,在电流密度为 0.5—3 A/dm2范围内,有添加剂时,可获得铁含量在0.2—0.8%的锌铁合金镀层。
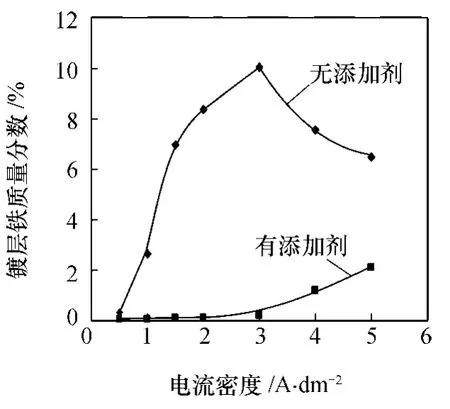
图3 电流密度对镀层铁质量分数的影响
3.5 添加剂对镀层的影响
3.5.1 镀层外观
添加剂的用量对所得锌铁合金镀层外观的影响情况如表4所示。从表中可以看出,当添加剂的用量达到 4 mL/L时,镀层外观就变成半光亮。当添加剂的用量达到 15 mL/L时,镀层外观为全光亮。这是因为添加剂中的有机物吸附在阴极表面,增大了金属离子在阴极还原的过电位,降低了金属沉积的速率,因此金属结晶颗粒变小,晶核生成速率大于晶粒生长速率,晶粒排列紧密,与基体结合力变牢固,镀层变得平整,因此外观光亮度增强。

表4 添加剂的用量对镀层外观的影响
3.5.2 镀层铁含量
图4显示了添加剂用量对镀层铁含量的影响。从图中可看出,随着添加剂的加入,镀层铁质量分数由 0.3%减小到 0.1%,当添加剂的用量超过 8 mL/L时,随着添加剂的增加,镀层铁含量出现先增大后减小的趋势。这说明添加剂在电极上的吸附,在量比较少的时候,首先吸附在亚铁离子沉积的活性位点上,对亚铁离子的沉积速率影响较大。而随着添加剂的增多,在锌离子沉积的活性位点上也产生吸附,使得锌离子的沉积速率也受到影响,但由于整个镀层中锌离子的活性位点多,所以对锌离子的影响程度变大,镀层中的铁含量又相对上升。当整个基体表面都被添加剂中的有机物分子覆盖时,锌离子和亚铁离子的还原速率都减慢,但相对速率接近于不含添加剂时,所以镀层中铁含量又出现降低的现象。按照文献[6]的结论,含铁量为 0.2%—0.8%的锌铁合金镀层钝化后耐腐蚀性最好,若只考虑镀层铁含量,本工艺中添加剂的含量应控制在 10—17 mL/L。
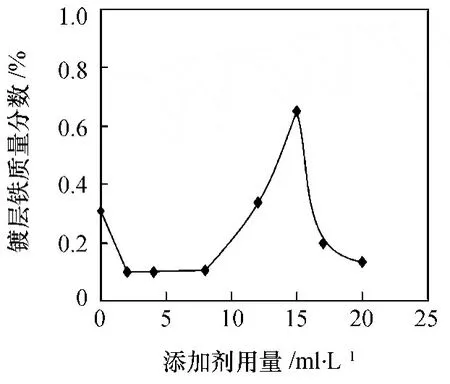
图4 添加剂对镀层铁质量分数的影响
3.5.3 镀层的 SEM表征
图5是在前述最佳操作条件下所得的三种镀层表面的 SEM图。从图5的三张放大图可看出,在放大 200倍的情况下比较,往镀液中加入添加剂2 mL/L后,镀层由高低不平的表面结构变为致密的网状结构,但可见许多微孔。当镀液中添加剂的浓度达到最佳取值的范围 15—17 mL/L时,所得镀层表面平整、致密,无微孔存在。这进一步证明,在其他条件相同的条件下,添加剂对于改善镀层微观结构有着重要作用。添加剂对于金属离子的阴极电沉积过程抑制,使得镀层金属颗粒细化,排列紧密,因而在合适的添加剂浓度条件下,所得镀层目测条件下外观为全光亮。

图5 镀层的 SEM图
4 结论
4.1 使用硫酸亚铁铵的锌铁合金电镀液稳定性好,室温 25℃下,静置 15d无沉淀产生。
4.2 综合锌铁合金镀层外观的光亮程度和镀层铁含量控制在0.2—0.8%两方面来考虑,本研究中的最佳添加剂用量为 15—17 mL/L。最佳操作条件为:温度 30℃,pH 4.5—5.5,电流密度 0.5—1.0 A/dm2。
4.3 本研究所得的锌铁合金镀层的微观结构与镀液中添加剂的用量有关,添加剂用量的增加使得镀层的表面结构更加平整、致密。当添加剂用量达到最佳浓度范围时,镀层结构平整、致密,无微孔存在,外观光亮。
[1] 杨新红,蒋雄,江琳才.光亮氯化钾镀锌添加剂的研究 [J].电镀与涂饰,1992,19(3):14-21.
[2] 屠振密,张景双,杨哲龙,等.电镀锌基合金的应用与发展 [J].材料保护,1993,26(7):15-21.
[3] 屠振密,杨哲龙,安茂忠,等.电镀锌基合金工艺的发展及应用 [J].电镀与精饰,1998,20(2):18-23.
[4] Jelena B B,Vesna B M,MiodragD M,et al.,Electrochemical deposition and characterization of Zn–Fe alloys[J].J Serb Chem Soc,2004,69(10):807-815.
[5] 周晓荣,张佳伟,程四清,等.电镀 Zn-Fe合金工艺研究 [J].电镀与精饰,2009,31(3):13-15.
[6] 张昭,张鉴清,王建明,等.Zn-Fe合金电镀工艺的研究 [J].化工机械,2000,27(6):320-324.
Study of zinc-iron electrode position in light acid solution containing(NH4)2Fe(SO4)2
ZHOU X iao-rong,LIU Xiao-bo,HU Yu,WANG Wei,LI Yong-ming,FANG Hua,ZHANG Kai-cheng
(School of Chemical and Environmental Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
Zn-Fe alloys are electrode posited in light acid solution containing zinc chloride and(NH4)2Fe(SO4)2.The bath is steady,and no position appears in 15 days.The effects of additives and current density,temperature,pH on the surface and the composition of Fe in the electrode posits are investigated. It shows that the Zn-Fe electrode posits become brighter with the increase of additives,or decrease of current density and bath temperature.The ideal Zn-Fe electrode posits are obtained when bath pH is adjusted to 4.5-5.5.Bright Zn—Fe electrode posits with Fe content in the range of 0.2—0.8%can be got when additives content is 15-17 ml/L,and temperature being 30℃,pH being 4.5—5.5,current density being 0.5-1.0 A/dm2.It is revealed by the SEM graphs that the increase of the additives make the sructure of Zn—Fe alloy deposits more tight.
electrode position;Zn-Fe alloy;SEM;ammonium ferrous sulfate
TQ 153.2
A
1009-4881(2010)01-0032-06
10.3969/j.issn.1009-4881.2010.01.010
2009-04-27.
周晓荣 (1977-),女,副教授,E-mail:zxr_whu@163.com.
湖北省教育厅项目(B20081804);武汉工业学院校立青年资助项目(07Q11).
