高温α-淀粉酶高表达的研究
2010-01-12黄春敏王正祥
黄春敏,沈 微,王正祥
(江南大学生物工程学院生物资源与生物能源研究中心和教育部工业生物技术教育部重点实验室,江苏无锡 214122)
高温α-淀粉酶是一种内切型淀粉酶,能随机水解淀粉质原料及其降解物内部的α-1,4糖苷键。因具有反应温度高、热稳定性好等特性而被广泛应用于酒精、白酒、啤酒等食品发酵工业中和纺织业高温退浆。地衣芽胞杆菌是公认的具有重要工业生产价值的生产菌株,在酶制剂工业中已使用数十年。但目前生产所使用的菌株大多是野生菌株经过传统遗传改良获得的突变株,容易出现平台效应[1]。在以前的研究已经发现:地衣芽胞杆菌中通过游离质粒增加BLA编码基因的剂量可以显著提高BLA的发酵速率和产酶水平[2];通过定向基因整合的方法也可以有效提高BLA的产率[3]。同时在研究中也发现,在特定地衣芽胞杆菌的染色体中,实现BLA编码基因的整合与基因扩增并不容易发生。为此,本研究构建了一种基于16S rDNA序列为整合位点的am yL重组表达载体,采用原生质体转化法将此重组质粒转化入地衣芽胞杆菌CBBD302中,通过16S rDNA序列实现BLA编码基因的整合与基因扩增,由此获得了BLA生产水平显著提高的重组菌。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 Escherchia coliJM109(CI CIMB0012)、Escherchia coliJM109(pLakr)、B acillus lichenifor m isCBBD302由江南大学中国高校工业微生物资源与信息中心(http://cicim-cu.jiang nan.edu.cn)提供。pBL-amyL[3]、pSKsym-EryR[4]为本实验室前期构建。
1.1.2 培养基 ①大肠埃希菌和地衣芽胞杆菌的培养基均为LB培养基,需要时加入卡那霉素至50μg/mL或红霉素至150μg/mL用于重组大肠埃希菌筛选,加入适量红霉素用于地衣芽胞杆菌的筛选;②地衣芽胞杆菌转化用培养基:416#培养基、2×S MM、Penassy培养基、S MMP、40%的PEG6000以及再生培养基DM3均参考文献[5]配置;③发酵培养基:玉米浆40 g/L,硫酸铵30 g/L,乳糖30 g/L;调pH 7.0。发酵试验在250 mL三角瓶中进行,培养基装液量为50 mL,200 r/min摇床培养120 h。
1.1.3 主要试剂 DNA限制性内切酶EcoRⅠ、Sm aⅠ、B amHⅠ、B glⅡ、PstⅠ以及卡那霉素、红霉素、PEG6000,上海生工生物工程技术服务有限公司;T4DNA连接酶,深圳晶美生物工程有限公司;X-Gal、IPTG,宝生物工程有限公司;PCR产物(小量)纯化试剂盒、胶回收试剂盒,博大泰克公司;其他试剂药品皆为国产或进口的分析纯和生化试剂。
1.1.4 主要仪器 PCR扩增仪(B IO-RAD公司生产),紫外分光光度计(UN ICO公司生产产品,型号UV-2000),垂直板状电泳系统(B IO-RAD公司生产),Alpha Innotech凝胶成像系统(美国Alpha Innotech公司生产),台式高速离心机(美国Sigma公司生产,型号1-15),台式高速冷冻离心机(美国Sigma公司生产,型号4K15)。
1.2 方法
1.2.1 DNA操作技术 地衣芽胞杆菌染色体DNA的提取,质粒提取、酶切,大肠埃希菌感受态制备、CaCl2法转化等操作参照文献[6]进行。DNA片段胶回收、PCR产物纯化用博大泰克试剂盒进行。B.lichenifor m is16S rDNA的PCR通用引物L1:AGAGTTTGATCCTGGCTCAG、L2:ACGGCTACCTTGTTACGACTT,PCR反应基本条件:95℃,5 min;94℃,50 s,56℃,90 s,72℃,60 s,35个循环;72℃,10 min。
1.2.2 原生质体的转化 参照文献[7]的方法,并根据B.licheniformis CBBD302的特性对原生质体制备和转化条件进行了优化。挑取单菌落接种于25 mL 416#培养基中,过夜培养。转接1 mL到新鲜的416#培养基中,振荡培养约4 h。离心收集菌液,用5 mL S MMP悬浮菌体,加入适量溶菌酶,37℃培养至90%的细胞变为原生质体,1 900 r/min离心10 min。弃上清,将收集的菌体重悬于5 mL S MMP中,随后依次加入5~10μL质粒、等体积的2×S MM缓冲液和2 mL 40%PEG6000,轻轻混匀后,再加入10 mL的S MMP,2 000 r/min离心10 min。弃上清,再加入500μL S MMP,30℃,100 r/min培养150 min。涂布于含抗性的DM3再生培养基上。
1.2.3 高温α-淀粉酶酶活的测定以及表达产物的SDS-PAGE分析 高温α-淀粉酶酶活测定参照国家行业标准QB/T2306-97进行[8]。1个酶活单位定义为在90℃、pH 6.0的条件下1 min液化1 mg淀粉成为糊精所需的酶量。酶活以1 mL发酵液中的高温α-淀粉酶酶活计算,用U/mL表示。SDS-PAGE分析参照文献[6]进行。
2 结 果
2.1 整合表达通用性质粒pBli16s-amyL-EryR的构建
以B.licheniform is染色体DNA为模板,用通用引物L1、L2扩增出B.licheniform is的16S rDNA,纯化后与经Sm aⅠ酶切的载体pLakr连接,连接产物转化E.coliJM109感受态细胞,在含有50μg/mL卡那霉素的蓝白平板上筛选阳性转化子,获得重组质粒pLa-Bli16s。重组质粒pLa-Bli16s经B amHⅠ酶切、pBL-amyL经BglⅡ酶切后胶回收1.88 kb的am yL片段,两者连接并转化E.coliJM109,在含有50μg/mL卡那霉素的淀粉平板上筛选阳性转化子,获得转化子pB-li16s-amyL,并提取质粒用PstⅠ酶切验证。将pB-li16s-amyL用Sm aⅠ酶切,pSKsym-EryR经Sm aⅠ酶切回收1.1 kb的EryR片段,两者连接并转化E.coliJM109,在含有50μg/mL红霉素的淀粉平板筛选阳性转化子,得到整合表达质粒pBli16samyL-EryR(图1)。
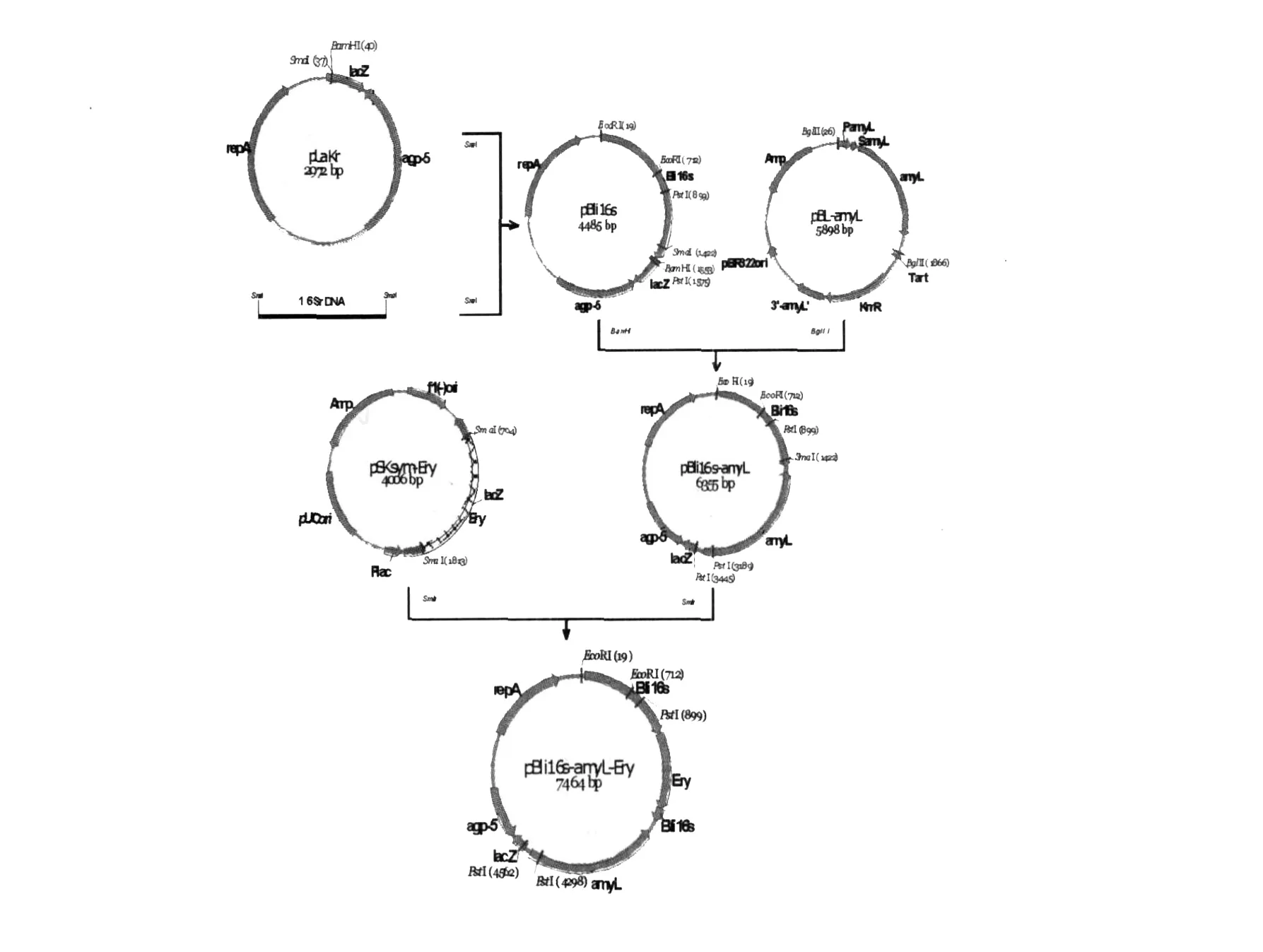
图1 整合表达通用性质粒pBli16s-amyL-EryR的构建Fig.1 Construction of the common integrated expression plasmid pBli16s-amyL-EryR
2.2 原生质体转化
用带有卡那、红霉素抗性的质粒pBli16samyL-EryR转化B.licheniform isCBBD302。将所得的转化子分别点种到无抗和含有卡那霉素、红霉素双抗的淀粉平板上,观察透明圈大小,挑取透明圈较原菌大的菌落分离纯化、发酵测酶活,酶活比原菌高10%及以上的即为阳性转化子。地衣芽胞杆菌原生质体再生困难、限制修饰系统复杂等特殊生理、遗传性状,使其分子改良难度大大提高[9],其遗传转化至今仍是一大难点。实验表明,相同条件下选择对数中后期的菌体有利于原生质体的再生;在制备原生质体时,溶菌酶终浓度为1μg/mL,作用时间为25~30 min,原生质体形成约90%,其转化子数量最多为20~50 cfu/μgDNA;当原生质体形成率成过高或过低,都不利于原生质体的转化或再生;在整个转化过程中动作要轻柔,采用低速离心,防止原生质体破裂。发酵试验表明,再生平板上长出的转化子假阳性极高,可能是在原生质体形成和再生过程中细胞壁结构破坏,使抗生素筛选效果大大降低。
2.3 整合表达目的基因拷贝数的提高
本实验采用地衣芽胞杆菌16S rDNA作为同源臂进行整合,而在地衣芽胞杆菌染色体上16S rDNA的整合位点有几十个,大大提高了整合转化的效率,而且可以反复转化,以提高目的基因的拷贝数。但是由于原生质体转化效率低、假阳性高,因而本实验采用在一定范围内提高液体培养基中抗生素的使用浓度,增加新生子代染色体中同源序列不等位交换,从而增加目的基因在宿主染色体上的基因拷贝数(图2)。在原生质体转化获得的阳性转化子中,随机挑取20株在含不同浓度红霉素的LB培养基上进行培养与诱导,并转接发酵培养基。酶活测定结果如表1所示。

图2 α-高温淀粉酶在染色体上的扩增模式Fig.2 The multiplication mode of thermophilicα-amylase in Chromosomes
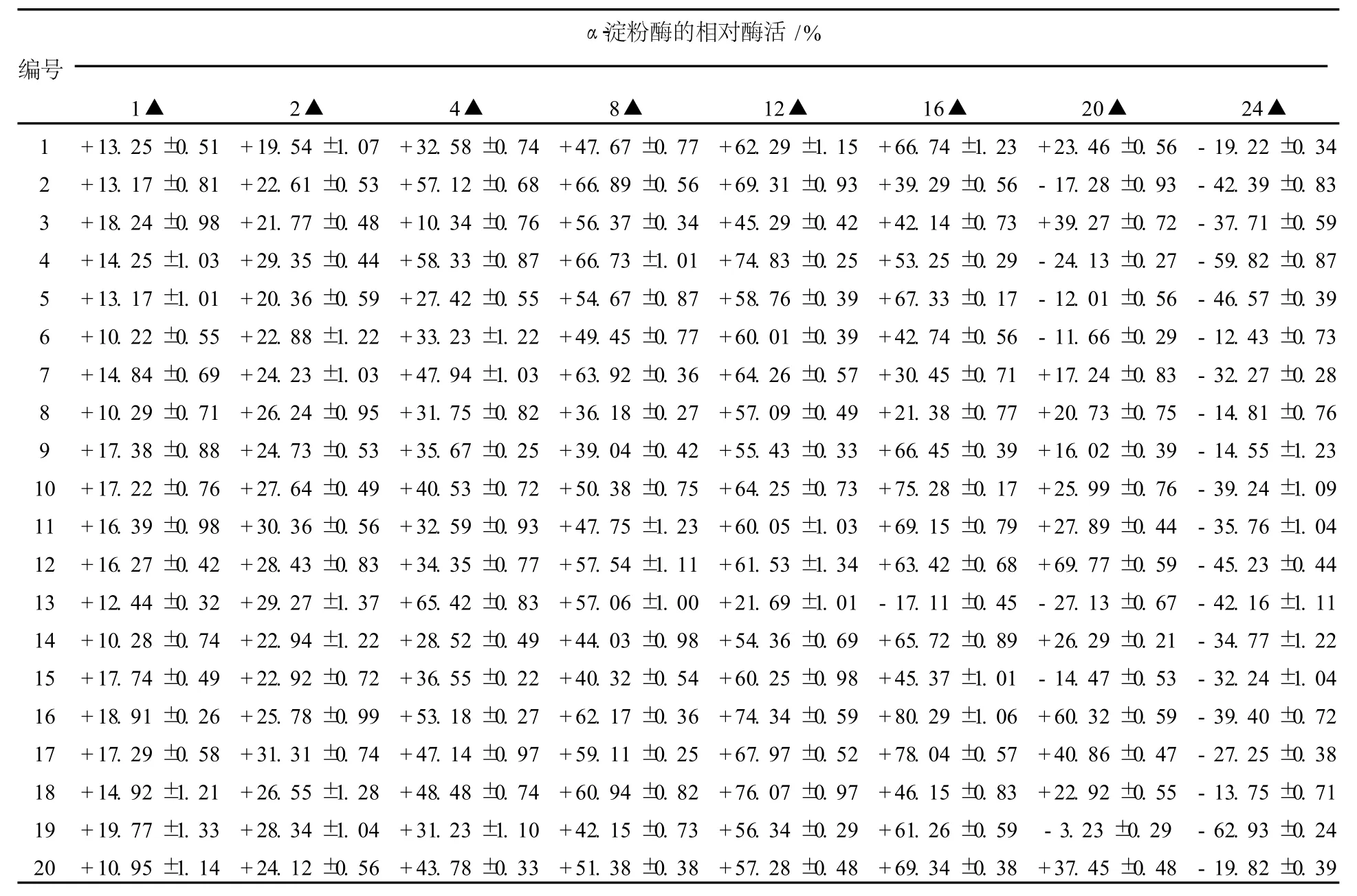
表1 转化子在不同浓度红霉素诱导下的α-淀粉酶相对活力Table 1 Relativeα-amylase activity of transformations in induction of different concentrations of erythromycin
由表1可知:不同的转化子对抗性的敏感性不同,在不同浓度红霉素的诱导下,转化子酶活提高了56.37%~80.29%。在低浓度下,酶活随着抗性增加而非线性提高,这是因为淀粉酶基因胞外分泌表达受到转录调节、翻译效率、肽链折叠等诸多因素影响;红霉素浓度过高,抑制转化子生长或产生不可逆的变化,使其酶活大大降低。
2.4 表达产物的SDS-PAGE分析
取酶活最高的发酵液与原菌做SDS-PAGE分析表明,目的条带大小与报道的地衣芽胞杆菌高温α-淀粉酶分子量55 ku左右相一致,胞外产BLA水平明显提高(图3)。由于BLA的大量分泌表达,胞外其他蛋白分泌量也发生了变化。

图3 发酵液的SDS-PAGE分析Fig.3 SDS-PAGE profile of the proteins in broth
3 讨 论
通过基因工程手段提高淀粉酶分泌的方法主要有强化启动子功能、提高基因拷贝数等。Paval等[10]通过提高α-淀粉酶基因拷贝数,使枯草芽胞杆菌野生菌株α-淀粉酶分泌能力提高了2 500倍;牛丹丹等[11]通过多拷贝游离质粒和染色体整合分别将大肠埃希菌、地衣芽胞杆菌分泌的β-甘露聚糖酶活提高了15~18倍和5~7倍;Waldeck J等[12]通过多拷贝游离质粒载体表达异源淀粉酶基因发现突变株表达异源淀粉酶的水平明显提高,同时细胞自身表达的蛋白酶活力也显著提高。实验证明提高酶编码基因拷贝数是提高其合成与分泌的最有效方法之一。从理论上讲,抗性浓度增加,目的基因的拷贝数增加,酶活会相应提高,但是目的基因的分泌表达是个极为复杂的过程,受到操纵子调控、细胞监控、能量再生、分泌调控等因素限制,因此找到不同转化子的最合适的抗性是实现目的基因高效表达的关键。本实验正是试图通过改变培养基中抗性使用浓度,筛选出目的基因的高效表达的转化子。最终转化子在其合适的抗性浓度下酶活都得到了较大的提高,为56.37%~80.29%。此外,通过SDS-PAGE分析表明地衣芽胞杆菌胞外分泌表达量可能存在极限。
[1] 潘风光,柳增善,刘海学,等.地衣芽胞杆菌耐高温α-淀粉酶基因工程菌的研究进展[J].内蒙古民族大学学报,2004,35(1):42-44.
[2] NiuDD,Zuo ZR,Shi GY,et al.High yield recombinant thermostable alpha-amylase production using an improved Bacillus licheniform issystem[J].Microbiol Cell Factories,2009,8(1):58-63.
[3] 牛丹丹,石贵阳,王正祥.通过同源介导α-淀粉酶基因扩增改良地衣芽胞杆菌α-淀粉酶生产菌株[J].生物工程学报,2009,3:375-380.
[4] 刘大伟,牛丹丹,张梁,等.便于抗性基因分离和分子重组的系列质粒的构建[J].微生物学通报,2007,34(5):926-928.
[5] Bianca W,Jens W,Susanne W,et al.Generation of readily transformable Bacillus licheniform ismutants[J].ApplMicrobiol Biotechnol,2008,78:181-188.
[6] 奥斯伯FM,金斯顿RE,塞德曼JG,等.精编分子生物学实验指南[M].北京:科学出版社,2008:42-50.
[7] Chang S,Cohen S.High frequency transformation ofBacillus subtilisprotoplasts by plasmid DNA[J].Mol Gen Genet,1979,168:111-115.
[8] 姜锡瑞.段钢.酶制剂实用技术手册[M].北京:中国轻工业出版社,2002:396-403.
[9] Er win HD,Dobek W,Ludolf GB,et al.Novel methods for genetic transformation of natural Bacillus subtilisisolates used to study the regulation of the mycosubtilin and surfactin synthetases[J].Appl Environ Microbiol,2007,73:3490-3496.
[10] Palva I.Molecular cloning of alpha-amylase gene from Bacillus amyloliquefaciensand its expression in B.subtilis[J].Gene,1982,19:81-87.
[11] Waldeck J,Rammes H M,Wieland S,et al.Targeted deletion of genes encoding extracellular enzymes in Bacillus licheniform is and the impact on the secretion capability[J].J Biotechnol,2007,130:124-132.
[12] Dandan Niu,Zheng-Xiang.Wang Development of a pair of bifunctional expression vectors for Escherichia coliand Bacillus lichenifor m is[J].J Ind Microbiol Biotechnol,2007,34:357-362.
