胶原模拟多肽三螺旋结构的热变性过程
2010-01-11刘玲蓉陈名懋杨文智张其清
刘 刘玲蓉陈名懋杨文智张其清
1中国医学科学院 北京协和医学院 生物医学工程研究所天津市生物医学材料重点实验室,天津 300192
2厦门大学 材料学院生物材料系生物医学工程研究中心福建省生物医学工程重点实验室,福建厦门 361005
胶原模拟多肽三螺旋结构的热变性过程
1中国医学科学院 北京协和医学院 生物医学工程研究所天津市生物医学材料重点实验室,天津 300192
2厦门大学 材料学院生物材料系生物医学工程研究中心福建省生物医学工程重点实验室,福建厦门 361005
胶原蛋白;三螺旋结构;热变性
DO I:10.3881/j.issn.1000-503X.2010.03.023
氨基酸重复序列是很多纤维状蛋白质特征,这些序列促进每种蛋白形成自己的拓扑结构[1]。胶原蛋白 Gly-X-Y肽段的重复出现使得胶原二级结构呈现特征性的聚脯氨酸Ⅱ型 (P2)结构,P2结构进一步形成稳定的三螺旋结构,这是胶原蛋白区别于其他蛋白质的特征性结构[2]。胶原蛋白的三螺旋结构在机体生命活动中发挥着极为重要的作用,胶原缺失及三螺旋结构改变会导致多种人类疾病发生[3]。本研究以具有氨基酸重复序列的胶原模拟多肽 (collagen mimetic peptides,CMP),即 (Gly-Pro-Hyp)7作为胶原蛋白三螺旋结构模型分子,采用圆二色谱和傅立叶红外光谱两种光谱学方法对其三螺旋结构及热诱导变性过程进行研究,旨在进一步认识胶原蛋白三螺旋结构受温度影响的相关机制。
材料和方法
材料和仪器 CMP(上海吉尔生化有限公司),D2O (青岛腾龙微波科技有限公司),CaF2窗片(32 mm×3 mm,天津港东科技有限公司);JASCO J-810圆二色谱仪 (日本 JASCO公司),Nicolet IS-10系列傅立叶变换红外光谱仪 (美国 Nicolet公司)。
圆二色谱分析 配制浓度为 0.2 g/L的 CMP重水稀溶液,将其注入 1 mm光径的石英池,于 190~260 nm范围内进行扫描,各参数设定如下:分辨率0.1 nm,扫描速率 100 nm/min,狭缝宽度 1 nm,响应时间 1 s,灵敏度 standard(100 mdeg),记录结果为 3次扫描平均值。
傅立叶红外分析 将 CMP溶于重水配制终浓度为 5 g/L的溶液,将 CMP溶液于 4℃放置 48 h后进行红外光谱检测。光谱采集采用 Nicolet公司液体变温附件,窗片之间距离为 25μm,将 40μl样品溶液注入 CaF2晶体窗片之间后密封。扫描条件设置为:扫描次数 64次,分辨率 2 cm-1,在不同温度条件下测量 CMP溶液位于 1 700~1 600 cm-1的光谱。得到的谱图在OM I NC软件下进行数据处理,应用溶剂峰差减和傅立叶去卷积等方法进行数据处理,对处理后红外谱线进行高斯/洛仑兹拟合。
结 果
圆二色谱分析结果 20℃时,CMP正峰出现在约 225 nm处,负峰出现在约 198 nm位置;随着温度升高,正负峰强度均有所减少并发生红移,负峰红移幅度大于正峰 (图 1)。225 nm处 CD值-温度曲线在 30~50℃范围内发生明显突跃;20℃时 CMP的圆二色谱谱峰正峰强度与负峰强度比值 (Rpn值)为0.104;升至 30℃以上时 CD谱峰型发生强烈改变,正峰和负峰强度都急剧减小,Rpn值也大幅度降低;50℃以后 Rpn值降低幅度减缓;80℃时降至 0.01;Rpn值-温度曲线的突跃中点约为 43℃,与 225 nm处CD值-温度曲线重叠效果良好 (图 2)。CMP在冷却过程中后其正负峰强度均有大幅度提高,负峰明显蓝移,CMP发生 “单体-三螺旋”转变;4 h后整个谱型与加热前相比几乎一致,Rpn值由最初的 0.01升至 0.106(图 3)。
傅立叶红外光谱分析结果 CMP红外光谱酰胺Ⅰ带吸收结果显示,1 645 cm-1和1 672 cm-1处有两个明显主峰,1 630 cm-1处有 1个肩峰;随着温度升高,1 645 cm-1处的吸收强度明显降低,但没有明显峰位移现象发生,1 630 cm-1和1 672 cm-1处吸收强度降低幅度不大 (图 4)。FTIR-温度曲线显示,15℃时 CMP在1 645 cm-1处具有最强吸收值 0.071,30℃以后吸收强度下降趋势加快,60℃时吸收强度已降至 0.045,整个酰胺Ⅰ带的吸收强度随温度升高逐渐降低,与圆二色谱所表示的热变性曲线具有相同的突跃区间并重叠情况良好,可得出变性温度 Tm≈42℃(图 5)。FTIR反应的 CMP复性结果显示,冷却过程中1 645 cm-1处的吸收强度逐渐增强,4 h后1 645 cm-1处吸收强度达到最大值 (图 6)。对 CMP红外谱图进行溶剂峰差减、二阶求导、去卷积和峰分辨拟合处理后结果显示,CMP酰胺Ⅰ带被拟合为 3个子峰,分别位于1 645 cm-1、1 630 cm-1和1 672 cm-1处 (图 7)。
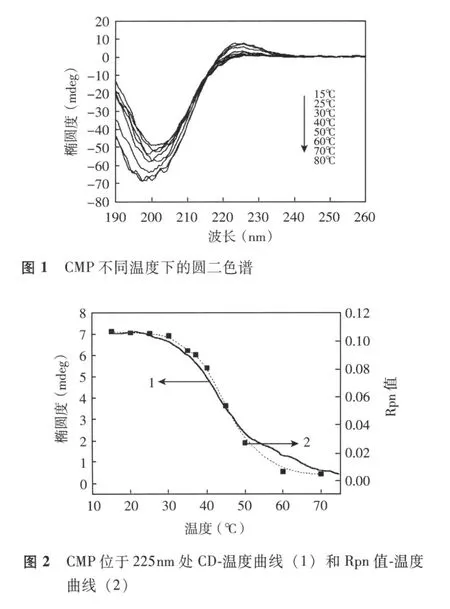
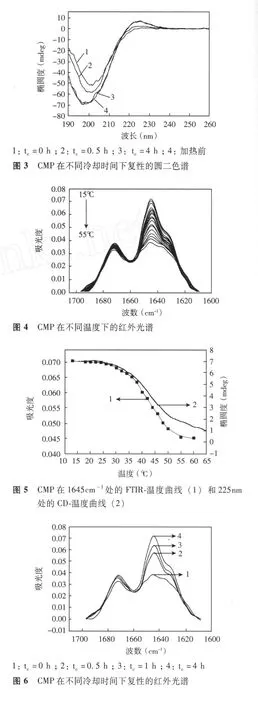
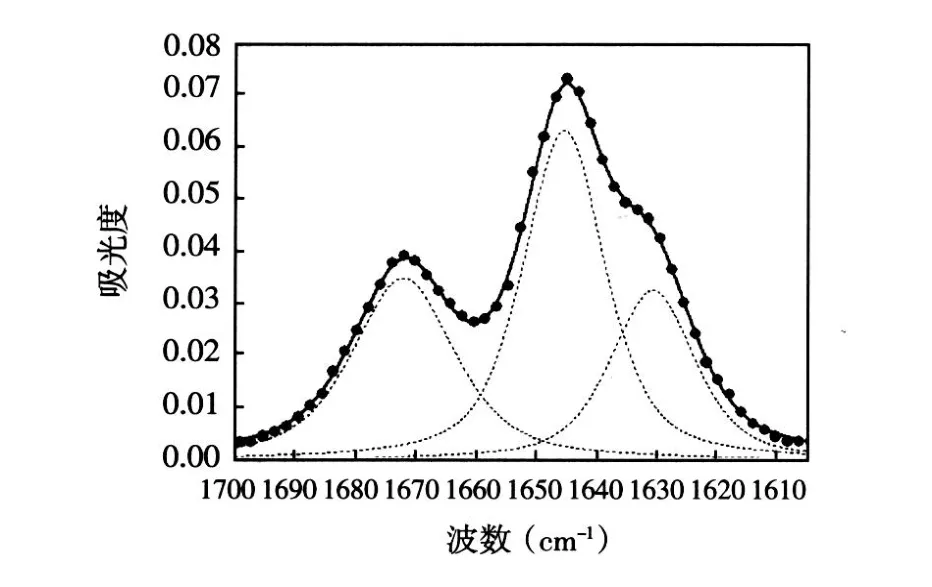
图 7 CMP在重水溶液中的红外实验谱图 (点)与红外拟合谱图 (粗线为叠加谱,虚线为分峰谱)
讨 论
生物体内组成蛋白质的 20种氨基酸,除最简单的甘氨酸不具有手性外,其余都是 L型,加之肽键的不对称性,蛋白质分子具有手性,也具有光学活性,其 CD光谱中在紫外区段有特征峰,可用于解析蛋白质分子或多肽序列主链的构象[4]。胶原蛋白的Rpn值通常被用来确定胶原蛋白的溶液构象,正负峰强度比值变化在一定程度上能够反映胶原蛋白三螺旋结构的变化[5]。由于 Rpn值能够反映整个远紫外区正、负两峰的变化情况,比单独依靠正峰强度变化能够更真实地反映多肽链在热变性过程当中发生的构象变化,并且实验证明 Rpn值-温度曲线与CD值-温度曲线重叠良好,因此利用 Rpn值-温度曲线表示多肽链热变性过程所反映的三螺旋结构变化信息应当更为全面。
由 CMP的 CD谱和 FTIR谱分析可知,在适当温度下 CMP可发生 “单体-三螺旋”结构的可逆变化。CMP在水溶液当中能组装为高度有序的三螺旋结构[6-7],并且其构象具有温度依赖性,高温处理后的CMP能够在适当条件下实现结构的可逆恢复。
氢键对于稳定胶原蛋白三螺旋结构具有重要作用,其中胶原蛋白肽链间的主要氢键作用力为 Gly-X-Y中 Gly酰胺基上的 H与相邻另一条肽链 Gly-X-Y中 X上的羰基之间的氢键,胶原蛋白受温度诱导的变性常伴随着氢键的断裂和三螺旋结构丧失。然而由于胶原大分子氨基酸组成种类较多,氢键作用力关系复杂,不利于阐述 “结构-作用力”的相关机制,本研究以合成的胶原模拟多肽 CMP为胶原三螺旋结构的模型分子,通过 FTIR研究其热变性过程并分析稳定三螺旋结构氢键作用力的相关信息,这对于研究胶原蛋白三螺旋结构受温度影响的相关机理具有重要指导作用。
羰基参与稳定三螺旋结构的氢键作用,酰胺Ⅰ带是三类羰基综合作用的结果,每个羰基的红外吸收变化都会引起酰胺Ⅰ带的峰型变化[8-9]。酰胺Ⅰ带吸收谱型的改变与羰基伸缩振动情况的变化有关,由于序列中 3种氨基酸的羰基所处溶液环境不同,而氢键作用力对羰基伸缩振动影响较大,反映在红外谱图中应当具有不同的红外吸收谱型。针对这种情况,本研究对 CMP红外谱图进行了溶剂峰差减、二阶求导、去卷积和峰分辨拟合处理,结果显示CMP酰胺Ⅰ带被拟合为 3个子峰,分别位于1 645 cm-1、1 630 cm-1和 1 672 cm-1处 , 并分别代表 Pro、Gly和 Hyp的羰基吸收情况[10],由于 Pro羰基对1 645 cm-1的红外吸收贡献最大,Pro对应的链内氢键作用力的变化情况反映在红外谱图上为1 645 cm-1处的吸收强度变化。
Doyle等[11]研究认为,三股螺旋之间通过氢键稳定,其中最重要的氢键是 Pro的羰基与另一条链上Gly的氨基之间形成的 (CPOP…NGHG),CPOP…NGHG是参与形成三股螺旋内氢键,Gly和 Hyp的羰基都朝向三股螺旋的外部,与溶液的水分子形成氢键 (分别为 CGOG…HwOw和 CYOY…HwOw)。由于1 645 cm-1处的红外吸收对应 Pro羰基的伸缩振动情况,而 Pro主要参与链内氢键作用,因此,随着温度升高,1 645 cm-1处的吸收强度大幅度减少,显示Pro羰基子峰的吸收强度降低,CPOP…NGHG的数量减少,链内氢键逐渐解离,发生三螺旋向单体的转变[12]。Gly和 Hyp主要参与 CMP水分子之间氢键作用,因此1 630 cm-1和1 672 cm-1处吸收强度随着温度升高,降低幅度不大,说明三螺旋结构的改变对于 CGOG…HwOw和 CYOY…HwOw的影响不是很大。以上分析表明,Pro的羰基与异链 Gly的氨基之间形成的 (CPOP…NGHG)是稳定三螺旋结构的主要作用力,利用红外光谱能够有效分析 CMP三螺旋结构热变性过程的结构变化信息,并且与 CD相比能够更确切地反映稳定肽链构象氢键作用力的变化情况。
[1] Parry DA.The molecular and fibrillar structure of collagen and its relationship to the mechanical properties of connec-tive tissue[J].Biophys Chem,1988,29(1-2):195-209.
[2] Holmgren SK,Bretscher LE,Taylor K M,et al.A hyperstable collagen mimic[J].Chem Biol,1999,6(2):63-70.
[3] Koide T.Designed triple-helical peptides as tools for collagen biochemistry and matrix engineering[J].Philos Trans R Soc Lond B Biol Sci,2007,362(1484):1281-1291.
[4] Sreerama N,Woody RW.Estimation of protein secondary structure from circular dichroism spectra:comparison of CONTI N,SELCON,and CDSSTR methodswith an expanded reference set[J].AnalBiochem,2000,287(2):252-260.
[5] Usha R,Ramasami T.Structure and conformation of intramolecularly cross-linked collagen[J].Colloids Surf B Biointerfaces,2005,41(1):21-24.
[6] Kar K,Amin P,BryanMA,et al.Self-association of collagen triple-helix peptides into higher order structures[J].J Biol Chem,2006,281(44):33283-33290.
[7] Persikov AV,Ramshaw JA,Brodsky B.Prediction of collagen stability from amino acid sequence[J].J Biol Chem,2005,280(19):19343-19349.
[8] George A,Veis A.FTIRS in H2O demonstrates that collagen monomers undergo a conformational transition prior to thermal self-assembly in vitro[J].Biochemistry,1991,30(9):2372-2377.
[9] Bryan MA,Brauner JW,Anderle G,et al.FTIR studies of collagen model peptides:complementary experimental and simulation approaches to conformation and unfolding[J].J Am Chem Soc,2007,129(25):7877-7884.
[10] Lazarev YA,GrishkovskyBA,Khromova TB.Amide Iband of IR spectrum and structure of collagen and related polypeptides[J].Biopolymers,1985,24(8):1449-1478.
[11] Doyle BB,Bendit EG,Blout ER.Infrared spectroscopy of collagen and collagen-like polypeptides[J].Biopolymers,1975,14(5):937-957.
[12] Payne KJ,VeisA.Fourier transform IR spectroscopy of collagen and gelatin solutions:deconvolution of the amide I band for conformational studies[J].Biopolymers,1988,27(11):1749-1760.
张其清 电话:022-87890868,电子邮件:zhangqiq@126.com
Q518.4
A
1000-503X(2010)03-0343-04
国家重点基础研究发展计划项目 (973计划)(2006CB933300)
2009-05-11)
·论 著·
