卡拉胶寡糖的制备及其生物活性的研究
2010-01-08吴海歌王艳预姚子昂
吴海歌,王艳预,姚子昂
(大连大学生物工程学院辽宁省生物有机化学重点实验室,辽宁大连 116622)
卡拉胶寡糖的制备及其生物活性的研究
吴海歌,王艳预,姚子昂
(大连大学生物工程学院辽宁省生物有机化学重点实验室,辽宁大连 116622)
对卡拉胶的降解条件、降解获得的卡拉胶寡糖的理化性质及其抗肿瘤活性进行了研究。结果表明,60℃下用0.5%硫酸降解1%的卡拉胶,可以得到比较均匀、分子量大小不等的多种卡拉胶寡糖。用这种方法获得的卡拉胶寡糖对结肠癌细胞DLD1生长的抑制作用远远强于相同浓度的卡拉胶,为拓宽卡拉胶的应用提供了实验依据。
卡拉胶;卡拉胶寡糖;降解;生物活性
卡拉胶(Carrageenan)是从某些红藻的细胞壁中提取的一种硫酸半乳聚糖,具有以1,3-β-D-半乳糖和1,42α-D-半乳糖交替连接形成的骨架结构,根据半乳糖中是否含有内醚以及半乳糖上硫酸基的数量和连接位置不同 ,可分为κ2、μ2、ι2、θ2、λ2、ε2、ν2七种类型 ,常见的是κ2、ι2和λ2型[1]。卡拉胶具有抗病毒、抗肿瘤、抗凝血、免疫调节、降血脂等多种生理活性[2~5],但由于粘度大、扩散困难,很难被机体吸收,严重限制了其在生物、医药等领域的应用。研究表明,卡拉胶降解后,可提高其生物利用率并具有独特的生理活性[6]。用稀无机酸作为催化剂进行酸水解是目前最常用的卡拉胶降解方法,但用盐酸等降解会导致硫酸多糖中硫酸基团的脱落,而用硫酸降解可以减少对其结构的破坏[7]。
作者在此采用硫酸降解卡拉胶,研究了卡拉胶酸性降解的条件、降解产物卡拉胶寡糖(CGOS)的理化性质及其抗肿瘤活性。
1 实验
1.1 材料与试剂
卡拉胶,江苏常航胶体科技有限公司;结肠癌细胞DLD1,中国典型生物保藏中心;四甲基偶氮唑蓝(M TT),Sigma公司;小牛血清,杭州四季青公司;RPM I21640培养液,Gibcobrl公司;其它试剂均为国产分析纯。
1.2 方法
1.2.1 卡拉胶的酸性降解
用硫酸对卡拉胶进行降解,考察了硫酸浓度、降解温度、卡拉胶浓度以及酸的强度对卡拉胶降解的影响。降解过程中每隔2 h取出降解样品,用冷水浴冷却至室温,并将p H值调至中性。一部分样品进行薄层层析分析(展开剂为正丁醇∶冰醋酸∶水=2∶2∶ 1;显色剂为苯胺-二苯胺),另一部分样品用DNS(3,52二硝基水杨酸)法测定其还原糖含量,并绘制卡拉胶降解时间-吸光度变化曲线。
1.2.2 卡拉胶寡糖的制备及纯化
配制1%(质量浓度,m/V,下同)卡拉胶溶液,用终浓度(质量浓度,m/V,下同)为0.5%的硫酸在60℃恒温水浴中搅拌水解4 h,然后用冷水浴冷却至室温,并调p H值至中性。将所得的卡拉胶寡糖溶液减压浓缩后,装入截留分子量500的透析袋中透析72 h(除去盐等小分子物质),然后冷冻干燥,获得纯化的卡拉胶寡糖固体。
1.3 分析与测定
1.3.1 卡拉胶寡糖的理化性质
卡拉胶寡糖的平均分子量用端基法[8]测定,粘度用数显粘度计测定,硫酸根含量用明胶-氯化钡法[9]测定。
1.3.2 卡拉胶寡糖对结肠癌细胞生长的影响
采用M TT法检测卡拉胶寡糖对结肠癌细胞生长的影响[10,11]。将处于指数生长期的结肠癌细胞DLD1以2×106个·孔-1的密度接种于96孔板中,37℃、5%CO2培养箱培养24 h后,分别加入终浓度为25μg·mL-1、50μg·m L-1、100μg ·mL-1、200μg·m L-1的卡拉胶和卡拉胶寡糖,每个浓度设4个复孔。将培养板放至37℃、5%CO2培养箱继续培养24 h,然后加入M TT溶液,再培养3 h,弃去培养板中的溶液,加入DM SO溶液,振荡至完全溶解。用酶标仪在570 nm处测定每孔的吸光度,实验重复3次。结肠癌细胞生长的抑制率(R)依下式计算:

式中:A1为空白组的吸光度;A2为卡拉胶或卡拉胶寡糖组的吸光度。
2 结果与讨论
2.1 卡拉胶降解条件的确定
2.1.1 硫酸浓度对卡拉胶降解的影响(图1、图2)

由图1和图2可以看出,硫酸浓度对卡拉胶的降解有一定的影响。硫酸浓度越大,卡拉胶降解得越快。1%硫酸降解卡拉胶的前4 h OD值变化很大,降解反应较快;4 h之后,OD值的变化趋缓,说明卡拉胶大部分被降解成分子量较小的寡糖;24 h之后,卡拉胶几乎全部被降解为单糖等小分子片段。0.5%硫酸降解卡拉胶6 h之后,OD值的变化趋缓,薄层层析结果与1%硫酸降解情况相似。0.1%硫酸降解卡拉胶的速度相对缓慢,降解8 h时只有少量分子量较小的寡糖生成;8 h之后OD值变化趋缓,24 h之后才有大量分子量较小的寡糖生成。综合考虑,选择硫酸浓度为0.5%,既能够满足降解卡拉胶为卡拉胶寡糖的需要,而且反应时间和反应产物较易控制。
2.1.2 温度对卡拉胶降解的影响(图3、图4)

由图3、图4可以看出,温度对卡拉胶降解的影响很大。在50℃降解卡拉胶时,反应缓慢,长时间降解也很少生成分子量较小的寡糖,降解效果不理想;在60℃降解卡拉胶时,反应较温和,卡拉胶能够逐渐被降解成小分子片断;在70℃降解卡拉胶时,反应较为剧烈,降解1 h左右卡拉胶就几乎全部被降解成单糖等小分子片段,之后变化甚微,使得反应产物和反应时间不易控制。因此,选择卡拉胶降解温度为60℃。
2.1.3 卡拉胶浓度对降解的影响(图5、图6)

由图5、图6可以看出,卡拉胶浓度越高,降解反应越慢。综合考虑,选择卡拉胶浓度为1%,不仅反应迅速,产品也易于控制。

图7 不同pH值下降解卡拉胶的吸光度变化曲线Fig.7 Absorbance of carrageenan degraded at different pH value
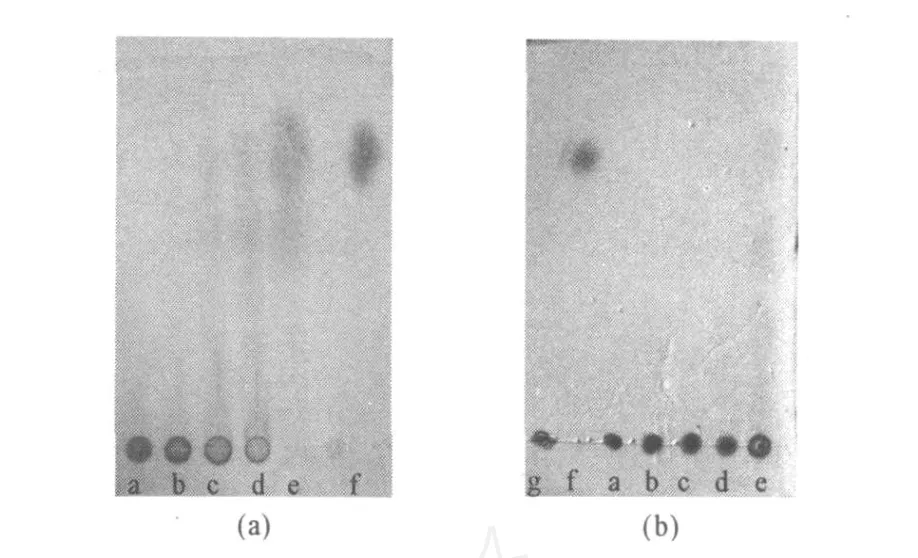
图8 0.5%磷酸(a)和5%醋酸(b)降解卡拉胶的薄层层析图Fig.8 TLC of carrageenan degraded with 0.5%phosphoric acid(a)or 5%acetic acid(b)
2.1.4 p H值对卡拉胶降解的影响(图7、图8)响很大。p H值越小,卡拉胶降解速度越快,降解程度也越高。0.5%硫酸(p H=1)降解卡拉胶4 h时,大部分卡拉胶就被降解为分子量较小的寡糖,OD值的变化趋缓;24 h之后,卡拉胶几乎全部被降解成了单糖等小分子片段。0.5%磷酸(p H=2)降解卡拉胶的速度较慢,OD值变化平缓,降解24 h之后仍然没有全部转化成单糖等小分子片段。5%醋酸(p H=3)降解卡拉胶的程度最弱,降解过程中 OD值变化缓慢,降解24 h才生成很少量分子量较小的寡糖。因此,选择0.5%硫酸(p H=1)用于卡拉胶的降解。
2.2 卡拉胶寡糖的理化性质
2.2.1 一般物理表征
纯化的卡拉胶寡糖为白色粉末状固体,易溶于水,不溶于乙醇、丙酮等有机溶剂。
2.2.2 平均分子量
卡拉胶的分子量一般在 3×105左右,用0.5%硫酸在60℃降解卡拉胶4 h后,其平均分子量大大降低,测得卡拉胶寡糖混合物的平均分子量为1430。
2.2.3 硫酸根含量
卡拉胶降解前后硫酸根的含量由9.98%降低为8.78%,说明温和条件下硫酸降解卡拉胶对结构没有破坏作用,大部分的硫酸根仍然连接在卡拉胶的糖环上。
2.2.4 粘度(图9)
由图9可以看出,0.5%硫酸在60℃降解卡拉胶15 m in后,表观粘度就由3380 m Pa·s降到428 m Pa·s;降解1 h之后,卡拉胶的表观粘度就低于100 m Pa·s。这说明酸性降解卡拉胶在使其分子量大大降低的同时,粘度也大大降低。

图9 卡拉胶降解的粘度变化曲线Fig.9 Change curve of carrageenan viscosity with the degradation time
2.3 卡拉胶寡糖对结肠癌细胞生长的影响(图10)

图10 卡拉胶和卡拉胶寡糖对结肠癌细胞DLD1生长的影响Fig.10 Effects of carrageenan and CGOSon the growth of DLD1
由图10可以看出,相同浓度的卡拉胶寡糖对结肠癌细胞DLD1生长的抑制率明显高于卡拉胶。25~100μg·mL-1的卡拉胶寡糖对结肠癌细胞DLD1生长的抑制作用相差不大,当卡拉胶寡糖的浓度为200 μg·m L-1时,其对结肠癌细胞DLD1生长的抑制率达到了20%。由此可见卡拉胶被降解为卡拉胶寡糖后,其生物活性会有一定的改善,这为拓宽卡拉胶乃至更多海洋多糖的应用奠定了基础,值得深入研究。
3 结论
对卡拉胶的降解条件、降解获得的卡拉胶寡糖的理化性质及其抗肿瘤活性进行了研究。结果表明,在60℃下用0.5%硫酸降解1%的卡拉胶可以得到比较均匀、分子量大小不等的多种卡拉胶寡糖。用这种方法获得的卡拉胶寡糖对结肠癌细胞DLD1生长的抑制作用远远强于相同浓度的卡拉胶,为拓宽卡拉胶的应用提供了实验依据。
[1]纪明候.海藻化学[M].北京:科学出版社,1997:117-187.
[2]Girond S,Crance JM,Van Cuyck-Gandre H,et al.Antiviral activ- ity of carrageenan on hepatitis A virus replication in cell culture[J].Res Virol,1991,142(4):261-270.
[3]Coombe D R,Parish C R,Ramshaw IA,et al.Analysis of the in- hibition of tumour metastasis by sulphated polysaccharides[J].Int J Cancer,1987,39(1):82-88.
[4]Noda H,Amano H,Arashima K,et al.Studies on the antitumor activity of marine algae[J].Nippon Suissan Gakkaishi,1989,55:1259-1264.
[5]Guven K C,Ozsoy Y,Ulutin O N.Anticoagulant,fibrinolytic and antiaggregant activity of carrageenans and alginic acid[J].Botani- ca Marina,1991,34(5):429-432.
[6]徐强,管华诗.卡拉胶研究的发展及现状[J].青岛海洋大学学报,1995,(海洋药物专辑):117-124.
[7]王长云,顾谦群,周鹏,等.红藻多糖卡拉胶分子修饰研究Ⅰ.酸降解[J].中国海洋药物,2003,22(2):24-27.
[8]张惟杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987:56.
[9]邱芳萍,张玲,于健.硫酸钡比浊法对鹿茸多糖中硫酸基含量的测定[J].长春工业大学学报(自然科学版),2005,26(4):268-270.
[10]岑颖洲,马夏军,王凌云,等.羊栖菜多糖的制备及其对 Hep G-细胞的抑制作用[J].中国海洋药物,2005,24(1):21-24.
[11]邓守恒,孙各琴,朱名安,等.硒化壳聚糖对NB4细胞作用的实验研究[J].广东微量元素科学,2006,13(1):23-26.
Preparation of Carrageenan Oligosaccharidesand Study on Its Biological Activity
WU Hai-ge,WANGYan-yu,YAO Zi-ang
(Key Lab of Bioorganic Chemistry of Liaoning Province,College of Bioengineering,Dalian University,Dalian 116622,China)
The degradation condition for carrageenan,the physico-chemical property and anticancer activity of carrageenan oligosaccharides(CGOS)obtained w ere studied.The results show ed that w hen 1% carrageenan was degraded with 0.5%sulphuric acid at 60℃,the products were uniform and the CGOS were inequality of size.The inhibition rate of colon carcinoma cell DLD1 by CGOS was much higher than that by carrageenan.It provides experimental reference to widen the application of carrageenan.
carrageenan;carrageenan oligosaccharides;degradation;biological activity
Q 533
A
1672-5425(2010)06-0037-04
国家自然科学基金资助项目(30901875),辽宁省教育厅科技资助项目(2008050)
2010-01-26
吴海歌(1975-),女,辽宁大连人,博士,副教授,研究方向:海洋生物化工;通讯作者:姚子昂,教授。E-mail:ziangyao@163.com。
