宣威肺癌高发区室内PM10对肺泡上皮细胞凋亡的影响
2010-01-07邵龙义刘君霞宋晓焱中国矿业大学北京地球科学与测绘工程学院煤炭资源与安全开采国家重点实验室北京100083
周 林,邵龙义,刘君霞,宋晓焱 (中国矿业大学(北京)地球科学与测绘工程学院,煤炭资源与安全开采国家重点实验室,北京 100083)
云南省宣威地区农村的肺癌发病率居全国之首,其中尤以女性肺癌发病率高,在世界女性肺癌死亡率水平中亦属前列[1-2].目前,国内外学者对宣威肺癌高发原因及影响因素进行了一系列的研究,发现宣威农村肺癌的高发病率与家庭使用烟煤高度相关;吸烟并不能解释宣威肺癌特殊的流行病学特征,吸烟者肺癌发病率和死亡率在肺癌高发区和地发区、男女之间的差异无统计学意义;以烟煤和木柴为生活燃料的家庭室内可吸入颗粒物浓度高,宣威肺癌高发地区长期燃烧煤烟造成室内以苯并芘(Bap)为主的多环芳烃类物(PAH)污染是宣威肺癌高发的主要原因之一;基因检测研究表明,宣威肺癌患者中存在肺癌易感基因;宣威肺癌的产生可能与所使用的烟煤及其产物中所含的微纤维状石英有关[3-11].
肺泡上皮细胞(AEC)是颗粒物接触和沉积的最初靶细胞,是肺组织最有可能受到颗粒物的毒性损害的细胞,同时AEC在肺癌的发生中具有重要的作用[12].目前宣威肺癌的研究尚未有直接针对肺泡上皮细胞的研究,尤其是 PM10对肺泡上皮细胞的毒性损害研究,对于进一步研究肺癌发病机制具有重要意义.
本研究通过肺上皮细胞 A549建立PM10体外染毒模型,应用Annexin V/PI双染色FCM研究宣威肺癌高发地区室内PM10对人肺泡上皮细胞A549的凋亡的影响.
1 材料与方法
1.1 材料
硫酸亚铁 D MEM 培 养液(Gibco,USA),胎牛血清(天津TBD公司),青链霉素(Invitrogen, USA),胰蛋白酶(Amresco,USA),台盼蓝(Sigma分装,USA), 四甲基偶氮锉蓝(MTT Amresco, USA),AnnexinV-FITC/PI试剂盒(北京宝赛公司),二甲基亚砜(DMSO Amresco,USA)等.实验所用的人肺泡上皮细胞由北京大学医学部提供.用含 l0%的胎牛血清和青链霉素双抗 DMEM 养液,37℃,5%CO2,饱和湿度条件下培养,细胞融合80%时,分别用0.5%和0.25%的胰蛋白酶消化,传代用于实验.
1.2 采样地点
采样地点之一的肺癌高发区虎头村位宣威市近郊的来宾镇,海拔 1859.8m,位于虎头山的北坡,背南风,空气不流通,主导风向为西南风,附近有长征煤矿、燕塘煤矿等 5家较大的煤矿,以品质较低的烟煤为主.虎头村村委会下辖 9个自然村,约4000多人,2007年有20多人死于肺癌,其中虎头村最为严重,约10人左右死于肺癌.在虎头村随机选取3户有肺癌患者家庭采样,这3户人家主要生活燃料是来自于附近煤矿的烟煤,日常做饭、取暖均使用采用开放式“火塘”,“火塘”没有烟囱和炉桥,上口与地面平行.由于缺乏通风装置,室内烟尘浓度很高,在一些家庭堂屋内监测到总悬浮颗粒物浓度可达20mg/m3.
作为对照的采样点位于西泽乡宁家湾村,属于肺癌低发区域,距离宣威市区 30km左右,附近无煤矿及其他污染企业,村民生活燃料普遍以木柴为主,少量使用无烟煤,采样家庭有独立厨房,有通向室外的烟囱.宁家湾村民呼吸系统疾病患病率低,2000年以来无肺癌患者.
1.3 样品的采集及处理
采样时间为2008年12月25日~2009年1月28日.其中虎头村采样22d,宁家湾村采样7d.采样仪器:KB80-E型采样泵(青岛崂山电子),粒度切割器(Negretti,UK)以及孔径为0.67μm,直径为47mm 的聚碳酸酯滤膜(Millipore,USA).在客厅距地面 120cm放置采样仪.采样流量为30L/min,12h连续采集室内 PM10样品,同时记录采样点温度、气压、湿度、室内生活状况等要素.温度和湿度由温度/湿度监测器(Oregon Scientific,UK)测得.采集部分样品用于细胞染毒试验.试验样品参数如表1所示.
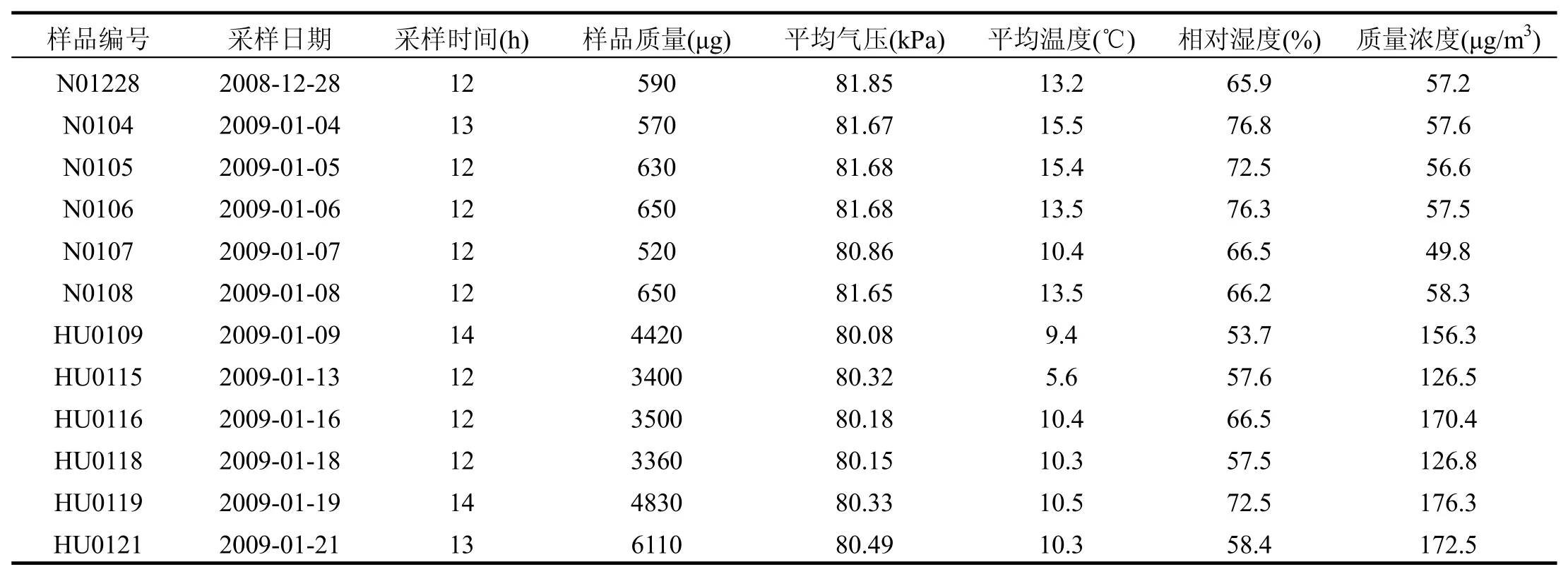
表1 实验样品参数Table 1 Parameters of samples
将样品干燥,用干净消毒的手术剪称重后的滤膜剪碎,置于15mL的洁净离心管中,加入5mL HPLC级水(Fisher化学公司,UK),封口膜封口,放在涡旋振荡器(Scientific Indus-tries,Vortex Genie 2)上轻轻振荡6h,然后移出溶液,在滤膜中重新加入5mL HPLC级水,再一次振荡6h,使颗粒物尽可能地从滤膜上分离开来,并将 2次振荡的溶液移到一个离心管中;取出滤膜,在通风橱内自然冷干后称重,通过差减法得到振荡下来的颗粒物的量;加入适量的HPLC级水颗粒物配成溶液,部分液体置于1.5mL的离心管中,在涡旋振荡器上轻轻振荡16h后,再超声振荡2min,以使样品中的水溶部分充分溶解后即为颗粒物水溶液,4℃保存备用.分别配制成 0,25,50, 100,200μg/mL 5 个浓度的全样溶液进行肺泡上皮细胞染毒试验.
1.4 细胞凋亡试验
从液氮罐中取出冻存的人肺上皮细胞A549,进行细胞复苏培养,经过细胞传代,接种,计数并调整细胞浓度,将生长良好的指数生长期的A549细胞制成1×105的细胞悬液2mL,接种于6孔培养板,置于 37℃,5%CO2培养箱(Forma3110系列,USA)培养24h后,弃上清液,用D-Hanks液洗3次,加入含双抗、不含小牛血清的DMEM培养液,每组样品设3个平行,培养20h.分别加入5个浓度等级的PM10溶液进行染毒,培养20h,收集细胞培养液,用PBS洗2次,胰酶消化,细胞与原细胞培养液合并,4℃,1000r/min离心12min,细胞用PBS重新悬浮,1000r/min离心1min,倒掉上清液,用 200μL binding buffer悬浮细胞,过 200 目筛,加6μL 的 Annexin-V,避光静置 15min,加 3μL 的碘化丙啶(PI),上流式细胞仪进行分析.
1.5 细胞计数与统计分析
采用流式细胞仪进行细胞计数分析.AnnexinV-FITC/PI双染检测法是目前较为理想的检测细胞凋亡的方法[13].未发生凋亡细胞的膜结构及功能完整,胞膜没有被染上绿色荧光(FITC-),细胞核完整且未被染上红色荧光(PI-);早期凋亡的细胞膜结构完整,但是因为“膜翻转”而被染上红色荧光(FITC+);但因为膜结构完整,细胞核未被染上红色荧光(PI-);晚期凋亡细胞膜完整性破坏,PI通过细胞膜进入细胞,细胞膜“翻转”不完整的胞膜被染上绿色荧光,胞核被染上红色荧光(FITC+/PI+).在本试验中,由于颗粒物的毒性损伤,导致早期细胞膜丧失不对称性,细胞膜上的磷脂酰丝氨酸(PS)外露,早于DNA 断裂[14],通过膜联蛋白(Annexin-V)与 PS特异性结合、PI与坏死细胞结合可区分凋亡细胞与坏死细胞.
采用One-way-ANOVA进行凋亡率的计算,凋亡率=(凋亡细胞数/10000)×100%.数据采用SPSS16.0统计软件的一般线性模型的Multivariate过程进行多元方差分析.
2 结果
表2是通过流式细胞仪检测并计数得到的肺泡上皮细胞的凋亡率.
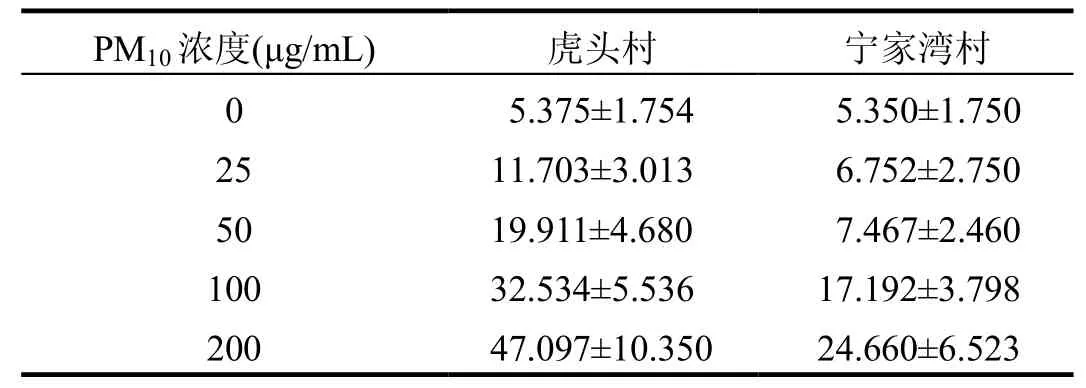
表2 PM10颗粒物悬浮液作用下A549总凋亡率(%)Table2 Apoptosis rate induced by PM10 solution(%)
方差齐性检验表明,虎头村与宁家湾村 2组PM10样本的Levene统计量为225.486(P<0.001),可以认为样本所在各总体的方差齐.对不同来源、不同浓度的PM10下肺泡上皮细胞单因素方差分析,虎头村组室内 PM10样本对肺上皮细胞凋亡的影响与宁家湾组差异显著(F=3124.522,P<0.001),而且各组内不同浓度对肺上皮细胞凋亡的影响差异显著(P<0.001).用 S-N-K 法进行两两比较,宁家湾村室内 PM10样本在 25,50μg/mL浓度下肺泡上皮细胞死亡率没有差异(P=0.671,P>0.01);虎头村室内 PM10样本在25,50μg/mL浓度下对肺泡上皮细胞凋亡率没有差异(P=0.026,P>0.01);其余被归入不同亚组(P<0.001),表明对肺上皮细胞的死亡或凋亡有差异.由表 3可以看出,虎头村组室内 PM10作用下肺上皮细胞死亡或凋亡率大于宁家湾组,2组样本作用下细胞的凋亡率和死亡率,随着的室内PM10浓度增加而提高.

表3 组别与浓度主效应交互作用结果Table 3 Analysis of the main effects interaction between groups and concentrations
3 讨论
正常凋亡是由多基因严格控制的、遵循自身程序的主动、高度有序的过程,但如果细胞受到外界因素的干扰,则会影响细胞的凋亡过程,表现在细胞凋亡过程处于各周期细胞数量的变化.在本研究中,室内 PM10的诱导是肺泡细胞上皮细胞凋亡的病理条件,细胞计数分析显示,细胞凋亡率随着浓度增加而增加,组间对比,同一浓度下虎头村凋亡率大于宁家湾组,具有显著性差异(P<0.001).在宁家湾村组内比较,在较低浓度下(<50μg/mL)PM10对肺泡上皮细胞凋亡的影响没有差异.但浓度较高时,随着浓度增加,细胞凋亡率明显增加,这可能由于较高浓度下颗粒物的体积、显微形貌、颗粒的聚集特性等理化性质对细胞的凋亡有一定影响.PM10生物活性研究表明,虎头村的PM10具有较强氧化性损伤能力[15],颗粒物自身的表面吸附的过渡金属金属等诱导细胞产生自由基,尤其是活性氧(ROS),它们会对细胞DNA造成显著的伤害,引起DNA的单链或双链断裂.细胞凋亡存在的3条途径:线粒体通路、内质网通路和死亡受体通路均与 ROS密切相关[16],因此推断,较强氧化性损伤能力可能是虎头村PM10样品影响肺泡上皮细胞的凋亡主要原因之一.
宣威肺癌产生机理至今尚不明确,室内PM10组成和来源非常复杂,是多种污染物的载体和催化剂,包括多种PAHs及其衍生物、含氧杂环化合物、金属元素及其化合物、硫酸盐、硝酸盐、各种生物气溶胶等,致毒机理也并非一种机理能够解释.PM10影响肺组织细胞的凋亡,损害遗传物质和干扰细胞正常分裂,而长期接触 PM10导致上皮细胞和巨噬细胞内的细胞因子增加;PM10污染物作用于细胞产生的一些细胞因子如生长因子,可能导致细胞周期失去正常调节,从而使细胞分裂增加,进一步形成肺癌.
4 结语
宣威肺癌高发区虎头村室内PM10对人肺泡上皮细胞凋亡的影响大于对照点肺癌低发区室内PM10,可能是虎头村肺癌高发的重要因素之一.因此改善居民居住环境和生活条件,控制室内PM10的浓度,对降低虎头村肺癌发病率具有积极作用.
[1]Mumford J, He X-Z, Champman R, et al. Lung cancer and indoor and pollution in Xuan Wei, China [J]. Science, 1987:217-235.
[2]Marineola F, Jaffee E, Hicklin D, et al. Escape of human solid tumors from T cell recognition: molecular mechanisms and functional significance [J]. Adv. Immunol., 2000,74:181-273.
[3]何兴舟,蓝 青,杨儒道.宣威肺癌危险因素研究概述 [J]. 卫生研究, 1995,24(4):203-206.
[4]Lan Q, Chen W. Risk factors for lung cancer in non-smokers in Xuanwei County of China [J]. Biomedical and Environmental Sciences, 1993,6(2):11-28.
[5]何兴舟,杨儒道.室内燃煤空气污染与肺癌 [M]. 昆明:云南科技出版社, 1994:197.
[6]Hunter T, Pines J. Cyclins and cancer. II: Cyelin D and CDK inhibitors come of age [J]. Cell, 1994,79(4):573-582.
[7]Sherr C. G1 phase progression: cycling on cue [J]. Cell, 1994,79(4):551-555.
[8]Sherr C. Mammalian G1 cyclins [J]. Cell, 1993,73(6):1059-1065.
[9]雷 雨.云南宣威肺癌HLA-A02高分辨率研究 [D]. 昆明:昆明医学院, 2007.
[10]Tian L W, Donald Lucas, Susan L, et al. Particle and gas emissions from a simulated coal-burning household fire pit [J].Environ. Sci. Technol., 2008,42(7):2503-2508.
[11]David J Large, Shona Kelly, Baruch Spiro, et al. Silica-volatile interaction and the geological cause of the Xuan Wei lung cancer epidemic [J]. Environ. Sci. Technol., 2009,43(23):9016-9021.
[12]Fadok V A, Voelker D R, Campbell P A, et al. Exposure of phosphatidylserine on the surface of apoptotic lymphocytes triggers specific recognition and removal by macrophages [J].Immunol., 1992,148(7):2207-2216.
[13]Vermes I, Haanen C, Steffens-Nakken H, et al. A novel assay for apoptosis flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluoresce in labeled Annexin V [J]. Immunol. Methods, 1995,184(1):39-51.
[14]Aravind L, Dixit V M, Koonin E V. The domains of death:evolution of the apoptosis machinery [J]. Trends Biochem. Sci.,1999,24(2):47-53.
[15]邵龙义,杨园园,吴明远,等.宣威农村肺癌高发区室内PM10的生物活性及其与微量元素组成的关系 [J]. 环境与健康杂志,2008,25(12):282-287.
[16]刘 卉,刘延香.细胞凋亡与活性氧 [J]. 现代肿瘤医学, 2008,16(10):1380-1382.
致谢:衷心感谢北京联合大学应用文理学院赵晓红教授对细胞实验部分的指导,感谢宣威市虎头村卫生室代普飞在采样过程中给予的帮助.
