黄芩苷在中国对虾体内的代谢及残留消除规律研究*
2010-01-05李小彦潘鲁青
李小彦,李 健,潘鲁青,张 喆
(1.中国海洋大学,山东青岛266003;2.中国水产科学研究院黄海水产研究所,山东青岛266071)
黄芩苷在中国对虾体内的代谢及残留消除规律研究*
李小彦1,2,李 健2**,潘鲁青1,张 喆2
(1.中国海洋大学,山东青岛266003;2.中国水产科学研究院黄海水产研究所,山东青岛266071)
在(24±1)℃下,中国对虾连续7 d给予100 mg/kg黄芩苷药饵,用高效液相色谱法(HPLC)测定对虾血液及其它组织中的黄芩苷含量,建立适合中国对虾体内黄芩苷含量的测定方法,研究黄芩苷在中国对虾不同组织中的残留消除规律。结果表明,HPLC法黄芩苷与杂质分离良好,4个浓度水平的黄芩苷在不同组织中的平均回收率在80.57%~96.25%之间,日内精密度在3.26%~5.85%之间,日间精密度在3.88%~5.73%之间。与其它给药方式相比,黄芩苷药饵给药吸收较慢,在血液、肝胰腺、肌肉、鳃中的达峰时间(Tmax)依次为6,3,6,3 h;黄芩苷在不同组织中的分布为肝胰腺>鳃>血液>肌肉。黄芩苷在肝胰腺、鳃、肌肉、血液中的消除半衰期(t1/2β)分别为29.62,27.50,25.20,23.73 h,消除速率从快到慢依次为血液>肌肉>鳃>肝胰腺;黄芩苷残留较少,在肌肉和血液中5 d已降到检测限以下,肝胰腺及鳃7 d降到检测限以下。本试验为含黄芩苷的药物的应用提供参考。
中国对虾;黄芩苷;代谢;残留;消除
中药作为我国传统药物已有悠久的历史,它具有毒副作用小,价格低廉,不易产生耐药性等优点,已逐渐开始应用于水产养殖业[1-2]。中药的代谢规律研究有助于阐明其作用机制及优选给药方案,还有助于促进中药新药开发和剂型改进。然而,中药成份复杂,即使单味中药也含有许多成份,因而中药的药物代谢研究进展缓慢,这大大制约了中药新药的开发及应用[3]。通常认为,中药比西药的药物不良反应小,应用更安全,但实际上中药也能引起许多不良反应。中药成份复杂,当与其它药物合用时,发生药物相互作用的可能性就明显增加,因此,加强中药的代谢规律及残留研究具有重要的意义[4]。
中药的药代动力学研究在哺乳动物中报道较多,而在水产动物中报道很少,仅见于少数鱼类[5]。有关黄芩苷在动物体内的药动学研究,以往的研究多侧重于复方制剂中黄芩苷在哺乳动物血液中的含量变化,如银黄冲剂中黄芩苷在家兔体内的药代动力学研究,银黄颗粒及复方茵芩制剂中黄芩苷在大鼠体内的药代动力学以及复方制剂中黄芩苷在奶牛体内的药动学研究等[6-9],而在水产动物中未见相关报道,有关中药残留及消除的研究也未见报道。黄芩苷是从唇形科植物黄芩的干燥根中提取的黄酮类化合物,是其主要有效成分之一,它属葡萄糖醛酸苷类,其结构为7-D-葡萄糖醛酸-5、6-二羟基黄酮,水解后产生黄芩素和葡萄糖醛酸,具有抗菌、抗病毒、抗变态反应、抗炎等作用[10],常用于对虾细菌性疾病的防治。本文以黄芩中主要成份黄芩苷的研究入手,研究黄芩苷在中国对虾体内的代谢特点及残留消除规律,有助于阐明黄芩苷的作用机理及优选黄芩苷给药方案,为水产养殖中合理使用黄芩苷及其复方制剂提供参考,为食品安全提供保障。
1 材料与方法
1.1 实验动物
健康中国对虾(Fenneropenaeus chinensis),平均体质量(9.37±1.21)g,购自胶州宝荣水产科技发展有限公司,试验前暂养一周,检测各组织内无药物残留。试验用水为自然海水,盐度25±1,试验期间每天换水2次,连续充气,水温(24±1)℃。
1.2 药品与试剂
黄芩苷标准品(含量95.2%,中国药品生物制品检定所,批号:110715-200815);黄芩苷药粉(购自胶南科奥植物制品有限公司,含量≥85%)。
甲醇、乙腈为色谱纯,其余试剂均为分析纯。
1.3 试验设计
药饵的配制:基础饲料(金海力水产科技有限公司)中添加10%鱼粉,使用2%褐藻酸钠作黏合剂,添加几滴植物油,黄芩苷药粉按照100 mg/kg虾体质量的剂量添加,充分混匀。用制饵机制成药饵,烘干备用。
1.4 样品处理及HPLC工作条件[11-12]
血液的处理:取200μL血液,加入甲醇至1 m L,充分混匀,旋涡振荡2 min,12 000 r/min离心10 min,取上清,过0.22μm滤膜进样。
肌肉、肝胰腺、鳃的处理:准确称取肌肉和肝胰腺0.5 g,鳃0.2 g加入2 mL甲醇,用高速分散器匀浆,再用2 mL甲醇清洗刀头,合并提取液,充分振荡,5 000 r/min离心10 min,取上清液。再用2 mL甲醇重复提取1次,合并2次提取液,40℃水浴氮气吹干,加1 mL流动相,再加1 mL正己烷,充分混匀,下层溶液过0.22μm滤膜后进样。
样品测定采用A gilent1100高效液相色谱仪,固定相:色谱柱为Agilent Tc-C18(250 mm×4.6 mm,5μm);柱温:30℃;流动相:甲醇/水/磷酸(体积比为60∶40∶0.1);流速0.8 mL/min;检测波长277 nm;进样量:20μL。
1.5 线性范围及最低检测限
准确称取5 mg黄芩苷标准品,以色谱纯甲醇溶解,用甲醇配制成100μg/mL标准储备液。临用前用流动相稀释成50,20,10,5,1,0.5,0.2,0.1,0.05μg/mL 9个系列质量浓度的标准溶液,用HPLC法进行检测,以药品峰面积对相应的浓度作线性回归,绘出标准曲线,得出回归方程和相关系数。将引起2倍基线噪音的药物浓度定义为最低检测限。
1.6 回收率和精密度
黄芩苷标准品在0.05~50μg/mL范围内以4个质量浓度加入血液、肝胰腺、肌肉和鳃的空白样品中,混匀,静置2 h以上,按照样品处理方法进行提取和测定,根据结果计算各组织的回收率。以上4个浓度的样品于1 d内不同时间分别进样5次和分5 d重复测定,计算各组织中不同浓度水平相应峰面积的日内平均变异系数和日间平均变异系数,以此衡量定量方法的精密度。
1.7 统计分析
将浓度-时间数据采用M icrosoft Excel 2003软件拟合,绘制药时曲线图和消除曲线图,求出消除速率常数(β)和消除曲线方程,计算消除半衰期(t1/2β)。
2 实验结果
2.1 线性范围与最低检测限
黄芩苷的液相色谱峰形尖锐且对称,各组织中杂质分离良好,无明显干扰峰。标准溶液在0.05~50μg/m L浓度范围内具有良好的相关性,线性回归方程Y=96.144X-17.835,相关系数R2=0.999 8。该方法最低检测限为0.05μg/m L。
2.2 回收率及精密度
在0.05~50μg/mL范围内4个质量浓度水平测定黄芩苷在中国对虾血液及肝胰腺、肌肉、鳃几种组织中的平均回收率分别为96.25%±1.53%,83.84%±3.68%,80.79%±6.70%,80.57%±1.01%。此方法精密度较高,所有样品的日内变异系数在3.26%~5.85%之间,日间变异系数在3.88%~5.73%之间。
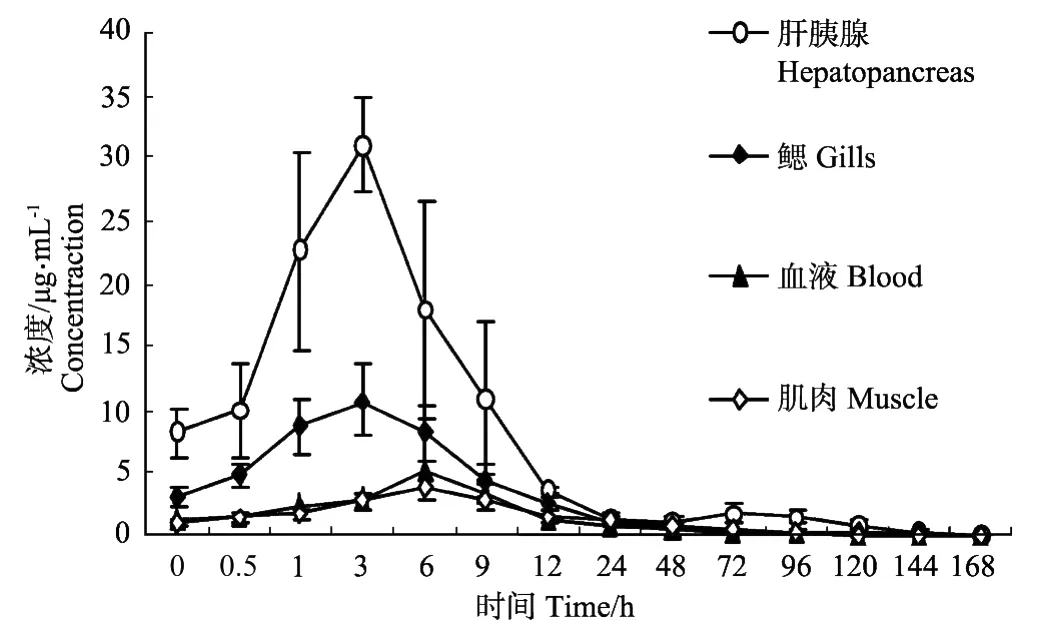
图1 药饵连续给药后黄芩苷在中国对虾各组织中的药物浓度(100 mg/kg)Fig.1 Concentrationsof baicalin in several tissues of Fenneropenaeus chinensis after o ralmulti-administration(100 mg/kg)
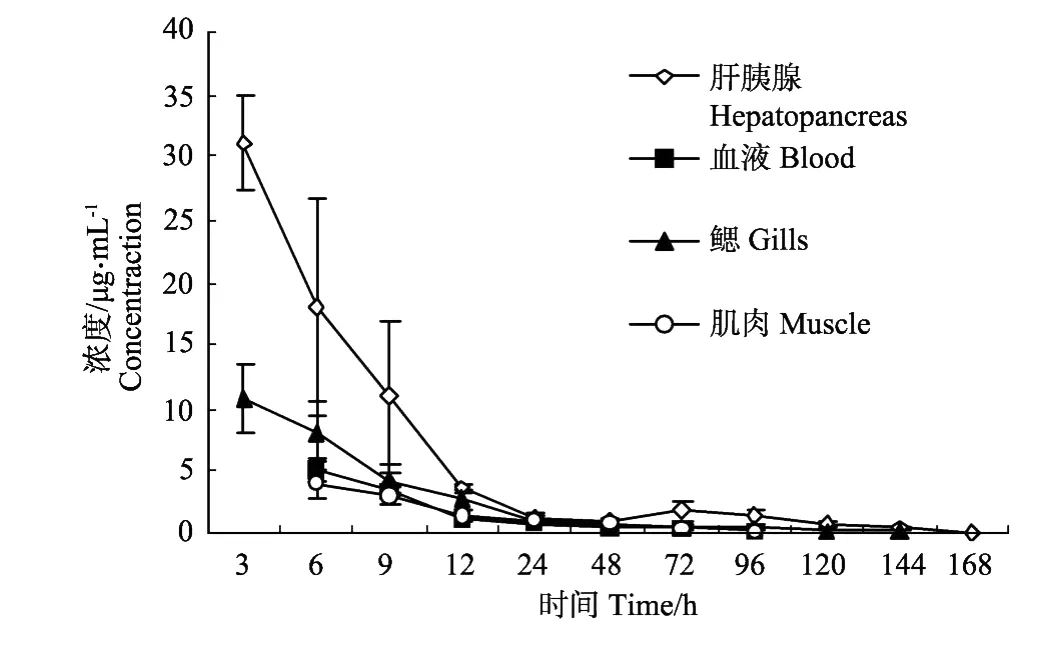
图2 药饵连续给药后黄芩苷在中国对虾各组织中的消除曲线(100 mg/kg)Fig.2 Elimination curves of baicalin in several tissuesof Fenneropenaeus chinensis after o ralmulti-administration(100 mg/kg)
2.3 黄芩苷多次给药后在中国对虾体内的代谢特征
中国对虾以100 mg/kg的剂量多次给予黄芩苷药饵,停药后黄芩苷在血液中6 h左右达到峰值,黄芩苷在各组织中的分布为肝胰腺>鳃>血液>肌肉。停药后黄芩苷在血液及肝胰腺、鳃、肌肉中的药时曲线见图1。
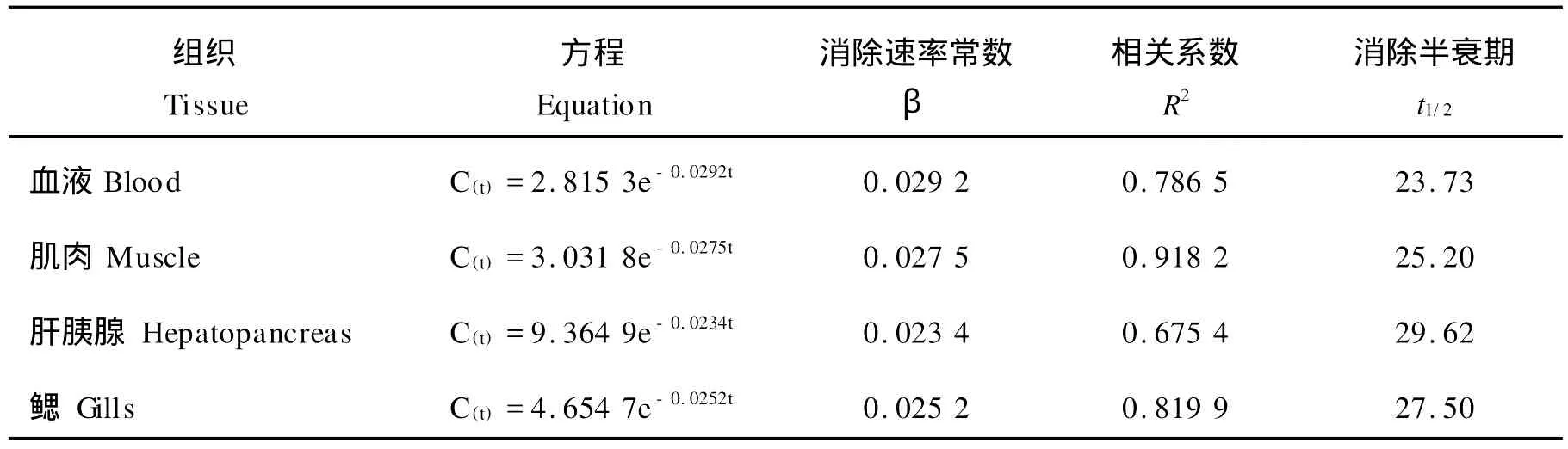
表1 药饵连续给药后黄芩苷在中国对虾不同组织中消除曲线方程和参数Table 1 The equations of elimination curves and parameters of Baicalin in tissues after oral multi-administration(100 mg/kg b.w)in Fenneropenaeus chinensis
2.4 黄芩苷在中国对虾体内的残留消除规律
将药物浓度-时间数据用Excel软件拟合,得出黄芩苷在中国对虾4种组织中的消除方程、相关系数及消除半衰期(见表1)。停药后黄芩苷在中国对虾各组织中消除曲线见图2。黄芩苷残留较少,肌肉和血液给药后5 d已降到检测限以下,肝胰腺和鳃给药后7 d降到检测限以下。
3 讨论
3.1 黄芩苷测定方法的探讨
在水产动物中,中药的药代动力学研究仅在少数鱼类中有过报道[5],有关黄芩苷在水产动物的代谢动力学研究未见报道。中国对虾属于开放式循环系统,和鱼类有较大差别,本研究旨在摸索适合中国对虾体内黄芩苷含量的检测方法。
参照有关文献[7-8,13-14]对黄芩苷的流动相进行了摸索,最终选择甲醇/水/磷酸(体积比为60/40/0.1)作为流动相。黄芩苷极性较大,在流动相中加入磷酸抑制其解离,防止色谱峰拖尾,可以起到改善峰形的作用[13]。在试验所摸索的条件下,黄芩苷的色谱行为较好,基线走动平稳,保留时间为6.992 min,与杂质分离较好。黄芩苷易氧化[15],浓缩温度不易过高,因此氮吹过程中水浴温度选择40℃。对组织样品的处理,采用常用的蛋白沉淀剂甲醇、乙腈进行实验,按照样品处理方法处理后甲醇平均回收率在80%以上,而乙腈的平均回收率不到30%,因此选用甲醇作蛋白提取剂。由于血液与其它组织成份的差别,本试验对血液和其它组织采取了不同的处理方法,省去了氮吹等过程,简化了操作步骤,节约了成本。中药的药代动力学研究多以血液或其它体液为研究对象,其它组织研究较少,本试验对组织样品中药物含量的测定方法进行了摸索,首次建立了组织样品中中药含量的检测方法。
在选定的试验条件下,黄芩苷的标准曲线具有极好的相关性,说明此标准曲线可以标准定量。回收率和变异系数是决定测定方法准确性和可靠性的重要依据,回收率不应低于70%,日内和日间变异系数应控制在10%以内,本试验所建立的方法准确可靠,均符合生物测定方法要求,可用于黄芩苷在中国对虾体内的代谢及残留消除的研究。
3.2 黄芩苷多次给药后在中国对虾体内的代谢特征
中国对虾以100 mg/kg的剂量连续7 d给药后,药物在血液中达峰时间(Tmax)为6 h,中国对虾黄芩苷药饵给药与兔灌胃给药,大鼠灌胃或直肠给药等血液中达峰时间相比均晚[6-9],药物吸收较慢。中国对虾属于开放式循环系统,理论上代谢应比脊椎动物更快,可能由于黄芩苷味苦,药饵给药适口性较差,对虾不易摄食导致达峰时间较晚,说明给药方式不同对药物代谢影响较大,也可能是种属之间的差异导致黄芩苷在对虾体内不易吸收。和一些西药如氟苯尼考相比,相同给药方式下黄芩苷在中国对虾血液中达峰时间较晚[12,16],黄芩苷在对虾体内吸收较慢。
中国对虾连续给药后肝胰腺及鳃药物浓度较高,而血液和肌肉中浓度较低。肝胰腺一直被公认为药物代谢的主要器官,药物浓度最高。而鳃药物浓度也较高,可能由于鳃作为对虾的呼吸器官,与水环境直接接触,药饵溶入水中部分药物可通过鳃进入体内,或者药物经过体内代谢循环进入鳃组织中,说明对虾鳃组织在代谢药物的过程中也起着重要的作用,但鳃通常不被作为主要的取样组织来进行分析,这一点应该引起重视。血液中药物浓度较低,这与口服给药方式有关,药物通过胃肠道吸收等损失后进入血液中就降低很多。肌肉中药物浓度最低,这可能是因为肌肉渗透性差,血管贫乏,相比于肝胰腺等一些血管丰富、渗透性好的组织来说,药物难以分布到这些组织中[17]。
3.3 黄芩苷在中国对虾体内的残留消除规律
有报道不同给药方式之间黄芩苷的消除速率差别较大,黄芩苷静脉给药代谢消除较快,维持有效血药浓度的时间短,而口服或灌服给药表现的代谢特征与静脉给药差别明显[8]。本试验结果支持上述观点,黄芩苷药饵给药在各组织中的消除速率相似,血液t1/2β为23.73 h,与大鼠直肠灌注给药血液中t1/2β为12.79 min以及奶牛静注给药血液中t1/2β为2 h相比,消除速率均较慢[7,9],口服给药消除半衰期普遍较其它给药方式长,主要因为口服给药后药物先经胃肠道吸收后才能分布到血液进行消除。本试验条件下黄芩苷消除速率较慢,也可能是由种属差异所致,杨先乐等[18]认为甲壳动物属于较低等的水生动物,主要通过触角腺和肝胰腺对药物进行排泄和降解,而哺乳动物如鼠等还可通过肾脏及呼吸器官等予以消除,因此黄芩苷在中国对虾体内的t1/2β较一些哺乳动物长,黄芩苷在中国对虾体内维持有效血药浓度时间较长,在药物消除方面适合生产用药。
本试验中连续7 d给予黄芩苷药饵(100 mg/kg),肌肉和血液中停药5 d后已降到检测限以下,肝胰腺和鳃停药7 d后降到检测限以下,说明黄芩苷不易在对虾体内残留。虽然中药相对于西药具有许多优势,但是实际上中药也会引起不良反应,因此避免中药在体内的残留也很重要。黄芩苷残留较少,不易对对虾生长造成负担,同时也保证了食品安全,在药物残留方面适合生产上用药。虽然中药没有明确的残留限量标准,但是为了保证食用者的健康安全,如果以最高残留限量100μg/kg为标准,通过休药期公式计算肌肉需5.17 d,肝胰腺需8.08 d,因此在本试验条件下,建议对虾至少9 d后才能食用。
3.4 临床用药建议
由本试验可知,黄芩苷药饵给药在中国对虾体内吸收较慢,这与许多研究报道结果一致[6,8]。有研究表明黄芩苷难溶于水,口服吸收缓慢,黄芩苷在肠内经过菌群酶(β-葡萄糖醛酸苷酶)作用转化为其甙元黄芩素而被吸收,而部分被吸收的黄芩素在体内可再被还原为黄芩苷[19-20],而黄芩素在胃、肠内各个部位的吸收均明显优于黄芩苷[21],因此,对于急症病例,可应用黄芩苷的代谢物黄芩素的口服制剂,这样可以提高生物利用度,增加临床疗效。另外,黄芩苷的吸收可能受与之联合使用的抗生素的影响,临床用药时应注意合理配伍;中药发挥药效所需的时间较长,单次用药难以发挥药效,临床上用量一般较大,本试验也为含黄芩苷的中药口服制剂的临床应用提供了可供参考的重要信息。
中药成份复杂,其化学成份众多,大多数中药有效成份及药理作用机制尚未明确。在药物代谢规律明确的基础上,加强药效学方面的研究,综合评价黄芩苷的作用机制,为黄芩苷的合理应用提供指导。
[1] 王玲,周旭正,尚若峰,等.中草药在水产生态养殖中的应用研究[J].饲料研究,2008,9:65-68.
[2] 吴梅秀.中草药在水产养殖业中的应用前景[J].畜牧兽医杂志,2008,27(2):64-65.
[3] 底佳芳,张秀英.中药药代动力学研究概况[J].中国兽药杂志.2004,38(12):35-37.
[4] 曾苏.药物代谢学[M].浙江:浙江大学出版社,1999:134-137.
[5] 游浩,李英伦,陈学宏.新三黄液在草鱼体内的药动学研究[J].淡水渔业,2007,37(5):26-31.
[6] 张志荣,胡晓颖,蒋大义,等.银黄冲剂中黄芩甙在家兔体内的代谢动力学研究[J].中成药,1996,18(6):1-3.
[7] 韩建春,佟恒敏,李继昌,等.复方制剂中黄芩甙成分在奶牛血浆和乳中药动学的研究[J].东北农业大学学报,2004,35(2):129-134.
[8] 黄志坚,杨丽英,陈强,等.复方茵芩制剂中黄芩甙的药代动力学研究[J].福建农林大学学报,2007,36(5):505-509.
[9] 李新圃,罗金印,李宏胜,等.银黄颗粒中黄芩甙在大鼠体内的测定及药代动力学[J].中兽医医学杂志,2008,1:17-19.
[10] 朱光勋.中药黄芩有效成份黄芩苷在牙周病防治中的应用[J].口腔医学研究,2006,22(5):566-567.
[11] 洪盈盈,吴韶铭.复方鱼腥草片中黄芩甙的HPLC测定[J].中国医药工业杂志,2001,32(11):510-511.
[12] 李静云,王群,李健,等.氟苯尼考在中国对虾组织内的代谢动力学及残留消除规律[J].水产学报,2004,28(增刊):63-68.
[13] 仇峰,何仲贵,程杉,等.RP-HPLC法测定兔血浆中黄芩苷含量[J].沈阳药科大学学报,2002,19(3):189-191.
[14] 车庆明,杨琳,陈颖,等.不同剂量黄芩素在大鼠体内的药动学差异[J].中国新药杂志,2007,16(8):604-606.
[15] 阴健,任天池,曹春林.血浆中黄芩甙的HPLC测定方法[J].中国实验方剂学杂志,1998,4(1):4-6.
[16] 王群,何玉英,李健.氟苯尼考在中国对虾体内消除规律的研究[J].中国海洋大学学报:自然科学版,2007,37(2):251-254.
[17] 邓树海,张秀珍,邹立家.药物动力学与生物药剂学(第1版)[M].天津:天津科技翻译出版公司,1992.
[18] 杨先乐,刘至治,横山雅仁.盐酸环丙沙星在中华绒螯蟹体内药代动力学研究[J].水生生物学报,2003,27(1):18-22.
[19] Akira K,Satoshi K,Hideki H,et al.HPLC with electrochemical detection to examine the pharmaco kinetics of baicalin and baicalein in rat plasma after oral administration of a Kampo medicine[J].Analytical Biochemistry,2006,350:99-104.
[20] Akao T,Kaw abata K,Yanagisaw a E,et al.Baicalin,the p redominant Xavone glucuronide of Scutellariae radix,is absorbed from the rat gastroin-testinal tract as the aglycone and resto red to its original form[J].Pharm Pharmacol.2000,52:1563-1568.
[21] 刘太明.黄芩苷和黄芩素的吸收机理研究[D].成都:四川大学,2006.
Metabolism and Residue of Baicalin in Fenneropenaeus chinensis
L IXiao-Yan1,2,LIJian2,PAN Lu-Qing1,ZHANG Zhe2
(1.Ocean University of China,Qingdao 266003,China;2.Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao 266071,China)
The shrimp Fenneropenaeus chinensis,was treated with baicalin at a dose of 100 m g/kg weight body per day for seven days at(24±1)℃.After oral administration,eight shrimps were selected randomly and killed at different times.Blood,hepatopancreas,muscle and gills of the killed shrimp were collected and analyzed by high-performance liquid chromatography(HPLC).A n HPLC method was established to detect the residue and elim ination of the baicalin from four tissues of Fenneropenaeus chinensis.The results showed that the established HPLC method was efficient because the baicalin and impurities could be highly separated.An four baicalin concentration levels,the percentage recoveries of baical in were between 80.57%and 96.25%,the within-day p recision was between 3.26%and 5.85%,and the between-day precision was between 3.88%and 5.73%from four tissues.Compared with other administration methods,baicalin was absorbed slower following seven days of multi-administration,the Tmaxof blood,hepatopancreas,m uscle and gills was 6 h,3 h,6 h and 3 h,respectively.The tissue concentrations decreased in the following order:hepatopancreas>gills>blood>muscle.The elimination rate decreased in the following order:blood>muscle>gills>hepatopancreas,with t1/2βvalues of 29.62 h,27.50 h,25.20 h and 23.73 h,respectively.The baicalin was less residual in Fenneropenaeus chinensis,it had dropped below the detection lim it on the fifth day in the muscle and blood and on the seventh day in the hepatopancreas and gills.The results provided app lication reference for drugs containing baicalin.
Fenneropenaeus chinensis;baicalin;metabolism;residue;elimination
S943
A
1672-5174(2010)12-032-05
公益性农业行业科研专项(200803012);国家虾产业技术体系(nycytx-46)资助
2009-10-13;
2009-12-07
李小彦(1984-),女,硕士,主要从事水产动物药理学研究;Tel:13687679122,E-mail:xiaoyan 211@163.com
**通讯作者:Tel:0532-85830183,E-mail:Lijian@ysfri.ac.cn
责任编辑 于 卫
