干酪乳清中乳铁蛋白分离纯化的研究
2010-01-04蒋超张彧陈历俊姜铁民
蒋超,张彧,陈历俊,姜铁民
(1大连工业大学,辽宁大连 116034;2北京三元食品股份有限公司,北京 100085)
干酪乳清中乳铁蛋白分离纯化的研究
蒋超1.2,张彧1,陈历俊2,姜铁民2
(1大连工业大学,辽宁大连 116034;2北京三元食品股份有限公司,北京 100085)
采用超滤、阳离子交换层析方法从热钙法处理过的干酪乳清中分离纯化乳铁蛋白。结果表明,经预处理后的干酪乳清加入经过磷酸盐缓冲液(pH值为8.0)平衡的树脂中,分别用浓度为0.3 mol/L和0.8 mol/L的NaCl进行阶跃洗脱,所得乳铁蛋白经SDS-PAGE和免疫印迹法(Western Blotting)检测,纯度达93.6%。
干酪乳清;乳铁蛋白;离子交换层析
0 引 言
乳清作为生产干酪的副产物,含有多种功能性蛋白,如β-乳球蛋白、α-乳白蛋白、免疫球蛋白、乳铁蛋白等[1],其中乳铁蛋白(Lactoferrin,LF)具有促进铁的吸收,抑菌、抗病毒感染,调节骨髓细胞的生成,调节机体免疫功能,增强机体抗病能力等生理作用[2-5],已成为当前研究的“热点”。
在我国,对乳铁蛋白分离纯化的研究多以牛初乳和脱脂乳为原料[6-8],而直接从干酪乳清中分离纯化乳铁蛋白的研究却未见报道。相比牛初乳和脱脂乳,干酪乳清存在混浊度较高,处理过程复杂等问题,因此从乳清中分离纯化乳铁蛋白较困难。本研究以干酪乳清为原料,经热钙法澄清乳清,并优化离子交换层析条件,建立适合工业化生产乳铁蛋白的工艺路线,为合理利用乳清资源提供理论依据。
1 材料与方法
1.1 原料、试剂及仪器
干酪乳清,乳铁蛋白标品,乳铁蛋白抗体,碱性磷酸酶标记兔抗羊IgG,BCIP/NBT,CM-Sepharose FastFlow。
稳压电泳仪,GIS-2010凝胶成像系统,板式超滤设备,YC-1层析实验冷柜,ALPHA1-2冷冻干燥机,LC-6M大容量冷冻离心机,Cintra 20分光光度计。
1.2 干酪乳清预处理
采用热钙法预处理干酪乳清[9],向干酪乳清中加入氯化钙,搅拌后用浓度为2 mol/L的NaOH调pH值至7.4,在50℃保温8 min,冷冻离心8 min后取上清液,通过测定上清液的混浊度判断乳清处理程度[10]。将获得的上清液通过超滤,进一步去除乳糖等小分子杂质,制备层析样品。
1.3 离子交换层析
乳清经预处理后,加入经浓度为0.02 mol/L的磷酸盐缓冲液平衡的CM-Sepharose Fast Flow离子交换柱,以30 cm/h的速度进行洗脱。同时,根据收集乳铁蛋白的纯度及回收率结果,优化层析条件,提高乳铁蛋白的分离纯化效果。
1.3.1 平衡缓冲液pH值选择
选择不同pH值 (6.3~8.0)缓冲液平衡离子交换树脂,通过SDS-PAGE电泳检测树脂对蛋白的吸附程度,确定平衡缓冲液pH值范围;并在该范围内,选取不同pH值缓冲液平衡树脂,通过动态吸附确定最适pH值。
1.3.2 洗脱离子强度选择
用含NaCl浓度为0.3~1 mol/L的磷酸盐缓冲液平衡树脂,通过检测树脂与乳铁蛋白结合程度确定洗脱盐范围;在选定范围内,选取不同盐浓度通过阶跃洗脱收集乳铁蛋白。
1.3.3 洗脱方法选择
使用5倍于树脂体积pH值为8.0浓度为0.02 mol/L的磷酸盐缓冲溶液平衡树脂,采用两种洗脱方法分离乳铁蛋白。方法一采用浓度为0~1 mol/L的NaCl磷酸盐缓冲液梯度洗脱;方法二采用1.3.2确定的最适洗脱离子强度 (含有浓度为0.3和0.8 mol/L的NaCl磷酸盐缓冲液)进行阶跃洗脱。通过比较确定最佳洗脱方法。
1.4 蛋白检测方法
(1)总蛋白质量浓度的测定:原料预处理过程中总蛋白质量浓度检测采用Lowry法[11]。
(2)乳铁蛋白质量浓度的测定:原料及冻干后乳铁蛋白质量浓度的测定采用SDS-PAGE法[12],并采用Bandscan分析软件对电泳条带纯度进行检测。
1.5 乳铁蛋白免疫原性分析
将纯化的乳铁蛋白经SDS-PAGE电泳后,通过电转仪转移至硝酸纤维素膜上,利用Western Blotting进行免疫原性分析[13]。
2 结果与分析
2.1 总蛋白、脂肪质量浓度及混浊度变化
由于车间生产干酪的乳清,混浊度很高,其中残余酪蛋白、脂类会严重影响分离效果。因此,在上样液准备前需进行处理。表1为热钙处理对乳清中总蛋白、乳铁蛋白质量浓度及混浊度的影响。由表1可以看出,热钙处理后总蛋白及乳铁蛋白质量浓度有所下降,原因可能是在处理过程中残余酪蛋白减少以及脂肪、酪蛋白与乳铁蛋白结合减少所致。但经过处理后的乳清,混浊度(500 nm吸光值)由2.74减小到0.07,可以极大改善后期分离纯化的效率。

表1 热钙处理对乳清的影响
2.2 乳铁蛋白分离纯化条件的确定
2.2.1 平衡缓冲液pH值
平衡缓冲液pH值主要取决于与被分离物质的等电点,根据文献报道,乳铁蛋白等电点在8.0~9.0[14],因此选择pH值小于8.0的缓冲液平衡离子交换树脂,通过电泳检测树脂与目的蛋白及杂蛋白的结合程度,确定平衡缓冲液pH值范围,结果如图1所示。图1中,1为乳铁蛋白标品;2~9为平衡缓冲液pH值分别为6.3,6.5,6.8,7.0,7.3,7.5,7.8,8.0。
由图1可以看出,在pH值为6.3~8.0范围内,每毫升树脂都可以结合15 mg左右的乳铁蛋白,但是pH值低于6.8时,杂蛋白也与树脂结合,这在洗脱过程中可能会影响到乳铁蛋白的纯度,因此确定平衡缓冲液pH值范围为6.8~8.0。
在确定缓冲液pH值范围条件下,分别用pH值为6.8,7.3,7.8,8.0磷酸盐缓冲液平衡树脂,通过对洗脱蛋白进行检测,结果如表2所示。由表2可以看出,乳铁蛋白得率及纯度随着平衡缓冲液pH值增加逐渐增加,在平衡缓冲液pH值为8.0时,获得的乳铁蛋白得率和纯度均高于其他pH值,因此,确定平衡缓冲液最适pH值为8.0。
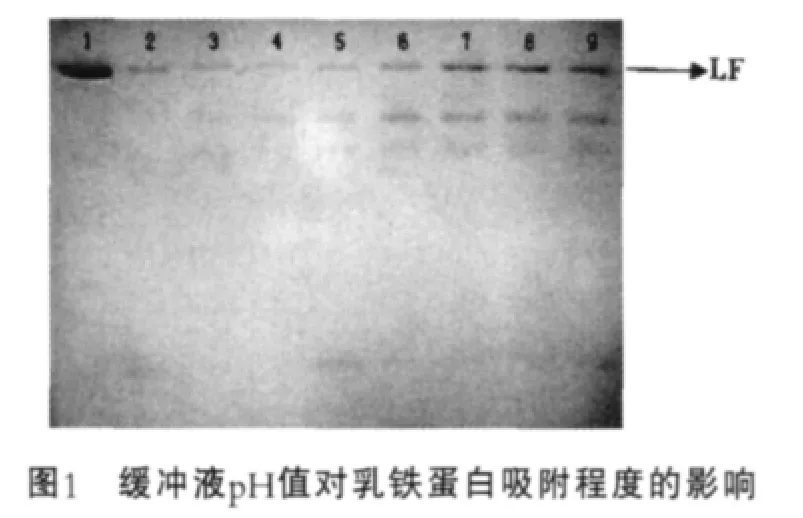

表2 不同缓冲液pH值效果比较
2.2.2 洗脱离子强度
在优化洗脱离子强度前,首先确定了洗脱盐浓度范围,选择含有NaCl浓度为0.3~1 mol/L的磷酸盐缓冲液平衡树脂,将乳铁蛋白样品加入树脂中,通过SDSPAGE电泳检测树脂上清液中蛋白,由电泳图可知(图2),在洗脱盐浓度为0.3 mol/L时,没有乳铁蛋白条带,这说明在此浓度下,可以很好的洗脱杂蛋白,而不会导致乳铁蛋白的损失;当随着洗脱离子强度达到0.6 mol/L后,出现明显的蛋白条带并逐渐变宽,但在浓度达到0.8 mol/L之后,条带不再变化,因此在试验中选择浓度为0.6,0.8,1.0 mol/L的NaCl洗脱乳铁蛋白,确定最佳洗脱离子强度。图2中,1为乳铁蛋白标品;2~9为洗脱盐质量浓度为0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mol/L。

按照电泳确定的洗脱离子强度范围,在优化试验中选择浓度为0.3 mol/L的NaCl洗脱杂蛋白,然后分别采用浓度为0.6,0.8,1.0 mol/L的NaCl洗脱乳铁蛋白。结果表明,采用浓度为0.8 mol/L的NaCl洗脱乳铁蛋白的得率为29.56%,纯度为93.60%,结果如表3所示。由表3可以看出,虽然纯度比浓度为0.6 mol/L的NaCl洗脱略低,但是得率是最高的。因此,从工业化生产考虑,确定最佳洗脱盐浓度为0.8 mol/L的NaCl。

表3 洗脱盐浓度效果比较

2.2.3 洗脱方法
为确定乳铁蛋白最佳洗脱方法,试验中比较了梯度洗脱和阶跃洗脱两种方法对乳铁蛋白分离效果的影响,由收集峰图可知(图3),采用梯度洗脱,收集峰变化缓慢,很难将乳铁蛋白收集,原因可能是流动相的浓度增大太慢,导致峰型变宽,影响分离效果;而换用浓度为0.3 mol/L与0.8 mol/L的NaCl进行阶跃洗脱,则会出现两个尖锐的峰,可以很好的收集乳铁蛋白。
根据对不同洗脱方法收集的乳铁蛋白进行检测,结果如表4所示。由表4可以看出,在上样量相同条件下,阶跃洗脱与梯度洗脱相比,用时较短,得率较高。因此,试验中选择阶跃洗脱,这样可以省去梯度洗脱装置、节约时间,有利于大规模生产。

表4 梯度洗脱与阶跃洗脱结果比较
2.3 优化后分离LF的SDS-PAGE及WesternBlotting结果
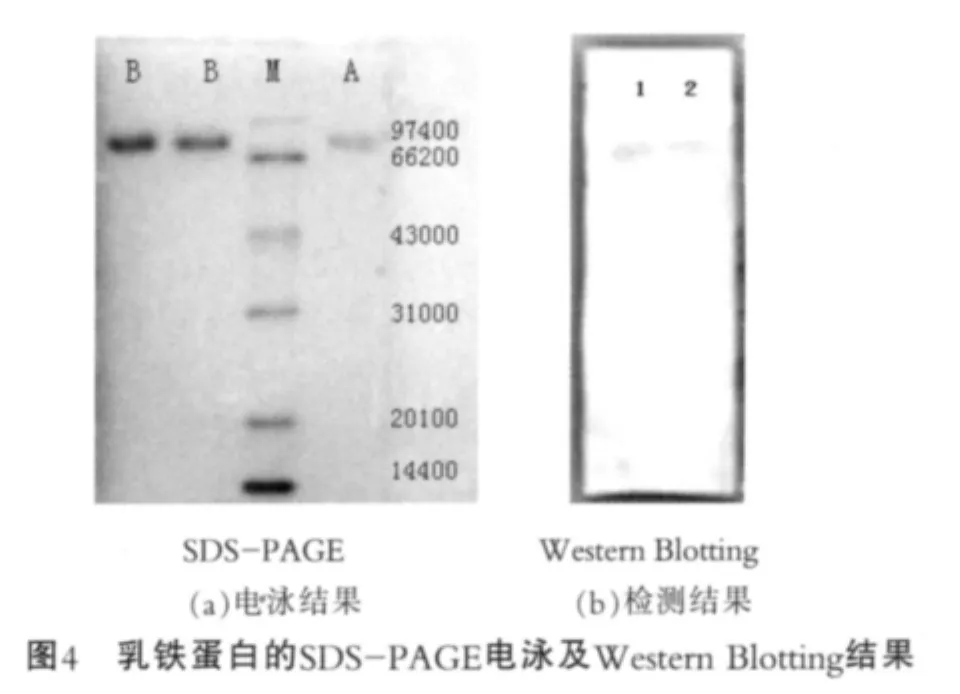
最终对纯化的蛋白与乳铁蛋白标品进行SDSPAGE电泳和Western Blotting检测。图4为乳铁蛋白的SDS-PAGE电泳及Western Blotting结果。 由图4(a)可以看出,纯化蛋白分子量在78 000 u左右,与标准乳铁蛋白分子量一致;由图4(b)可以看出,样品经Western Blotting检测,在标准品相同位置出现特异性条带,由此证明分离纯化的乳铁蛋白具有免疫活性;在试验中采用的一抗是通过人乳铁蛋白制备的抗体,这说明牛乳铁蛋白与人乳铁蛋白有较高同源性,免疫血清有较强的交叉反应能力,这与其他人报道的试验结果是一致的[15]。图4中,M为marker(低分子量标准蛋白);A为乳铁蛋白标品;B为分离纯化样品;1为乳铁蛋白标品;2为分离纯化样品。
3 结 论
本研究主要以生产干酪的副产物乳清为原料分离纯化乳铁蛋白,通过热钙法预处理干酪乳清,经超滤、离子交换层析,最终获得分子量为78 000 u,纯度为93.6%的乳铁蛋白,此法简单易行,成本较低,为工业化分离乳铁蛋白及乳清的合理利用提供了理论依据。
[1]MADUREIRA A R,PEREIRA C I,GOMES A M P,et al.Bovine Whey Proteins-Overview on Their Main Biological Properties[J].Food Res Int,2007,40:1197-1211.
[2]CONNEELY O M.Antiinflammatory Activities of Lactoferrin[J].J Am Coll Nutr,2001,20(5):389-395.
[3]LEVAY P F,VILJOEN M.Lactoferrin:A General Review[J].Haematologica,1995,80:252-267.
[4]GONZALEZ-CHAVEZ S A,AREVALO-GALLEGOS S,RASCON-CRUZ Q.Lactoferrin:Structure,Function and Applications[J].Int J Antimicrob Agents,2008,33(4):301.
[5]WAKABAYASHI H,YAMAUCHI K,TAKASE M.Lactoferrin Research,TechnologyandApplications[J].IntDairyJ,2006(16):1241-1251.
[6]吕立获,周晓云,姚婷婷,等.乳铁蛋白的分离工艺研究[J].中国乳品工业,2005,33(8):10-13.
[7]凌雪萍,庞广昌,李国强.乳铁蛋白的分离及纯化[J].食品与发酵工业,2003,29(5):7-10.
[8]叶震敏,王志耕,余为一.牛初乳中乳铁蛋白的分离纯化与免疫功能检测[J].食品科学,2005,26(7):208-211.
[9]WOLMAN F J,GONZALEZ MAGLIO D,GRASSELLI M,et al.OnestepLactoferrinPurificationfrom BovineWhey and Colostrum by Affinity MembraneChromatography[J].JMembrSci,2007,288:132-138.
[10]HWANG D,DAMODARAN S.Selective Precipitation and Removal of Lipids from Cheese Whey Using Chitosan[J].Agric Food Chem,1995,43:33-37.
[11]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2002:47-50.
[12]李珊珊,王加启,魏宏阳,等.乳及乳制品中乳铁蛋白定量测定法SDS-PAGE法的建立[J].中国乳业,2008,(9):42-46.
[13]TSUJI S,HIRATA Y,MATSUOKA K.Two Apparent Molecular forms of Bovine Lactoferrin[J].J Dairy Sci,1989,72:1130-1136.
[14]BrockJH.ThePhysiologyofLactoferrin[J].BiochemCellBiol,2002,80:1-6.
[15]林成招,张彦明,陈伟华,等.肝素亲和柱分离纯化乳铁蛋白[J].色谱,2003,21(4):434.
Study on separation and purification of lactoferrin in cheese whey
JIANG Chao1,2,ZHANG Yu1,CHEN Li-jun2,JIANG Tie-min2
(1.Dalian Polytechnic University,Dalian 116034,China;2.Beijing Sanyuan Foods Co.Ltd.,Beijing 100085,China)
This paper was intended to separate and purify lactoferrin from cheese whey through thermocalcic?precipitation,ultrafiltration and cation-exchange chromatography.It was showed that the pretreated cheese whey was applied to the resin,which was previously equilibrated on static state with phosphate buffer(pH=8.0)at 4℃,and eluted with 0.3 mol/L and 0.8 mol/L NaCl respectively in two stages.In addition,lactoferrin was analyzed qualitatively and quantitatively by Western Blotting and SDS-PAGE.The purity of lactoferrin product reached 93.6%.
cheese whey;lactoferrin;cation-exchange chromatography
TS252.59
A
1001-2230(2010)02-0010-03
2009-09-04
蒋超(1983-),男,硕士研究生,研究方向为乳品科学。
陈历俊
