急性运动中骨骼肌线粒体移动相关基因表达与线粒体动力学的关系
2010-01-04刘慧君姜宁赵斐翟克敏刘洪涛吉力立张勇
刘慧君姜宁赵斐翟克敏刘洪涛吉力立张勇
●成果报告Original Articles
急性运动中骨骼肌线粒体移动相关基因表达与线粒体动力学的关系
刘慧君1,2,姜宁2,1,赵斐2,翟克敏2,刘洪涛1,吉力立3,2,张勇2,1
目的:拟探讨急性运动中骨骼肌线粒体移动基因miro1、融合基因mfn2及分裂基因drp1的动态变化以及之间的相互关联。方法:以C57 BL/6小鼠一次中等强度负荷跑台运动(0°,13m/min)为实验模型,观察运动中骨骼肌miro1、mfn2、drp1mRNA表达变化,同时测定骨骼肌H2O2生成。结果:(1)120min急性运动过程中miro1mRNA表达均较安静组显著增高,E60~E120组mfn2mRNA表达较安静组显著降低;E60~E120组drp1mRNA表达较安静组增高。(2)在运动中各时间点骨骼肌H2O2均较安静组显著增高。结论:线粒体移动基因的动态表达可能作为融合分裂基因表达变化的先导,协同应对细胞能量需求急剧变化产生快速应答。
急性运动;骨骼肌;线粒体移动;线粒体融合分裂
线粒体是具有高度动态结构和能移动的细胞器,为适应细胞不同生理功能、细胞内信息传递及不同部位能量需要的变化,其在细胞中持续地进行着移动、分裂与融合、合成与降解,其形态、分布、数量都在不断地改变[1-3],从而维持适宜的动态平衡。目前已发现一些与线粒体形态动力学密切相关蛋白,如调控线粒体内、外膜融合的线粒体融合蛋白1/2(Mfn1/2)、调控线粒体分裂的动态相关蛋白1(Drp1)、线粒体移动相关蛋白Miro1/2等[4]。研究发现,线粒体形态和结构的动态变化深刻地影响着线粒体功能、细胞能量代谢、发育、凋亡、衰老、线粒体DNA复制等生命活动以及神经系统疾病、代谢性疾病等多种疾病发生过程[5-6]。如线粒体过度分裂将损害线粒体的能量代谢,融合与分裂的动态平衡能力下降直接导致细胞能量代谢紊乱,引发代谢性疾病[7];线粒体移动的变化、线粒体定位异常与机体发育、多种神经系统疾病密切相关[8]。
研究证实,能量需求旺盛的组织如心肌、骨骼肌中线粒体呈丰富的网络化结构。目前运动中线粒体形态动力学密切相关蛋白的研究尚少,运动过程中骨骼肌细胞能量需求急剧变化时,线粒体移动、融合分裂基因表达及与线粒体能量代谢的关联和意义仍不清楚。本实验拟以急性运动为模型,研究骨骼肌在能量需求急剧变化过程中,线粒体移动与融合分裂基因表达的动态变化,并初步探讨线粒体移动、融合、分裂基因动态表达之间的可能关系及其生理意义。
1 材料与方法
1.1 实验动物与分组
雄性C57 BL/6小鼠40只(19~21 g),7~8周龄,购自北京维通利华实验动物技术有限公司(SPF级),于正式实验前一周购入,在本实验室分笼饲养,自由饮食,饲料为标准啮齿类饲料。饲养环境为21~24℃,相对湿度45%~55%,每日光照12 h。将小鼠随机分为5组,组间体重无显著性差异。其中1组为安静对照组(R,n=8),4组为急性运动组,分别以不同组代表各时间点:运动30 min组(E30,n=8)、运动60 m in组(E60,n=8)、运动90min组(E90,n=8)、运动120min组(E120,n=8)。
1.2 急性运动模型
以跑台运动作为运动应激模型。实验前所有动物均未进行过跑台运动。正式实验前,动物先在跑台上进行5min跑步以适应跑台环境(0,5 m/min)。运动组正式实验采用中等强度运动(0,13m/min)。
1.3 骨骼肌样品制备
安静对照组动物于安静状态、其他组于运动中不同时间点(E30、E60、E90、E120)即刻颈椎脱臼处死,迅速取出下肢骨骼肌,部分样本液氮速冻,-80℃冻存备用进行基因测定;另外部分骨骼肌样本立即进行H2O2测定。以上操作均在冰浴中进行。
1.4 骨骼肌m iro1、m fn2和drp1mRNA荧光定量PCR分析
使用Trizol(Invitrogen)提取骨骼肌总RNA,通过0.8%的琼脂糖电泳和紫外分光光度计确定总RNA完整性和纯度;按照RevertAid First Strand cDNA Synthesis Kit(Fermentas)说明书进行逆转录反应。采用Applied Biosystems StepOne Real-Time PCR System(BIO-RAD)进行荧光定量PCR反应,引物由宝生物工程(大连)有限公司合成,荧光定量PCR条件:预变性95℃/30 s;95℃/5 s,60℃/30 s,共40个循环(见表1)。根据SYBR~Premix Ex Taq Kit(BIO-RAD)说明书配制反应体系,目的基因的相对变化量(Fold Change)=2-Δ(ΔCT),其中ΔCT=CTtarget-CT18s,Δ(ΔCT)=ΔCTstimulated-ΔCTcontrol。
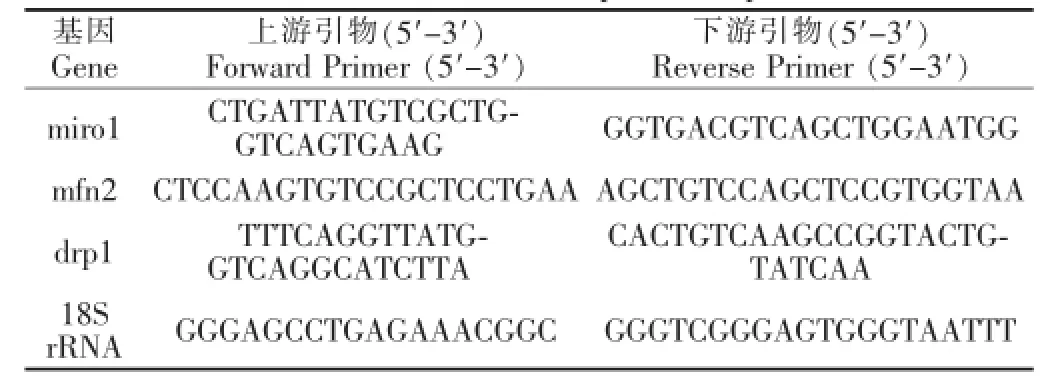
表1 荧光定量PCR引物序列Table 1 Real-time PCR prim er sequences
1.5 骨骼肌H2O 2测定
根据H2O2与钼酸铵作用生成稳定的黄色过氧钼酸络合物的原理,在可见-紫外分光光度计(Beckman Co,USA)波长405 nm测定其络合物生成量可计算H2O2的浓度。组织剪碎,去除筋膜、脂肪;加入生理盐水用玻璃匀浆器匀浆;2 500 r/min 4℃离心10min,取上清,严格按照南京建成生物工程研究所试剂盒说明书操作进行检测。
1.6 统计学分析
2 结果
2.1 m iro1和m fn2、drp1 m RNA含量的变化
如图1所示,120min运动过程中miro1mRNA表达均较安静组显著增高,E30、E60、E90、E120组分别较安静组增高32.8%、107.6%、63.8%及44.8%,E60组达峰值。如图2所示,E60、E90、E120组m fn2mRNA表达均较安静组明显减少,分别较安静组降低了34.6%、69.3%及60.4%。如图3所示,E60、E90、E120组drp1 mRNA表达均较安静组分别增高20.5%、35.3%及22.0%。
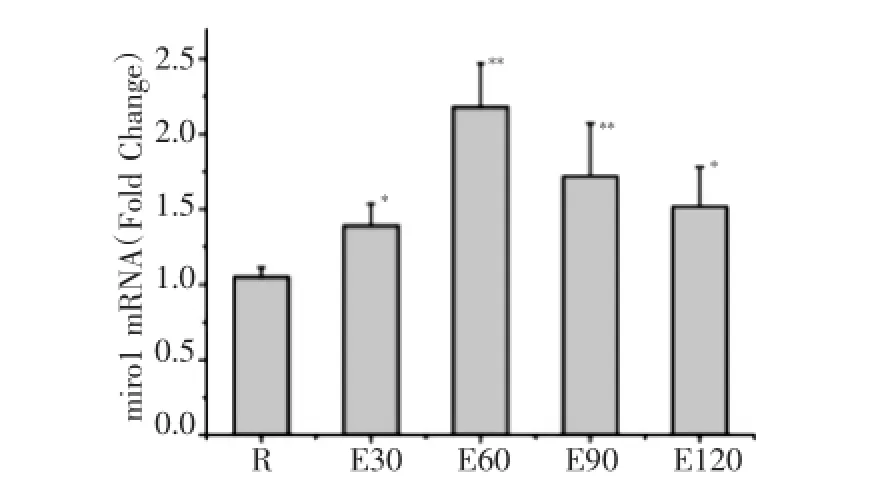
图1 急性运动中小鼠骨骼肌m iro1m RNA表达的动态变化(与安静组比较,*P<0.05**P<0.01,n=8,以下同)Fig.1 Dynam ics expression ofm iro1 m RNA in m ouse skeletal muscle during acute exercise

图2 急性运动中小鼠骨骼肌m fn2mRNA表达的动态变化Fig.2 Dynamics exp ression ofm fn2m RNA inmouse skeletal muscle during acute exercise
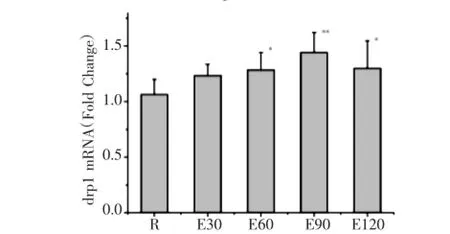
图3 急性运动中小鼠骨骼肌drp1 m RNA表达的动态变化Fig.3 Dynam ics expression ofd rp1m RNA inmouse skeleta l m uscle during acute exercise
2.2 骨骼肌H2O2浓度变化
如图4所示,120 min运动过程中骨骼肌H2O2均较安静组显著增高,其中E30、E60和E90组H2O2持续增高,分别较安静组增高了22.1%、26.7%、37.6%,E90组达峰值,E120组比E90组略有降低但仍明显高于安静组。
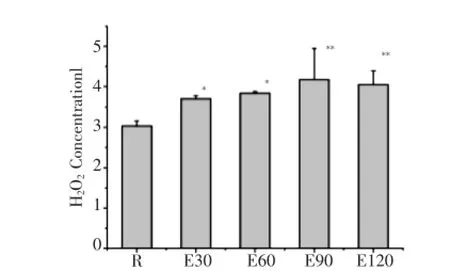
图4 急性运动中小鼠骨骼肌H2O2浓度动态变化Fig.4 Dynamics ofH2O2 concentration inmouse skeleta lmuscle during acute exercise
3 讨论
近年来的研究表明,线粒体在细胞中不断地移动、融合与分裂,其形态分布不断地变化,以应对不同生理功能和细胞内不同区域的能量需要,形成动态平衡的“整合性应答”。线粒体形态分布的动态变化对线粒体功能、细胞能量代谢、凋亡等生命活动具有重要的生理意义。如L6E9肌管细胞中,mfn2表达下调可降低呼吸链复合体I、Ⅱ、III、V亚单位的表达,而m fn2表达上调则增加这些基因的表达,促进线粒体能量代谢[9]。通过RNA干扰减少HeLa细胞中drp1表达,使线粒体呼吸速率降低、ATP合成减少,线粒体膜流动性增加[10]。线粒体倾向于聚集在特殊的亚细胞部位提供能量、参与如钙缓冲等胞内信号传递[3,[12]。Waterham HR等报道了首例Drp1突变的病例,该突变为致死突变,可引起线粒体和过氧化物酶体形态改变,并引起出生后大脑发育障碍、视神经萎缩、高乳酸血症等一系列严重的并发症[13]。由此可见,线粒体形态动力学变化参与细胞内信息传递、能量代谢,与细胞生理病理密切相关。
目前,运动过程中骨骼肌这一能量代谢旺盛的组织中线粒体移动、融合分裂基因表达的研究鲜见报道。本研究发现:120 m in急性运动过程中E60~E120组m fn2 mRNA表达均较安静组明显降低;E60~E120组drp1mRNA表达均较安静组增高。并且急性运动过程中m fn2 mRNA表达显著下调,drp1 mRNA表达上调。以上融合分裂基因动态变化的结果与本实验室前期报道首次发现急性运动中大鼠骨骼肌Mfn1/2 mRNA表达及蛋白含量减少,分裂蛋白Fis1mRNA表达及蛋白含量增加的结果趋势一致[14],再次证实了线粒体的动态变化可能适应了细胞能量代谢的需求。正常的线粒体分裂融合动态变化直接影响线粒体的氧化磷酸化功能[9-10]。一般认为线粒体融合成网络利于能量和信息在不同线粒体中传递,线粒体内容物及mtDNA交换互补[15];线粒体分裂利于线粒体根据能量需求重新分布,提高线粒体能量代谢速率,合成更多ATP,同时保护线粒体免于遭受过多损伤[10,16]。以上研究提示:急性运动中线粒体融合受抑制而趋于分裂,从而可能提高线粒体能量代谢速率,以满足细胞对能量的需求。
近年来研究发现,线粒体移动与线粒体融合分裂之间具有密切关联。如HeLa细胞中,Dynein/dynactin复合体(线粒体移动马达蛋白)通过影响drp1在胞内重新分布调控线粒体形态分布,当Dynein功能破坏导致线粒体分布于核周且形成长的分支状结构[17]。H9C2及原代脑皮层神经细胞中,细胞胞浆中游离钙离子浓度([Ca2+]i)静息水平时,过表达Miro增强线粒体移动并促进线粒体趋于融合;[Ca2+]i升高或钙振荡时,过表达Miro促进线粒体趋于分裂[18]。以上研究提示,线粒体移动很可能作为线粒体融合与分裂介导的网络结构变化的基础,通过影响融合分裂,进而影响线粒体能量代谢。本研究发现:120min急性运动中miro1mRNA表达均较安静组显著增高,且m iro1基因表达的改变先于m fn2、drp1基因表达变化。提示:急性运动中线粒体移动增加,且很可能通过影响线粒体融合与分裂基因,促进线粒体网络结构趋于分裂以利于线粒体重新分布,以应对细胞能量需求的急剧变化。
目前,有关线粒体形态分布的调控机制尚不清晰。相关研究发现活性氧(ROS)可以调控线粒体移动融合分裂动态改变。ROS是把双刃剑,较低浓度的H2O2等活性氧在调节细胞增殖、分化、凋亡以及细胞信号转导中起着重要作用[19];高浓度的ROS能够诱导细胞死亡[20],氧化脂质、蛋白、DNA等多种细胞成分,从而对细胞完整性造成威胁[21]。Barsoum发现NO可以诱导线粒体分裂使线粒体活性下降,ATP产生减少,ROS增多,对神经元细胞产生毒性引起神经损伤病变[22]。原代前脑神经细胞中,NO诱导线粒体移动停止,同时线粒体膜电位降低[23]。本实验结果表明,120min急性运动过程中各组骨骼肌H2O2均较安静组显著增高。根据前述实验结果及相关研究分析提示:一次急性运动中H2O2生成急剧增多,同时线粒体移动基因表达迅速增加,线粒体通过移动分布的变化应对能量需求改变产生“早期快速应答”,在此基础上线粒体融合分裂网络结构动态平衡变化产生“整合性应答”。在这一应答过程中,线粒体的动力学变化导致细胞内线粒体不断地进行重构,可能有助于线粒体与细胞胞浆和其他细胞器之间的物质、信息和能量交换以满足细胞对能量的快速需求。
目前,对运动过程中线粒体移动、融合分裂的研究还不够深入,线粒体融合分裂之间的偶联机制及线粒体移动与融合分裂的关系以及具体的调控机制和生理意义尚不清楚。骨骼肌线粒体移动基因变化是否作为融合分裂基因表达变化的先导影响线粒体动力学;ROS是否作为信号分子参与调控线粒体动力学改变及其与线粒体能量代谢的关系等问题还有待进一步深入探讨。
[1]Heymann JA,Hinshaw JE.Dynaminsataglance[J].Journalof Cell Science,2009,122(19):3427-3431.
[2]Liu X G,Weaver D,Shirihai O,et al.Mitochondrial'kiss-and-run':interplay betweenmitochondrialmotility and fusion-fission dynamics[J].The EMBO Journal,2009,28(20):3 074-3 089.
[3]Yi M,Weaver D,Hajnóczky G.Control ofmitochondrialmotility and distribution by the calcium signal:ahomeostatic circuit[J].Journal of Cell Biology,2004,167:661-672.
[4]马国栋,张勇.运动与解偶联蛋白3(UCP3)介导的线粒体活性氧代谢调控研究进展[J].西安体育学院学报,2007,(4):71-78.
[5]夏云健,时庆德,蒋春笋,等.运动性疲劳状态下大鼠心肌线粒体氧化磷酸化偶联的变化[J].天津体育学院学报,2002,(2):22-24.
[6]常波.运动源性自由基对大鼠肾脏线粒体游离钙和ATP合成能力的影响[J].上海体育学院学报,2006,(2):76-79,83.
[7]Chan DC.MitochondrialFusion and Fission inMammals[J].AnnualReview of Celland Developmental Biology,2006,22:79-99.
[8]Guo X,Macleod G.T,Wellington A,etal.The GTPase dMiro is required for axonaltransportofmitochondriatoDrosophilasynapses[J].Neuron,2005,47(3):379-393.
[9]Pich S,Bach D,Briones P,et al.The Charcot-Marie-Tooth type 2A gene product,Mfn2,up-regulates fueloxidationthrough expression of OXPHOS system[J].Human Molecular Genetics,2005,14(11):1 405-1 415.
[10]Benard G,Bellance N,James D,et al.Mitochondrial bioenergetics and structural network organization[J].Journal of Cell Science,2007,120:838-848.
[11]Park M K,Ashby M C,Erdemli G,et al.Perinuclear and sub-plasmalemmal mitochondria have distinct functions in the regulation of cellular calcium transport[J].The EMBO Journal,2001,17:1 863-1874.
[12]Bach D,Pich S,Soriano FX,etal.Mitofusin-2 determinesmitochondrial network architecture and mitochondrialmetabolism.A novel regulatory mechanism altered in obesity[J].Journal of Biological Chemistry,2003,278:17190-17197.
[13]Waterham H R,Koster J,van Roermund CW,et al.A lethal defect of mitochondrial and peroxisomal fission[J].The New England Journal of Medicine,2007,356:1 736-1 741.
[14]Ding H,Jing N,Liu H J,et al.Response of Mitochondrial Fusion and Fission Protein Gene Expression to Exercise in Rat SkeletalMuscle[J].Biochim Biophy Acta,2009,8:7.
[15]Legros F,Lombes A,Frachon P,etal.Mitochondrial fusion in human cells is efficient,requires the inner membrane potential,and ismediated by mitofusins[J].Molecular Biology of the Cell,2002,13(12):4343-4 354.
[16]Pletjushkina O Y,Lyamzaev K G,Popova E N,et al.Effect of oxidative stresson dynamicsofmitochondrial reticulum[J].Biochim Biophys Acta,2006,1757:518-524.
[17]Varadi A,Johnson-Cadwell L I,Cirulli V,et al.Cytoplasmic dynein regulates the subcellular distribution ofmitochondria by controlling the recruitmentof the fission factor dynamin-related protein-1[J].Journal of CellScience,2004,117:4 389-4 400.
[18]Saotome M,Safiulina D,Szabadkai G.Bidirectional Ca2+-dependent controlofmitochondrialdynamicsby theMiroGTPase[J].Proceedings of the National Academy of Sciences of the United States of Americ(PNAS),2008,105(52):20 728-20 733.
[19]Peus D,BeyerLe A,VasaM,et al.Antipsoriatic drug anthralin induces EGF receptor phosphorylation in kerationocytes:requirement for H2O2 generation[J].Experimental Dermatology,2004,13(2):78-85.
[20]Orzechowski A,Grizard J.Jank M.et al.Dexamethasone-mediated regulation ofdeathand diferentiation ofmusclecells Ishydrogen peroxide involved in theprocess[J].Reproduction Nutrition Development,2002,42(3):l97-216.
[21]Scherz-Shouval R,Elazar Z.ROS,mitochondria and the regulation of autophagy[J].Trends in Cell Biology,2007,17(9):422-427.
[22]Barsoum M J,Yuan H,Gerencser A A,et al.Nitric oxide-induced mitochondrial fission is regulated by dynamin-related GTPases in neurons[J].The EMBO Journal,2006,25(16):3 900-3 911.
[23]RintoulGL,BennettV J,PapaconstandinouNA,etal.Nitricoxide inhibits mitochondrialmovementin forebrain neuronsassociatedwith disruption of mitochondrialmembranepotential[J].JournalofNeurochemistry,2006,97(3):800-806.
The Relationship of M itochond rial M otility-related Gene Expression and M itochond rial Dynam ic during a Bout of Acute Exercise
LIU Huijun1,2,JIANG Ning2,1,ZHAO Fei2,ZHAIKemin2,LIU Hongtao1,JILili3,2,ZHANG Yong2,1
(1.Institute of Health and Environmental Medicine,Academy of Military Medical Sciences,Tianjin 300050,China;2.Tianjin Key Laboratory of Exercise Physiology and Sports Medicine,Tianjin University of Sport,Tianjin 300381,China;3 Dept.of Kinesiology,University of Wisconsin-Madison,Madison,WI 53706,USA)
Objective:The purpose of this study was to investigate the gene expressions ofmiro1,m fn2,drp1 during an acute bout of prolonged exercise and to analysis the relations of the gene expressions.Methods:C57 BL/6 mouse underwent amidd le intensity treadmill running with 0,13m/min.Gene expressions ofmirol,mfn2 and drp1 mRNA were detected,skeletalmuscle H2O2concentration was alsomeasured.Results:First,compared with resting group(R), miro1 mRNA contents were significant increased during 120 min of exercise;mfn2 mRNA contentswere significant decreased in groups E60~E120;drpl mRNA expression increased in groups E60~E120.second,H2O2contents of skeletalmuscle were progressively increased during 120min of exercise.Conclusion:Mitochondrialmotilitymaybe the base ofmitochondrial fusion-fission,the gene expression ofmitochondrial fusion-fission and motility proteins in skeletalmusclemight respond rapidly tomatch the energy demand during exercise.
acute exercise;skeletalmuscle;mitochondrialmotility;mitochondrial fusion-fission
G 804.2
A
1005-0000(2010)02-0118-04
2010-01-07;
2010-01-31;录用日期:2010-02-01
国家自然科学基金项目(项目编号:30771048);天津市社会发展重大科技攻关项目(项目编号:05YFGDSF02100)
刘慧君(1973-),女,天津市人,天津体育学院助理研究员,军事医学科学院在读博士研究生。通讯作者:张勇(1956-),男,湖北人,天津体育学院教授,军事医学科学院博士生导师。Email:yzhang@tjus.edu.cn
1.军事医学科学院卫生学医学研究所,天津300050;2.天津体育学院天津市运动生理与运动学重点实验室,天津300381;3.Deportmentof kinesiology,University ofWisoonsin-Madison,Madison,WI53706,USA。
