补充精氨酸对过度训练大鼠肌糖原、AMPK及GLUT-4的影响
2010-01-04刘无逸陆爱云
刘无逸,陆爱云
●研究报道Short Communications
补充精氨酸对过度训练大鼠肌糖原、AMPK及GLUT-4的影响
刘无逸,陆爱云
目的:观察体外补充L-精氨酸对过度训练大鼠的作用。方法:9周龄SD雌性大鼠40只,随机分为安静对照组(A组)、大强度运动组(B组)、大强度运动服L-精氨酸组(C组)、过度训练组(D组),其中D1组为过度训练组,D2组为过度训练加服L-精氨酸组。上坡跑训练9周后测各组白腓肠肌和比目鱼肌的肌糖原含量、AMPK活性和肌膜GLUT-4含量。结果:B组和D1组糖原含量较A组有升高趋势,但无显著性;C组显著高于A组(P<0.01);D2组大鼠比目鱼肌糖原含量较A组显著升高(P<0.01);D2组较D1组升高,但未达到显著水平(P>0.05)。B组、C组和D2组AMPK活性显著高于A组(P<0.01);D2组较D1组有明显增加,差异显著(P<0.05)。B组、C组和D2组GLUT-4含量分别较A组增加100%左右,D1组增加11%;D2组较D1组增加57%。结论:体外补充L-精氨酸可能有利于延缓或治疗过度训练。
大鼠;过度训练;L-精氨酸;肌糖原;AMP-活化的蛋白激酶;葡萄糖载体蛋白-4
目前,过度训练在运动员中仍是较为常见的运动性疾病之一。研究认为,高水平运动员常在他们的职业生涯中发生过度训练,如径赛运动员发生率达60%,澳大利亚国家游泳队在半年的赛季中发生率是21%,印度国家蓝球队在6周集训期间发生率是33%,半职业的足球运动员在5个月的赛季以后发生率在50%以上。尽管过度训练的发病率较高,但产生的机制目前尚未完全明了,许多研究认为与代谢紊乱关系密切,Petibois等[1]将其称为代谢紊乱综合症(a metabolism alteration process syndrome)。
左旋精氨酸(L-arginine,L-Arg)是体内合成一氧化氮(NO)的天然底物,即L-Arg和O2在一氧化氮合酶(nitric oxide synthase,NOS)的作用下,生成NO和瓜氨酸(L-Cit)。NO在体内具有广泛的生理作用,其中对骨骼肌葡萄糖转运具有促进作用。近年来在对心、肺、肝等脏器缺血/再灌注的研究中发现,L-Arg可明显减轻再灌注损伤[2],同时,L-Arg也被用于烧伤、心力衰竭等多种临床疾病。本实验的目的是观察体外补充(口服)L-Arg对过度训练大鼠骨骼肌糖原含量及部分调节因素的影响,探讨过度训练发生的可能机制。
1 材料与方法
1.1 实验对象
1.1.1 大鼠分组9周龄Sprague-Dawley(SD)雌性大鼠40只,由中国科学院上海实验动物中心提供,以国家标准啮齿类动物饲料(由上海海军医学研究所动物中心提供)每笼5只(鼠笼体积40 cm×27 cm×22 cm)饲养,自由进食、饮水,室温20℃~25℃,相对湿度45%~55%,每天光照时间12 h。大鼠随机分4个大组:对照组(A组),7只;大强度运动组(B组),7只;大强度运动服L-精氨酸组(C组),8只;过度训练组(D组),18只;再分D1组9只;D2组(服L-精氨酸组),9只。
1.2 主要试剂和测试方法
1.2.1 主要试剂与材料肌糖原测定试剂盒由南京建成生物研究所提供;SAMSPeptide为UPSTATE产品;[γ-32P]ATP,福瑞生物工程公司核酸研究室提供;兔抗鼠GLUT-4,Chemicon产品;辣根酶标记山羊抗兔IgG,北京中山生物技术有限公司;三磷酸腺苷(ATP),Sigma产品;Whatman P81滤纸,Whatman公司产品;L-精氨酸,上海医药集团上海化学试剂公司提供;一氧化氮测定试剂盒和一氧化氮合酶测定试剂盒,南京建成生物研究所提供。1.2.2测试方法称取肌肉组织120mg用眼科剪剪碎后,加缓冲液A(210mM蔗糖,2mMEGTA,40mM NaCl,30mM HEPES,pH 7.4,蛋白酶抑制剂)3 mL,置试管内冰水浴中用MICCRA D-8型匀浆器15 s×2次匀浆。取1 mL匀浆上清液置-78℃冰箱保存备用,其余匀浆液经超速离心提取肌膜。
肌糖原含量、肌NO含量、肌NOS活性均按南京建成生物研究所提供的试剂盒说明书操作,蛋白定量采用BCA法;肌AMP-活化的蛋白激酶(AMPK)活性的测试根据Derave等[5]方法进行;肌膜葡萄糖载体蛋白-4葡萄糖载体蛋白-4(GLUT-4)蛋白测定按Dubouchaud等[6]的方法进行。
1.3 统计方法
实验数据采用SPSS 9.0统计软件处理,计量资料用均数±标准差(D)表示,计数资料用百分率表示,组间比较分别采用单因素方差分析。显著性标准为P<0.05,P<0.01为差异具有高度显著性。
2 结果
2.1 训练期间大鼠的体重变化
9周训练后,D1和D2组大鼠毛发耸立无光泽,活动减少,反应迟缓,后期不能完成120min的运动时间;但体重与其他各组比较差异均无显著性(P>0.05)(见图1)。
图1 大鼠训练期间体重变化Figure 1 Changes in rats body weightduring breeding
2.2 各组大鼠肌糖原含量
大鼠在9周运动训练后比目鱼肌安静肌糖原含量有明显的升高(见表2),与A组比较C组和D2组达到显著和非常显著水平(P<0.05;P<0.01);D2组与D1组比较糖原含量虽有升高,但尚未达到显著水平。
9周训练后白腓肠肌糖原含量有增加趋势,其中C组与A组比较有非常显著的差异,P<0.01(见表2);D2组与D1组比较糖原含量虽有升高,但未达到显著水平。

表2 各组大鼠肌糖原含量(m g/g肌组织)Table 2 Themusc le glycogen contents in various groups(mg/g wetm uscle)
2.3 各组大鼠肌AMPK活性
9周耐力训练后,大鼠比目鱼肌AMPK活性有升高的趋势,B组与A组比较差异具有显著性(P<0.05)。D1组肌AMPK活性与B组比较肌AMPK活性下降的差异非常显著(P<0.01)。D2组肌AMPK活性较D1组提高,差异显著(P<0.05)(见表3)。
在大鼠白腓肠肌,AMPK活性B组、C组和D2组均较A组增加,差异均非常显著(P<0.01)。D1组与B组比较,活性下降具有非常显著意义(P<0.01);D2组与D1组比较,活性明显增加,差异非常显著(P<0.01)。腓肠肌AMPK活性D2组较D1组提高,具有非常显著的差异(P<0.01)(见表3)。
2.4 各组大鼠比目鱼肌肌膜GLUT-4蛋白含量
各组比目鱼肌肌膜GLUT-4蛋白质印迹试验结果见图2(S为参照样本的膜蛋白)。用Image-pro plus分析软件对各条带的分析结果见表4。
9周耐力训练使B组、C组、D1组和D2组大鼠比目鱼肌肌膜GLUT-4蛋白积分光密度分别较A组增加115%、92%、11%和75%;D1组GLUT-4蛋白积分光密度较B组下降48%,D2组下降19%;D2组与D1组比较GLUT-4蛋白积分光密度增加了57%。
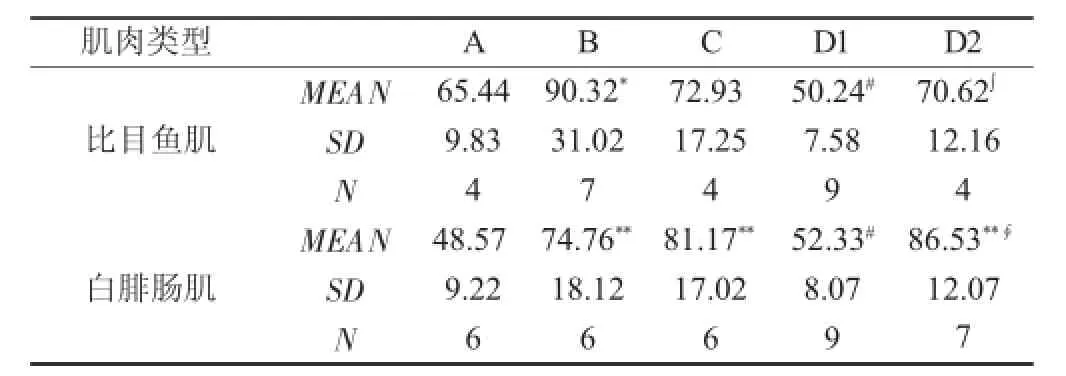
表3 各组AMPK活性(nm ol·m in-1·mg-1 prot)Table 3 Muscle AMPKactivity in variousg loups(nmol·m in-1·mg-1 pro)

图2 各组比目鱼肌GLUT-4蛋白含量(S为参照)Figure 2 sarcolemma GLUT4 protein contens in soleus

表4 各组比目鱼肌GLUT-4蛋白含量比较Table 4 sa rcolemma GLUT4 protein contens in soleus
2.5 各组大鼠肌NOS活性
经9周耐力训练,B组和C组比目鱼肌和白腓肠肌NOS活性较A组有一定提高(见表5),但均未达到统计学意义;D1组和D2组较B组降低,具有显著性(P<0.05);D2组与D1组之间无显著性差异(P>0.05)。

表5 各组肌NOS活性(U/mg prot)Table 5 Musc le NOS activity in various gloups(U/mg prot)
2.6 各组大鼠肌NO含量
9周耐力训练后B组和C组大鼠比目鱼肌NO含量略有升高,但无统计学意义(见表6);D1组和D2组比目鱼肌NO含量基本维持在A组水平。在白腓肠肌,B组和C组肌NO含量较A组升高,差异均非常显著,P<0.01;D1组和D2组肌NO含量分别较B组和C组降低,D1组差异具有显著性,P<0.05。
3 讨论
L-Arg被认为是免疫营养成分之一,在体内可通过NO合成途径和诱导生长激素、胰岛素及高血糖素等作用于免疫系统的途径发挥生理作用[7],被用于严重的创伤、感染和应激等。
过度训练是运动员在运动训练中较容易出现的一种运动性疾病,是长期应激状态下的一种病理状态,主要表现为身体机能低下,其产生的机制较为复杂,Petibois等[1]将其称之谓代谢紊乱综合症,其依据之一认为过度训练与肌糖原耗竭有关[8]。我们将L-Arg用于过度训练大鼠,观察对肌糖原含量及部分调节因素可能产生的影响。
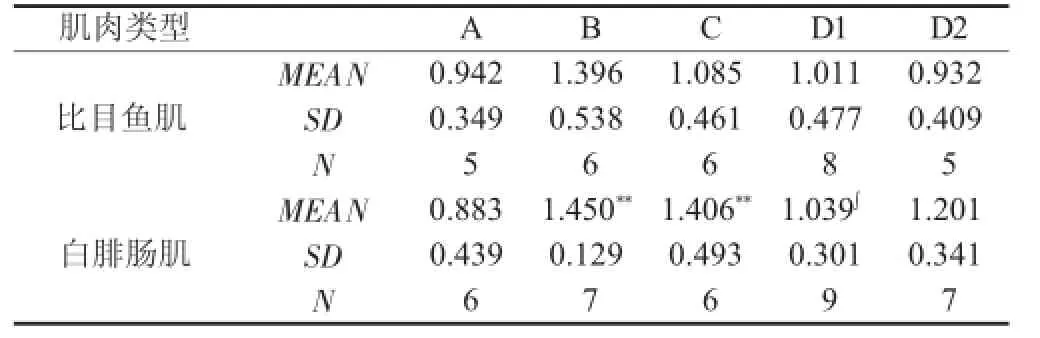
表6 各组肌NO含量(um ol/g pro t)Table 6 Musc le NO contents in various gloups(umol/g p rot)
实验中我们发现补充L-Arg可提高正常训练大鼠和过度训练大鼠肌糖原的含量,比目鱼肌的表现尤为明显,机制可能与NO可促进骨骼肌葡萄糖转运有关。肌细胞对葡萄糖的转运有两条途径,即胰岛素依赖途径和非胰岛素依赖途径。据Balon和Nadler[9]的实验发现,L-Arg可引起趾长伸肌NO浓度升高,增加大鼠骨骼肌基础葡萄糖转运。L-Arg的这种作用可被L-NG-甲基精氨酸(L-NMMA,NOS的阻断剂)抑制,且不受胰岛素浓度的影响,表明NOS/NO参与骨骼肌葡萄糖代谢是通过非胰岛素依赖的途径进行的[10-11]。
长期耐力运动可促进NOS活性的提高[12],增加NO的合成,但我们发现在过度训练状态下,大鼠肌NOS活性较正常训练组显著下降,其值甚至低于安静对照组的水平。补充L-Arg对其活性无激活作用,显示在过度训练状态下,NOS的活性受到抑制。
正常情况下,NOS的活性受AMP-活化的蛋白激酶(AMP-activated protein kinase,AMPK)的调节。近年来的研究表明,AMPK能感知细胞能量代谢状态的改变,并通过影响细胞物质代谢的多个环节维持细胞能量供求平衡。当细胞ATP减少时,AMPK一方面抑制糖原、脂肪和胆固醇合成,减少能量消耗;另一方面促进脂肪酸氧化、葡萄糖转运,增加能量的产生。因此,被认为是调节细胞能量代谢的开关[13]。
实验显示过度训练大鼠肌AMPK活性与正常训练组比较受到明显抑制,补充L-Arg可显著提高肌AMPK的活性,显示L-Arg对肌AMPK活性具有一定的保护作用,但这一现象从肌收缩促进葡萄糖转运增加的信号链角度很难解释。
Fryer等学者认为[14]AMPK可通过NOS依赖的途径促进骨骼肌的葡萄糖摄取。他们发现NOS活性随着葡萄糖转运而增加,NOS抑制剂可阻断AMPK活化引起的葡萄糖转运作用。在体外,nNOS和eNOS能被AMPK磷酸化,其产物NO可激活鸟苷酸环化酶,然后催化cGMP的合成。用鸟苷酸环化酶抑制剂可防止这些细胞由AICAR(5-Am inoim idazole-4-carboxam ide 1-β-D-ribofuranoside,为AMPK刺激剂)刺激引起的葡萄糖转运。这些结果表明AMPK在诱导葡萄糖转运方面,NOS是重要因素之一。目前认为这一信号链由肌收缩发动,随着肌组织中AMP含量增加使AMPK活化,后者可引起NOS磷酸化(活化),增加NO的合成,NO进一步活化鸟氨酸环化酶,加快cGMP形成,促进细胞内GLUT-4向肌膜转位,提高葡萄糖的转运[15]。可见,NO位于AMPK的下游,对AMPK不产生直接的作用,最大的可能是通过间接的途径减轻AMPK抑制因子对AMPK活性的抑制,提高AMPK的活性。如通过cGMP对AMPK产生一定的调节作用。
尽管长期耐力训练可提高NOS活性,过度训练状态下,NOS活性受到抑制,但实验中补充L-Arg对正常训练大鼠或过度训练大鼠比目鱼肌和白腓肠肌的NO含量无显著性的改变。这可能与NO分子在体内半衰期短(约5 s左右)、作用迅速,我们采用的分析方法不够灵敏有关。
肌细胞摄取葡萄糖需葡萄糖转运蛋白(GLUT)作为载体,其中载体蛋白4(Glucose transporter type 4,GLUT-4)是骨骼肌葡萄糖跨膜转运的主要载体,葡萄糖转运被认为是肌细胞葡萄糖代谢的限速步骤。安静时,GLUT-4主要分布在细胞内的管泡状结构(TGN区)内,当受到胰岛素或肌收缩刺激时,可向胞膜和T管转移,增加肌膜表面GLTU-4的含量。
我们在实验中发现过度训练大鼠肌膜GLUT-4含量较正常训练组减少48%,补充L-Arg可使过度训练大鼠肌膜GLUT-4含量增加57%,但在正常训练组大鼠这一作用不明显。前者可能因为过度训练时,AMPK的活性受到抑制,对NOS的活化作用减弱。补充外源性L-Arg,增加了NOS的作用底物,有利于NO的产生,促进细胞内GLUT-4向肌膜转位,提高胞膜的GLUT-4含量。后者可能由于肌AMPK、NOS活性正常,增加底物对进一步提高NO的意义不大。因此,在正常训练状态下,补充外源性L-Arg对提高肌膜GLUT-4含量的作用不明显。
过度训练产生的机制复杂,肌细胞能量代谢障碍可能是重要因素之一。从肌细胞对葡萄糖转运角度出发,过度训练状态下虽然肌AMPK活性、NOS活性受到抑制,肌膜GLUT-4含量降低,但糖原含量基本正常。补充L-Arg可在一定程度上改善AMPK的活性,提高肌膜GLUT-4含量,增加肌糖原的含量,可能有利于延缓或治疗过度训练。实验显示过度训练在肌糖原含量基本正常情况下仍可发生,可能提示肌细胞对糖利用的障碍,值得进一步研究。
4 结论
体外补充L-精氨酸可增加过度训练大鼠肌糖原的含量,并可提高肌AMPK活性,增加肌膜GLUT-4含量,可能有利于延缓或治疗过度训练。
[1]Petibois C,Cazorla G,Poortmans J R,et al.Biochemical aspects of overtraining in endurance sports:the metabolism alteration process syndrome[J].Sports Med,2003,33(2):83-94.
[2]王万铁,郝卯林,郁引飞,等.左旋精氨酸对兔肺缺血/再灌注损伤时细胞凋亡的影响[J].中国急救医学,2006,26(2):126-128.
[3]Bedford TG,Tipton CM,Wilson NC,etal.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].JAppl Physiol,1979,47(6):1278-1 283.
[4]叶剑飞,余闽,岑浩望.过度训练的病理生理及康复[J].中国运动医学杂志,1992,11(1):15-21.
[5]Derave W,Ai H,Ihlemann J,et al,Ploug T.Dissociation of AMP-Activated Protein Kinase Activation and Glucose Transport in Contracting Slow-Twitch Muscle[J].Diabetes,2000,49(8):1 281-1 287.
[6]Dubouchaud H.Endurance training,expression,and physiology of LDH,MCT1,and MCT4 in human skeletalmuscle[J].Am JPhysiol,2000,278:E571-E579.
[7]越玉明,刘维福,谷仁烨.免疫营养新进展[J].日本医学介绍,2006,27(4):176-179.
[8]Snyder A C.Overtraining and glycogen dep letion hypothesis[J].Med Sci Sports Exerc,1998,30(7):1 146-1 150.
[9]Balon TW,Nadler J L.Nitric oxide release is present from incubated skeletalmusclepreparations[J].Jappl physiol,1994,77:2 549-2 521.
[10]Etgen GJ Jr,Fryburg D A,Gibbs E M.Nitric oxide stimulates skeletalmuscle glucose transport through a calcium/contraction-and phosphatidylinositol-3-kinase-independentpathway[J].Diabetes,1997,46:1915-1 919.
[11]Roberts C K,Barnard R J,Scheck S H,et al.Exercise-stimulated glucose transport in skeletalmuscle is nitric oxide dependent[J].Am J Physiol Endocrinol Metab,1997,273:E220-E225.
[12]WinderW W.Energy-sensing and signaling by AMP-activated protein kinase in skeletalmuscle[J].JAppl Physiol,2001,91:1 017-1 028.
[13]Friedlander A L,Casazza G A,Horning M A,et al.Training-induced alterations of carbohydrate metabolism in women:Women respond differently from men[J].JApp l Physiol,1998,85:1 175-1 186.
[14]Fryer LGD,Hajduch E,Rencurel F,et al.Activation of glucose transportby AMP-activated protein kinase via stimulation ofnitric oxide synthetase[J].Diabetes,2000,49:1 978-1 985.
[15]Gorovits N,Charron M J.What We Know about Facilitative Glucose Transporters[J].Biochemistry and Molecular Biology Education,2003,31(3):163-172.
Effect of Supp lying L-arginine on Skeletal M uscle G lycogen,AMPK Activity and Sarcolemm a GLUT4 Protein Contentsin Overtraining Rats
LIUWuyi,LU Aiyun
(School of Sport&Exercise Science,ShanghaiUniversity of Sport,Shanghai200438,China)
Objective:The purpose of the present study was to observe effect of supplying L-arginine on skeletalmuscle glycogen contents,AMP-activated protein kinase(AMPK)activity and sarcolemma Glucose transporter type 4(GLUT4)protein contents in overtraining rats.Methods:Forty SD ratswere randomly divided into group A(sedentary),group B(underwentendurance exercise 60minutes/day),group C(underwentendurance exercise 60minutes/day, supplying L-arginine)and group D(underwentendurance exercise 120minutes/day),group D subdivided group D1(without L-arginine)and group D2(with L-arginine).All exercise groups were trained 6 days/wk for 9 weeks.Muscle glycogen,sarcolemma GLUT4 contents and muscle AMPK activity were determined after the 9-week training.Results:Muscle glycogen contents in group B and group D1 exist a trend of increase compared with that in group A,but not significantly(P>0.05).Muscle glycogen contents in soleus showed a significant higher level in group C and group D2 compared with that in group A(P<0.01), and itshowed a trend of increase in group D2 compared with that in group D1,but not significantly(P>0.05).Muscle AMPK activity in group B,group C and group D2 increased significantly compared with that in group A,and it showed a significanthigher level in group D2 compared with that in group D1(P<0.01).Sarcolemma GLUT4 contents in group B,group C and group D2 increased about 100%compared with that in group A,but it only increased 11%in group D1.And that increased by 57%in group D2 as compared with that in group D1.Conclusion:Supplying with L-Arg could increase muscle glycogen cotents, muscle AMPK activity,and sarcolemma GLUT4 content in overtraining rats,whichmightbe helpful in staying or treating overtraining.
rat;overtraining;L-arginine;muscle glycogen;GLUT4;AMPK
G 804.7
A
1005-0000(2010)04-0340-04
2010-04-20;
2010-05-12;录用日期:2010-05-15
上海市教委课题(项目编号:06IZ004);上海市重点学科建设项目(项目编号:S30802)
刘无逸(1955-),男,浙江宁波人,上海体育学院副教授。
上海体育学院运动科学学院,上海200438。
从第7周开始,配制浓度为1%的L-精氨酸溶液供C组和D2组大鼠每晚饮用(溶液量略多于给药前3个晚上的最大饮水量),连续3周。
1.1.2 大鼠训练方案购入大鼠经一周适应后,参照Bedford等的大鼠运动负荷标准[3],采用BCPF-98型生物医学动物跑台(由杭州立泰科技有限公司提供)进行上坡跑训练。训练时间为9周,其中前4周为递增负荷,后5周维持大强度运动,每周训练6天。
大鼠过度训练模型根据叶剑飞等[4]采用的方法适当改进后进行,具体方案见表1。
表1 9周大鼠训练方案
Table 1 9-week train ing pro tocol for rats
训练周次/(m·min-1)坡度/%时间/(m·min-1)速度/(m·min-1)坡度/%时间/(m·min-1)1 15 0 30 15 0 30 2 20 5 45 20 5 60 3 25 10 45 25 10 90 4 30 15 45 30 15 90 5 30 15 60 30 15 120 6 31 15 60 31 15 120 7 32 15 60 32 15 120 8 33 15 60 33 15 120 9 35 15 60 35 15 120 B组和C组D组速度
1.1.3 大鼠处死和取材9周训练结束后36 h,各组大鼠于安静状态下断头处死,均取比目鱼肌和腓肠肌白肌部分,液氮速冻后置-78℃冰箱保存备用。
