从HEPC基因筛选预测HiHiLo训练对左心室结构与功能影响的分子标记
2010-01-04乌云格日勒胡扬衣龙彦聂晶王景玲吉洪书
乌云格日勒,胡扬,衣龙彦,聂晶,王景玲,吉洪书
●成果报告Original Articles
从HEPC基因筛选预测HiHiLo训练对左心室结构与功能影响的分子标记
乌云格日勒1,2,胡扬2,衣龙彦2,聂晶3,王景玲4,吉洪书5
通过对HEPC基因SNP/A2032G与HiHiLo训练后左心室结构与功能指标变化的关联分析,从HEPC基因中筛选预测HiHiLo训练效果的分子标记。方法:对66名平原地区居住的北方汉族男子进行为期30天的HiHiLo训练,测定其训练前后安静状态和递增负荷运动下的左心室结构与功能指标。应用PCR-RFLP技术解析受试者SNP/A2032G多态性,采用关联方法分析SNP/A2032G与训练前后左心室结构功能指标变化的关联性。结果:(1)HiHiLo训练后,受试者ESD、EDD、PWD、IVSD、LVM和LVMI等6项心室结构指标均增长;心室功能指标中HR、CO、COI下降,而SV、SVI和EF增长。(2)HiHiLo训练后,AA型PWD和IVSD的增加量显著高于AG型和GG型,AA型100W/HR的下降量显著高于GG型,AA型Re/SV和Re/SVI的增加量显著高于AG型和GG型。结论:HEPC基因SNP/A2032G的AA型可以作为预测HiHiLo训练后心室结构和功能指标训练效果的分子标记。
HEPC基因多态性;HiHiLo训练;左心室结构;左心室功能
HiHiLo作为一种有效的耐力训练方法,通过缺氧和运动两方面的刺激提高运动员的运动能力[1]。但是运动员在高原缺氧的适应能力上存在很大的个体差异,这种个体差异决定了高原训练效果的好坏[2]。同时,低氧训练效果的个体差异与基因多态性有关[3]。铁是人体适应耐力训练、提高运动能力的必要条件之一。长期的运动训练不仅增加机体铁的丢失量,同时也减少肠道对铁的吸收,使机体铁贮备下降[4],从而直接影响运动员Hb合成、氧的运输和储存能力及ATP合成。在机体铁代谢过程中,hepcidin是调节铁吸收和释放的中心调控因子[5]。它不仅在小肠和肝脏中表达,而且也在心肌细胞中表达[6],其作用通过调节心肌细胞的铁代谢进而影响人体运动能力。因此,可以推测HEPC是影响运动能力的重要候选基因,但有关HEPC基因多态性与运动能力关系的研究尚未见报道。本研究通过探讨中国北方汉族男性HEPC基因SNP/A2032G与30天HiHiLo训练后左心室结构与功能指标变化的关联性,为制定个体化HiHiLo训练方案提供分子标记。
1 研究对象与方法
1.1 研究对象
中国北方汉族平原地区健康男性在校大学生66人,试验前无低氧居住史,平均年龄(20.73±1.48)岁,身高(177.95±5.10)cm,体重(68.66±7.52)kg。受试者均知情同意。
1.2 试验方法
1.2.1 低氧训练方案高住:受试者每天在氧气浓度为14.8%~14.3%(模拟海拔高度约为2 800~3 000m)的低氧房中休息和睡眠10 h(晚21:00至次日晨7:00);高练:每周进行3次低氧训练,即在浓度为15.4%~14.8%(海拔约2 500 m~2 800 m)的常压低氧环境中,以个体75%VO2max强度蹬踏功率自行车(Monark818型功率自行车、瑞典),将受试者的SpO2维持在87%~93%,HiHiLo训练期限为30天。
1.2.2 基因多态性分析Hepcidin基因位于19q1311,全长约2.5 kb,SNP/A2032G多态是Hepcidin基因标签SNP位点,位于第1内含子,杂合度近40%。采用Promaga公司试剂盒提取全血DNA,primer premier5.0自行设计引物,上游引物为5'-GGCAACACAACCAGACCCCAC-3';下游引物为5'-GCCTCCTCCTCTTTCCACAGC-3'。
15μL反应体系:DNA模板(0.4μL),Taq酶(0.2μL,5U/μL),dNTP(0.4μL,10mM),Mg2+(1.2μL,25mM),上下游引物各2μL(0.05μg/μL),PCR buffer(2μL),其余7.2μL用灭菌双蒸水补齐。
PCR反应条件:95℃预变性10 m in;变性95℃30 s,退火62.5℃30 s,延伸72℃30 s,共30个循环;72℃延伸7min。PCR反应产物340 bp。限制性内切酶分析:内切酶MspI在37℃水浴3 h消化扩增产物,2%琼脂糖凝胶电泳,用DL2000DNA marker作为长度标记判断酶切后DNA片断的长度,并用凝胶成像系统紫外光成像分型。
1.2.3 左心室结构与功能指标的测定(1)测试方法:受试者静坐10min。测定安静时的左心室结构功能指标。准备活动:按60 r/min节律零负荷下踏车2m in以适应踏车节律。运动方式:卧式蹬车的极限下递增定量负荷运动。受试者以50W起始负荷、60 r/m in的频率蹬车,每3 min增加50W负荷,直至150W负荷蹬踏3 min后结束,总负荷时间9min。平卧恢复3 min。分别测定50W、100W、150 W负荷和恢复期的心室结构功能指标。在HiHiLo前后各测定1次。
(2)测试仪器:Doppler超声心动图仪(CarisPLUS-DU3,Eastoe,Italy),Polar表(POLARa3,Polar Electro OY,Finland),卧式功率自行车(Ergotest ER3/A,Erich Jaeger,Germany)。
(3)测试指标:心室结构指标为左室收缩末期内径(ESD)、左室舒张末期内径(EDD)、左室舒张末期后壁厚度(PWD)、舒张末期室间隔厚度(IVSD)、左室心肌质量(LVM)、左室心肌质量指数(LVMI)。心室功能指标为心率(HR)、每博输出量(SV)、每博输出量指数(SVI)、心输出量(CO)、心指数(COI)、射血分数(EF)。
1.3 数据处理
采用χ2检验确定受试者人群的基因型频率是否符合H-W遗传平衡定律。所有数据在K-S检验的基础上,计算出训练前和训练后变化量(△=训练后-训练前)。用变化量(△)表示训练敏感性,即训练效果。原始数据进行了正态检验,对不满足方差检验的数据,均转换成对数进行了检验,使总体服从正态分布。并采用Box's检验与Levene’s检验,验证了能否满足重复测量方差分析的前提条件。基因型组间和组内数据采用重复测量的方差分析和一元方差分析。数据处理采用SPSS13.0软件。差异检验显著水平为P<0.05。
2 结果
2.1 HEPC基因SNP/A2032G基因型及等位基因的分布特征
HEPC基因SNP/A2032G扩增片断长度为340 bp,PCR产物经MspI内切酶消化后,出现3种类型条带:有MspI酶切位点的纯合型为236 bp和57 bp两条带,没有MspI酶切位点的纯和型为293 bp一条带,杂和型为293 bp、236 bp和57 bp3条带(见图2)。受试者基因型分布频率为AA型7人(11%);AG型人19(29%);GG型40人(60%)。经卡方检验,其结果为:χ2(df=2)= 1.753,P=0.440,表明研究对象符合H-W平衡定律,具有群体代表性。

图1 Hepc基因SNP/A2032G多态PCR-RFLP电泳结果(1.2.3.5.6为GG型,4.7.8.9.11.12为AG型,10.13.14AA型,Marker为DL2000 DNA Marke r)Figure 1 Electrophoretic patterns ofHepcidin gene observed by PCR-REFP analysis(Lane1.2.3.5.6 are homozygous GG,Lane10. 13.14 is homozygous AA,Lane 4.7.8.9.11.12 are heterozygous AG. Marker is DL2000 DNA Ma rker)
2.2 HEPC基因SNP/A2032G与耐力训练敏感性的关联性
2.2.1 与心室结构指标的关联性不同基因型的心室结构各指标的初始值没有显著差异;经30天HiHiLo训练后,不同基因型的PWD和IVSD的变化量有显著差异,AA型PWD和IVSD的增加量显著高于AG型和GG型(P<0.05)(见表1)。

表1 SNP/A2032G多态性各基因型心室结构指标的变化Table 1 Change of the leftventricular structure for SNP/A2032G polymorphism
2.2.2 SNP/A2032G与心室功能指标的关联性(1)与心率的关联性。在安静状态下,不同基因型HR初始值有显著差异,GG型显著高于AA型(P<0.05);训练后AA型的100W/HR下降量显著高于GG型(P<0.05)(见表2)。

表2 SNP/A2032G多态性各基因型R的变化Table 2 change ofHR forgenotype o f SNP/A2032G polymorphism
(2)与每搏量的关联性。3种基因型的SV和SVI的初始值没有显著差异;训练后,不同基因型的Re/SV和Re/SVI的变化量有显著差异,AA型Re/SV和Re/SVI的增加量显著高于AG型和GG型(P<0.05)(见表3)。

表3 SNP/A2032G多态性各基因型每博量的变化Table 3 change o f SV and SVIfor geno type of SNP/A2032G polymo rphism
(3)与心输出量的关联性。不同基因型的CO和COI的初始值有显著差异,GG型的CO和COI的初始值显著高于AA型(P<0.05);但训练后的变化量没有差异(见表4)。
(4)与射血分数的关联性。不同基因型的EF的初始值之间有显著差异,AG和GG型EF初始值显著高于AA型(P<0.05);但训练后的变化量没有差异(见表5)。

表4 SNP/A2032G多态性各基因型的心输出量与心指数的变化Tab le 4 change o f CO and COIfor genotype of SNP/A2032G po lym orphism
3 讨论
经H-W平衡检验,三种基因型的分布频率符合H-W平衡定律。本研究受试者均来自北京体育大学运动系和体育系在校大学生,因其基因型分布频率符合H-W平衡定律,因此确定具有群体代表性。而且H-W平衡是根据2项分布原理检验的,当样本量足够大时趋于近似正态分布,可以满足方差检验的前提。尽管有两个组的样本量小于10,但由于通过了球型检验与列文检验,故能满足本文统计处理的前提要求。
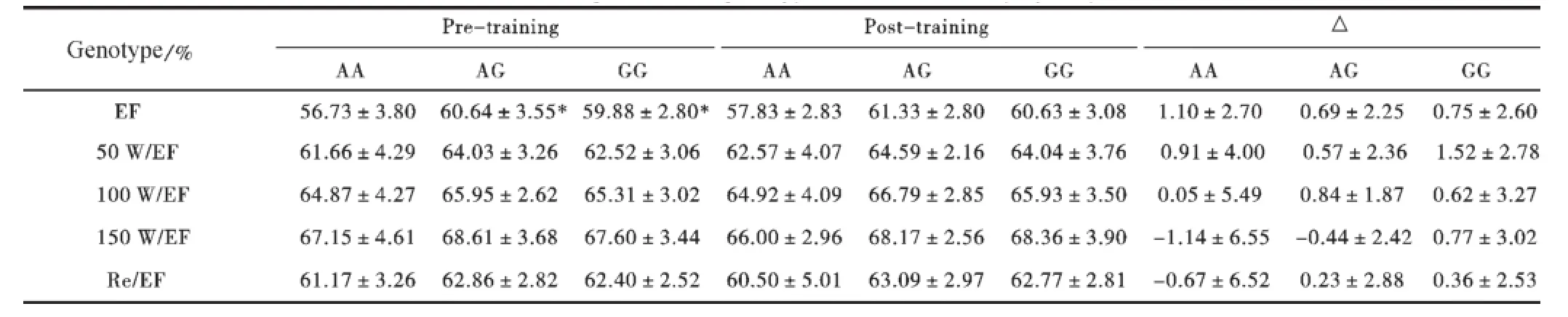
表5 SNP/A2032G多态性各基因型射血分数的变化Table 5 change of EF forgenotype o f SNP/A2032G polymorphism
3.1 HiHiLo训练后左心室结构与功能指标变化的分析
本研究结果发现,经过30天HiHiLo训练后,受试者的ESD、EDD、PWD、IVSD、LVM和LVMI等6项心室结构指标均有所增长,其平均增长率依次为0.95‰、0.36‰、2.44%、1.64%、3.73%和4.14%。其中,做为判断心脏肥大的重要指标PWD、IVSD、LVM和LVMI的增长率具有统计学意义。通常,训练引起的心脏肥大能够增加心肌的收缩力量,而ESD和EDD的增加可使心室容积扩大,有利于左心室泵血功能的改善。Svedenhag等[7]曾对优秀运动员进行30天高原训练后,发现运动员左室舒张末期内径、舒张末期室间隔厚度和左室舒张末期后壁厚度有所增加,而且,心肌质量也显著增加。该报道与本研究结果基本一致。
经过30天HiHiLo训练后,受试者安静时、递增负荷下(50 W/100W/150W)和恢复时期的SV/SVI显著增加,而HR和CO/COI显著下降;安静时的EF和50W/EF显著增加,虽然100 W/EF、150W/EF和Re/EF有所增加,但没有显著差异。HR的明显下降,表明左心舒张时间延长,心脏的储备能力增强;每搏量和射血分数的增加,表明心肌收缩能力增强,左室充盈量增加,心脏泵血功能提高。而CO/COI的下降,一方面是因为HR的下降,另一方面可能是由于低氧暴露后RBC和Hb含量的增加[8~9],提高了血液的氧气运输能力。
训练后不少指标变化量(△)的最小值为负值,如HR,敏感性高则下降值大,负值也大。计算标准差时由于负值平方变成正值,这样计算得到的标准差极易出现大于均值的现象。当然样本量小也是重要因素,所以有必要再加大样本量进一步验证。
3.2 HEPC基因多态性与左心室功能指标训练效果的关联分析
本研究结果表明,(1)rs7251432与PWD、IVSD的训练敏感性关联。经过30天的HiHiLo训练后,AA型PWD和IVSD的增加量显著高于AG型,反映AA型左心室壁增厚显著,心脏结构有所改善。(2)rs7251432与HR、CO、COI和EF的初始值和100W /HR、Re/SV和Re/SVI的训练敏感性关联。训练前安静时GG型的HR、CO、COI高于AA型,AG和GG型的EF显著高于AA型,在3种基因型中AA型的心功能初始水平最低。但是,经过HiHiLo训练后,不同基因型之间100W/HR、Re/SV和Re/SVI的变化量出现显著差异,AA型100W/HR的下降量显著高于GG型,而Re/SV和Re/SVI的增加量显著高于AG型和GG型。表明AA型SV增加HR下降,心脏的储备能力增强,在完成同等负荷的条件下心脏机能出现节省化,这种功能的变化与上述结构变化是一致的。
本研究分析了HEPC基因SNP/A2032G多态性与6项心室结构和功能指标的关联。HIF(HIF-1和HIF-2)是细胞适应低氧环境的关键调节因子[10],在维持机体铁平衡中发挥关键作用。hepcidin是机体铁代谢的中心调控因子[5],与HIF之间的联系已被研究证实[11]。低氧时Hif-1通过改变hepcidin、DMT1、DcytB的表达来缓解铁缺乏的状态。而且,HIF-1可诱导EPO基因的表达增加[12],而EPO抑制肝脏hepcidin mRNA的表达[13]。另外,HiHiLo训练可使运动员发生功能性铁缺乏[14],铁缺乏可以使hepcidin mRNA的表达量也减少[15],从而增加小肠的铁吸收量和巨噬细胞铁的释放量来满足低氧时的需铁量。Merle等人[16]通过大鼠在体实验证实了hepcidin mRNA和蛋白质在心脏的表达。同时发现低氧时,肝脏hepcidin表达减少,相反,心脏hepcidinmRNA的表达和蛋白水平却显著上调。另外,运动可使大鼠肝脏hepcidinmRNA的表达显著下降[6.17],有利于十二指肠铁吸收。Roetto等[18]和Porto等人发现[19],葡萄牙家庭两名成员HEPC基因位于基因5,非翻译区mRNA加帽位点单核苷酸变异,表现为心力衰竭,严重影响了心脏的正常功能。说明,低氧时可能通过Hif-1通路,影响hepcidin mRN A在心脏的表达,而HEPC基因变异与心脏结构功能密切相关,直接影响心脏的功能。本研究结果表明,HEPC基因SNP/ A2032G的AA型与HiHiLo训练后的心室结构和功能指标的变化关联。
4 小结
对66名健康男子30天的HiHiLo训练结果表明,Hepcidin基因SNP/A2032G多态性与HiHiLo训练效果明显关联。训练后,AA型PWD和IVSD的增加量显著高于AG型和GG型;AA型100W/HR的下降量显著高于GG型,AA型Re/SV和Re/SVI的增加量显著高于AG型和GG型,总趋势表现为AA>GG和AG。这一结果与AA型左心室结构和功能指标的变化相一致。本研究结果提示,HEPC基因SNP/A2032G的AA型可作为预测HiHiLo训练后心室功能指标训练效果的分子标记。
[1]胡扬.模拟高原训练的新发展—从HiLo到HiHiLo[J].中国运动医学杂志,2005,24(1):69-72.
[2]胡扬.关于高原训练中若干问题的思考[J].北京体育大学学报,2006,29(7):865-868.
[3]刘海平,胡扬.HIF-1α和eNOS基因多态性与个体低氧训练效果的关联性研究[J].中国应用生理学杂志,2006,22(4):434-438.
[4]曹建民,田野,赵杰修,等.运动与铁代谢[J].北京体育大学学报,2003,26(3):331-335.
[5]Kemna EH,Tjalsma H,WillemsH L,etal.Hepcidin:from discovery to differentialdiagnosis[J].Haematologica,2008,93:(1)90-97.
[6]刘玉倩,常彦忠,王海涛,等.不同强度运动对大鼠十二指肠DMT1、FP1蛋白和肝HepcidinmRNA表达的影响[J].体育科学,2006,26(9):68-71.
[7]Svedenhag J,Piehl-Aulin K,Skog C,et al.Increased left ventricular musclemass after long-term altitude training in athletes[J].Acta Physiol Scand,1997,161(1):63-70.
[8]Wehrlin J P,Marti B.Live high-train low associated with increased haemoglobin mass as preparation for the 2003World Championships in two native Europeanworld class runners[J].Br JSports Med,2006,40(2):e3.
[9]Wehrlin JP,Zuest P,Hallén J,et al.Live high-train low for 24 days increases hemoglobin mass and red cell volume in elite endurance athletes[J].JAppl Physiol,2006,100(6):1 938-1 945.
[10]Semenza G L.HIF-1:mediator of physiological and pathophysiological responses to hypoxia[J].J Appl Physiol JT-Journal of applied physiology,2000,88(4):1 474-1 480.
[11]Mastrogiannaki M,Matak P,Keith B,et al.HIF-2alpha,but not HIF-1alpha,promotesiron absorption inmice[J].JClin Invest,2009,119(5):1 159-1 166.
[12]Semenza G L,Wang G L.A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer ata site required for transcriptional activation[J].Mol Cell Biol JTMolecular and cellular biology,1992,12(12):5 447-5 454.
[13]孙雪峰,周道斌,赵永强.EPO对铁调节蛋白Hepcidin表达影响的研究[J].中国实验血液学杂志,2006,14(4):778-782.
[14]沈倬,刘媛媛,曾凡星,等.低氧训练中网织红细胞血红蛋白与低色素红细胞百分比的变化[J].中国运动医学杂志,2006,25(5):582-582.
[15]Weinstein DA,Roy CN,FlemingM D,etal.Inappropriate Expression ofHepcidin is Associated with Iron Refractory Anemia:Implications for the AnemiaofChronic Disease[J].Blood,2002,100(10):3776-3781.
[16]Merle U,Fein E,Gehrke S G,et al.The iron regulatory peptide hepcidin is expressed in the heart and regulated by hypoxia and inflammation[J].Endocrinology,2007,148:2 663-2 668.
[17]刘玉倩,常彦忠,王海涛,等.不同强度游泳运动对大鼠贮存铁及十二指肠铁吸收相关蛋白表达的影响[J].中国运动医学杂志,2006,25(4):411-415.
[18]Roetto A,Papanikolaou G,PolitouM,etal.Mutantantimicrobialpeptide hepcidin is associated with severe juvenile hemochromatosis[J].Nat Genet,2003,33:21-22.
[19]PortoG,Roetto A,Daraio F,etal.A Portuguese patienthomozygous for the-25G>A mutation of the HEPC promoter shows evidence of steady-state transcription but fails to up-regulate hepcidin levelsby iron [J].Blood,2005,106:2 922-2 923.
Genetic Marker for Predicting the Effectof HiHiLo Training on Left Ventricular Structure and Function from HEPCGeneSelection
WUYUN Gerile1.2,HU Yang2,YILongyan2,NIE Jing3,WANG Jingling4,JIHongshu5
(1.School of PE,Inner Mongolia Normal University,Hhhot 010022,China;2.Graduate Schools,Beijing Sports University,Beijing 100084, China;3.School of PE,Jiangxi Normal University,Nanchang 330027,China;4.Qingdao Sport Training Center,Qingdao 266023,China;5. Nanjing Institute of Physical Education,Nanjing 210014,China)
Objective:The association between SNP/A2032G in HEPC gene and the change of left ventricular structure and function after HiHiLowas analyzed and to provide as a genetic marker that can predict the efficiency of HiHiLo training.Methods:66male college-students from North of China were completed HiHiLo training for 30days and left ventricular structure/functional parameters in static and incremental exercise status for pre-post training was measured respectively.The SNPwas differentiated by PCR-RFLP,then association between the change of left ventricular structure/function parameters and SNP/A2032G was analyzed by association studies with training response phenotypes.Results:(1)The ESD,EDD,PWD,IVSD,LVM and LVMI of subject were increased,and HR,CO and COIwere decreased,but SV,SVIand EF were increased.(2)The increase of PWD and IVSD with AA were significantly higher than that AG and GG genotype,and an amountof decrease of 100W/HRwith AA genotypewas severity than GG genotype.Moreover,the increase of Re/SV and Re/SVIwith AA genotype was significantly higher than AG and GG genotype.Conclusion:AA genotype of SNP/A2032G wasmaybe used as a geneticmarker that can predict the efficiency with left ventricular structure/function after HiHiLo training.
HEPC gene polymorphism;HIHILo training;left ventricular structure;left ventricular function
G 804.7
A
1005-0000(2010)04-0282-05
2010-04-14;
2010-05-31;录用日期:2010-06-05
科技部奥运攻关项目(项目编号:2006BAK12B01)
乌云格日勒(1963-),女,内蒙古呼和浩特人,内蒙古师范大学副教授,北京体育大学博士研究生。
1.内蒙古师范大学体育学院,呼和浩特010022;2.北京体育大学科学研究中心,北京100084;3.江西师范大学,南昌330027;4.青岛体育训练基地,青岛266023;5.南京体育学院,南京210014。
