运动对RBP4诱导的胰岛素抵抗大鼠骨骼肌PI3-K表达的影响
2010-01-03张明军
张明军
●成果报告
运动对RBP4诱导的胰岛素抵抗大鼠骨骼肌PI3-K表达的影响
张明军
目的:研究运动对RBP4诱导的胰岛素抵抗大鼠骨骼肌PI3-K表达的影响。方法:8周龄雄性SD大鼠给予重组RBP43μgg-1体重腹腔注射,12小时注射一次,持续注射3周。设RBP4+运动组(RE)、RBP4安静组(RR)和正常安静对照组(C),RE组予3周无负重游泳训练,60 min/天. ELISA、液闪计、免疫组化和免疫印迹法分别检测血清RBP4,胰岛素抵抗指数HOMA-IR、葡萄糖摄取率和骨骼肌PI3-K表达。结果:RBP4注射组血清RBP4和HOMA-IR显著高于未注射RBP4的正常安静对照组,葡萄糖摄取率显著低于正常安静对照组;RE组血清RBP4和HOMA-IR显著低于RR组,葡萄糖摄取率显著高于RR组。RE组骨骼肌细胞PI3-K蛋白表达显著高于RR组。结论:游泳运动能够增加RBP4诱导的胰岛素抵抗大鼠骨骼肌PI3-K表达,促进葡萄糖摄取,改善胰岛素抵抗。
运动;视黄醇结合蛋白4;胰岛素抵抗;磷酸肌醇-3-激酶
视黄醇结合蛋白4(RBP4)是一类特异性结合视黄醇的蛋白质,主要由脂肪细胞分泌[1]。研究发现,RBP4是导致胰岛素抗性的脂肪因子,在胰岛素抗发展过程中起到一个关键作用,具有胰岛素抗性的小鼠和患有肥胖和2型糖尿病的病人体内,血清RBP4的水平是升高的[2]。升高的RBP4水平可以用于评价胰岛素抵抗程度,并与心血管危险因子的关系密切[3]。研究显示,运动训练能够降低不同年龄研究对象的RBP4水平[3-4],提示运动可以通过降低RBP4水平,提高胰岛素敏感性。
前期对运动改善RBP4诱导的胰岛素抵抗机制进行探索发现,RBP4抑制了胰岛素信号传导的关键蛋白胰岛素受体(IR)和胰岛素受体底物1(IRS-1)的蛋白表达和磷酸化,进行8周游泳运动后,IRS-1的磷酸化抑制被解除,葡萄糖摄取率提高[5]。在胰岛素信号转导通路中,具有酪氨酸激酶活性的跨膜受体胰岛素受体与胰岛素结合后,自身发生自磷酸化,使胰岛素受体底物的酪氨酸残基磷酸化,使酪氨酸激酶自身激活,活化的受体酪氨酸激酶残基为效应蛋白提供了附着点,募集众多重要的效应蛋白,将信号传递给细胞内不同的信号传递通路,其中包括磷酸肌醇-3-激酶(PI-3-kinase)通路,胰岛素介导的许多生物学效应是由该通路介导的。本文采用重组RBP4注射活体大鼠,获得高RBP4诱导的胰岛素抵抗大鼠模型,观察运动后胰岛素抵抗和骨骼肌细胞PI3-K的表达变化,进一步深入探讨运动影响RBP4诱导的胰岛素抵抗机制。
1 研究材料与方法
1.1 材 料
胰岛素(Sigma-Aldrich)、2-Deoxy-D-[I-3H]-glucose(Sigma-Aldrich)、抗PI3-K多克隆抗体(ProSpec)以及相应的第二抗体、RBP4ELISA试剂盒(Biosource)、胰岛素放射免疫试剂盒(Biogenesis)、重组RBP4(Alexis)均购自厦门慧嘉生物技术公司。
1.2 方 法
1.2.1 重组RBP4注射与运动方案 雄性SD大鼠18只,8周龄,体重180~210 g,随机分为RBP4+运动组(RE)12只、RBP4安静组(RR)6只,2组大鼠给予重组RBP4腹腔注射[2],3μg/g体重,12小时注射一次,持续注射3周。RE组大鼠同时进行游泳训练,按照Ploug方法[6]训练3周,RE组6只大鼠同时在直径47 cm内壁光滑的塑料桶内进行游泳训练,水深60 cm,水温保持在35℃,游泳训练时间为晚上19点;大鼠10 min/天适应性游泳训练2天,第3天后每天无负重持续游泳60 min,每周训练5天,周六、周日休息,持续3周。训练早期大鼠不适应,出现反复下沉和溺水倾向时,捞出休息,然后补足训练时间;出现大鼠抱团、漂浮现象时予以驱赶,使之处于持续运动状态,保证训练效果。安静对照组大鼠浸水后捞出。游泳结束后干毛巾擦拭,电吹风吹干。雄性SD大鼠6只为正常安静对照组(C)。
1.2.2 血清RBP4和胰岛素抵抗指数的检测 RBP4的测定采用双抗体夹心酶标免疫分析法。胰岛素测定采用放射免疫分析法。评价胰岛素敏感性的方法采用稳态模式评估法,该方法是假定肝脏和外周组织的胰岛素抵抗相等,按血葡萄糖和胰岛素在不同器官(包括胰腺、肝和周围组织)的相互影响而建立的数学模型。此模型的计算公式涉及空腹血糖和空腹胰岛素,即稳态模型的胰岛素抵抗指数(HOMA-IR)=空腹胰岛素(国际单位/ L)×以空腹葡萄糖(mmoL/L)/22.5。
1.2.3 骨骼肌细胞葡萄糖摄取率和PI-3K表达的检测 骨骼肌细胞葡萄糖摄取率检测。第3周运动后,6只免疫组化法检测PI3-K表达的大鼠10%水合氯醛腹腔注射麻醉,心脏取血,4%多聚甲醛灌注后取腓肠肌,进行24小时外固定。6只免疫印迹法检测PI3-K表达的大鼠10%水合氯醛腹腔注射麻醉,心脏取血,断头处死后分离腓肠肌细胞,25 mmol/L 2-Deoxy-D-[I-3H]-glucose分别孵育各组骨骼肌细胞,之后,细胞转入Kerbs-Ringers液,分别添加胰岛素(10U/L)或不予胰岛素孵育24 h,液闪计数仪测定骨骼肌细胞葡萄糖摄取率。各组内同比重复2次,实验共重复5次。
免疫组化法检测腓肠肌细胞PI-3K的表达。HE常规染色:制作4 μm的石蜡切片,脱蜡,Harris苏木素液染色,脱水、透明、中性树胶封片,显微镜下观察:细胞核呈蓝色胞浆呈红色。免疫组织化学染色:脱蜡,柠檬酸盐缓冲液(pH=6.0)高温高压热修复抗原,3%过氧化氢溶液浸泡10 min阻断内源性过氧化物酶,PBS振洗。l∶20正常二抗血清室温10 min封闭,甩去血清后加一抗(1∶200),置湿盒内37℃60 min,PBS清洗,擦片后加二抗(试剂盒配置),置湿盒内37℃孵育10 min,清洗,加入2滴DAB显微镜下观察,显色3~5 min,流水冲洗10~15 min终止显色。脱水、透明、固封。显微镜下观察:核紫蓝色,阳性呈棕黄色,胞浆或胞膜染色阳性,以低倍显微镜在每张切片上随即选取5个视野,数码成像系统摄片,IPP5.0(美国)专业图像分析系统分析染色阳性物质,测定累计光密度(intergrated optical density,IOD)。
免疫印迹法检测PI3-K的表达。DNP离心分离骨骼肌细胞,细胞分别经PBS洗2次,使用细胞溶解液消化1 h,离心15 min(4℃、12 000 g),采取上清液放入-80℃中保存备用。West bloting法测定PI-3K蛋白表达,100 μg细胞溶解物SDS-PAGE蛋白分离,然后转移至硝酸纤维素膜。在室温用5%低脂奶粉PBS液封膜3 h。加入抗PI3-K抗体(工作浓度1∶4 000)4℃孵育过夜,洗涤后加入相应辣根过氧化酶标记的Ⅱ抗(工作浓度1∶5 000)分别孵育1 h,洗膜方法同前。充分洗涤后与ECL(增强化学发光剂,英国Amersham)反应,即刻与KadakX-Omat底片曝光洗片后用LeicaQ550-IW图像分析仪(德国)进行扫描,测定光密度,进行定量分析。
1.3 统计学处理
所有数据以SPSS16.0进行统计,数据以均数±标准差(X± S)表示,Kolmogorov-Smirnov检验数据的正态分布,组间进行方差分析,采用LSD检验,P<0.05为差异具有统计学意义,P<0.01为差异具有显著统计学意义。
2结 果
2.1 血清RBP4和胰岛素抵抗指数变化
3周后,RE组和RR组大鼠血清RBP4水平显著高于C组(P<0.01);RE组大鼠血清RBP4水平显著低于RR组(P<0.01);RE组和RR组大鼠HOMA-IR显著高于C组(P<0.01);RE组大鼠HOMA-IR显著低于RR组(P<0.01)(见表1)。

表1 血清RBP4和胰岛素抵抗指数变化Tab 1 Changes in serum RBP4 and HOMA-IR of rats(n=6)
2.2 骨骼肌细胞葡萄糖摄取率变化
3周后,RE组和RR组大鼠骨骼肌基础状态下(未添加胰岛素)和胰岛素刺激状态下的葡萄糖摄取率均显著低于C组(P<0.01);与RR组相比,RE组骨骼肌基础状态下(未添加胰岛素)和胰岛素刺激状态下的葡萄糖摄取率显著增加(P<0.01)(见表2)。

表2大鼠骨骼肌葡萄糖摄取率变化Tab 2 Changes in glucose uptake rate of rats skeletal muscle(n=6)RBP4+运动组(RE)RBP4安静组(RR) 正常安静对照组(C)基础状态 3.3±0.2ab 1.7±0.3a 5.8±0.4胰岛素刺激状态 5.5±0.1ab 3.8±0.2a 8.1±0.4
2.3 骨骼肌细胞PI3-K的表达变化
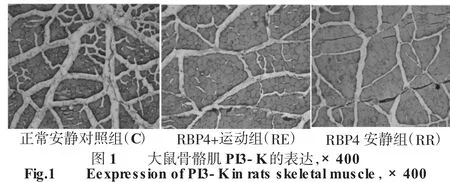
免疫组化染色结果显示PI3-K于骨骼肌细胞浆中表达,呈棕黄色阳性颗粒,C组骨骼肌细胞浆内见大量棕黄色阳性颗粒,RE组骨骼肌浆内见比较明显棕黄色阳性颗粒,RR照组仅见少量棕黄色阳性颗粒分布(见图1)。3周后,RE组和RR组大鼠骨骼肌PI3-K阳性染色累计光密度均值均显著低于C组(P<0.01);与RR组相比,RE组骨骼肌PI3-K阳性染色累计光密度均值显著增加(P<0.01)(见图2)。
免疫印记结果显示:3周后,RE组和RR组大鼠骨骼肌基础状态下(未添加胰岛素)和胰岛素刺激状态下PI3-K蛋白表达均显著低于C组(P<0.01);与RR组相比,RE组骨骼基础状态下(未添加胰岛素)和胰岛素刺激状态下PI3-K蛋白表达显著增加(P<0.01)(见图3)。

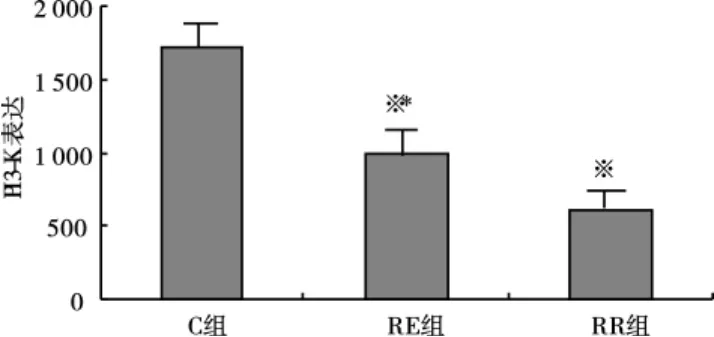
图2 大鼠骨骼肌PI3-K的表达变化Fig 2 Protein expression of PI3-Kin rats skeletal muscle
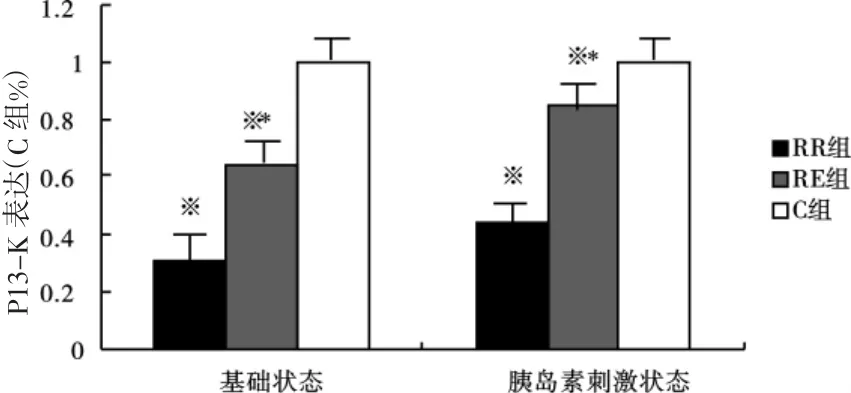
图3 大鼠骨骼肌基础和胰岛素刺激状态下PI3-K的表达变化Fig 3 Protein expression of PI3-Kin rats skeletal muscle after incubalation with orwithout insulin.
3 讨 论
本研究结果显示,大鼠经过RBP4注射3周后,RE组大鼠和RR组大鼠血清RBP4水平和HOMA-IR水平显著高于未注射RBP4的C组大鼠。对2组RBP4注射大鼠的进一步分析发现,RE组大鼠血清RBP4水平显著低于RR组,较RR组下降30%;RE组大鼠HOMA-IR也显著低于RR组,较RR组下降44%,结果与以往运动对RBP4影响的研究一致[3-4,7]。胰岛素抵抗不仅是2型糖尿病的发病基础,还是代谢综合征(糖尿病、肥胖、高血压病、动脉粥样硬化、脂肪肝等疾病)的共同的病理基础。目前的研究中常用的胰岛素抵抗的评价方法包括:葡萄糖耐量试验(OGTT)、HOMA-IR、胰岛素敏感性指数(ISI)和胰岛素释放试验(AIC)等,除了正常血糖高胰岛素钳夹试验这一“金标准”外,其它方法在评价胰岛素抵抗时各有不足之处。本研究采用HOMA-IR作为胰岛素抵抗的评价指标,其数学模型的理论依据是肝脏和胰岛β细胞在调节血糖和胰岛素浓度时存在一个负反馈环路。该方法与正常血糖高胰岛素钳夹试验比较,具有简单方便,易于操作的特点,自Matthews等首次将HOMA-IR运用于胰岛素抵抗的评价后便成为很多研究中最为常用的指标之一[8]。
胰岛素能够提高组织对葡萄糖的摄取率,机制是胰岛素与靶细胞的胰岛素信号蛋白相互作用,最终能够增加葡萄糖转运体从细胞内池向细胞膜的运动[9]。胰岛素在不同的组织、细胞中通过复杂的信号级联放大作用发挥不同的生理作用[10]。胰岛素与IR结合,激活IR的酪氨酸蛋白激酶的活性,导致IR、IRS1、IRS2、src同源性/胶原蛋白和pp60/IRS3的酪氨酸磷酸化[10],随后,酪氨酸磷酸化的底物借助SH2结构域募集磷脂酰肌醇-3激酶(PI3-K)的P85亚单位和生长因子受体结合蛋白(GRB),PI3-K酶的激活导致了包含葡萄糖转运体4(GLUT4)的囊泡的转位增加,从而增加骨骼肌和脂肪细胞的葡萄糖摄取[11]。本研究中大鼠经过RBP4注射3周后,与C组相比,RE组和RR组大鼠均出现胰岛素抵抗,葡萄糖摄取率均比安静正常大鼠显著下降;对RBP4注射后的大鼠进行运动干预后发现,RE组大鼠骨骼肌基础和胰岛素刺激状态下的葡萄糖摄取率显著高于RR组,基础和胰岛素刺激状态下的葡萄糖摄取率较RR组分别增加94%和45%。综合上述研究结果可以判定:3周游泳运动能够缓解RBP4诱导的胰岛素抵抗,增加骨骼肌的葡萄糖摄取,但是具体机制尚不明确。
PI3-K是由调节亚基和催化亚基组成的异源二聚体,P85调节亚基是多种细胞内激酶和受体酪氨酸激酶的磷酸化底物,能够通过本身SH2结构域与许多酪氨酸激酶种磷酸化的酪氨酸残基结合,P85-酪氨酸蛋白激酶之间可以通过包括IRS-1在内的适配蛋白发挥作用。在组成PI3-K家族的成员中,ClassIPI3-Ks是由两个亚类IA和IB组成,分别传导来自酪氨酸激酶和G蛋白耦联受体的信号。PI3-K催化磷脂酰肌醇在D3位的磷酸化,使底物PIP2转化为PIP3。P85α、β、γ 3种不同基因编码中P85α可能对P110亚基活性有负性调节作用,该调节功能的发挥与P85的两个SH2结构域、一个位于蛋白内部与P110结合的结构域、一个位于氨基酸末端的SH3结构域和BCR同源结构域有关,PI3-K的另外两个剪切异构体P55α和P50α由于缺失SH3结构域和BCR同源结构域,催化活性超过P85α。P110亚基也由3种基因编码(α、β、γ),还有相同结构域,PI3-K家族的成员中ClassII和ClassIII可能与抗原递呈和细胞毒作用有关。P13-K可被生长因子、细胞因子和胰岛素等细胞外信号刺激激活。P13-K的靶蛋白是蛋白激酶B(PKB)/Akt,在磷脂酰肌醇依赖的蛋白激酶(PDK)的协同作用下,P13-K激活产物导致Akt从胞浆转位到质膜,并促进Akt的Ser473和Thy308位点磷酸化,激活的Akt主要通过哺乳动物雷帕霉素靶蛋白(mTOR)、糖原合成酶激酶-3(GSK-3)等下游底物磷酸化而发挥广泛的生物学效应[12-13]。为了进一步探索运动改善RBP4诱导的胰岛素抵抗机制,我们挑选胰岛素信号传导通路中的关键酶PI3-K为观察指标,分别采用免疫组化和免疫印迹的方法对骨骼肌细胞内PI3-K的表达进行检测,结果发现:RBP4注射3周后,RE组和RR组大鼠的PI3-K表达均比C组显著下降;运动干预后,RE组大鼠骨骼肌内PI3-K的表达量则较RR组显著增加,随后的免疫印迹结果也与免疫组化一致。
胰岛素是重要的P13-K/AKt/mTOR信号通路的细胞外信号刺激激素,而运动可以增加骨骼肌细胞对胰岛素的敏感性,通过激活P13-K/AKt/mTOR信号转导途径增加葡萄糖的吸收和利用,调节血糖平衡。RBP4是一种脂肪因子,作用广泛,对于鼠骨骼肌细胞的胰岛素信号传导也会产生影响,研究显示,RBP4通过影响鼠骨骼肌细胞IRS1和PI3-K酶抑制胰岛素信号的传导,RBP4注射21天后,小鼠骨骼肌胰岛素刺激状态下的PI3-K的活性下降了34%[2]。结合本研究结果可以推断:PI3-K可能是胰岛素信号传导过程中受到RBP4影响的信号蛋白之一,其蛋白表达量的改变可能使下游蛋白的表达以及磷酸化发生变化,最终导致骨骼肌细胞生物学效应发生变化,葡萄糖摄取率的降低就是这些变化中的一种,或许可以作为解释RBP4诱导骨骼肌细胞产生胰岛素抵抗的机制之一。
经过3周游泳运动干预后,RE组大鼠PI3-K蛋白表达显著高于RR组,增加幅度达到74%,说明运动部分增加了被RBP4抑制的PI3-K蛋白表达,通过影响P13-K/AKt/mTOR信号通路,骨骼肌的葡萄糖摄取功能也得以改善,胰岛素抵抗程度也相应减轻。由于胰岛素信号传导的途径比较复杂,涉及数量和种类繁杂的信号蛋白,本研究仅仅以P13-K/AKt/mTOR信号通路中的PI3-K为观察指标,试图探索运动影响RBP4诱导的胰岛素抵抗机制,即使发现了运动与RBP4诱导的胰岛素抵抗骨骼肌细胞PI3-K之间的联系,也只能作为一种可能的解释,仍然需要对其它蛋白和信号通路做深入研究,才有可能全面揭示运动改善胰岛素抵抗的机制。
[1]Quadro L,Blaner W S,Salchow D J,et al.Impaired retinal function and vitamin A availability in mice lacking retinol[J].J EMBO,1999,17(18):4 633-4 644.
[2]Yang Q,GrahamTE,Mody N.Serumretinol binding protein 4 contributes to insulin resistance in obesity and type 2 diabetes.Nature, 2005,436(21):356-362.
[3]Graham T E,Yang Q,Bluher M.Retinol-Binding Protein 4 and Insulin Resistance in Lean,Obese,and Diabetic Subjects[J].NEJM,2006,354:2 552-2 563.
[4]LimS,Choi S H,Jeong I K,et al.Insulin-sensitizing effects of exercise on adiponectin and retinol-binding protein-4 concentrations in young and middle-aged women[J].J Clin Endocrinol Metab,2008,93(6):2 263-2 268.
[5]张明军.RBP4对游泳训练大鼠脂肪细胞IR和IRS-1蛋白表达和磷酸化的影响[J].天津体育学院学报,2010,25(1):38-40.
[6]Ploug T,Stallknecht B M,Pedersen O.Effect of endurance training on glucose transport capacity and glucose transporter expression in rat skeletal muscle.AmJPhysiol,1990,259E:778-784.
[7]ReinehrT,Stoffel-WagnerB,RothCL.Retinol-bindingprotein 4 and its relation to insulin resistance in obese children before and after weight loss[J].J Clin Endocrinol Metab,2008,93(6):2 287-93.
[8]Matthews D R,Hosker J P,Rudenski A S,et al.Homeostasis model assessment insulin resistance and β-cellfunction from fasting plasma glucose andinsulin concentrations in man[J].Diabetes,1985,25:1 154-1 161.
[9]Kwiecinski A,Nowak P.Effect of prenatal manganese intoxication on glucose uptake in the brain of ratslesioned asneonateswith 6-hydroxydopamine[J].Pharmacol Rep,2009,61(3):558-563.
[10]Cheatham B,Kahn CR.Insulin Action and the Insulin Signaling Network[J].Endoc Rev,1995,16(2):117-142.
[11]Lee J,Pilch P F.The insulin receptor:structure,function,and signaling[J].AmJ Physiol,1994,266:c319-c334.
[12]Cantley LC.The Phosphoinositide 3-Kinase Pathway[J].Science,2002,296:1 655-1 657.
[13]Vanhaesebroeck B,Waterfield M D.Signaling by distinct classes of phosphoinositide 3-kinases[J].Expl Cell Res,1999,253:239-254.
Effects of Exercise on PI3-K Expression of Skeletal Muscle in RBP4-induced Insulin Resistance Rats
ZHANG Mingjun
(School of PE and Sports Science,Fujian Normal University,Fuzhou 350007,China)
Objective:To study the effects of exercise on PI3-K expression of skeletal muscle cells in RBP4-induced insulin resistance rats.Methods:8-week-old SD male rats model established by intraperitoneal injection with Recombination RBP4 3μgg-1body weight,2 times per day for 3 weeks.Model rats were divided into RBP4+swimming group(RE),RBP4+rest group(RE),and normal control group(C).RE group rata swam three weeks without load,60 min per day.ELISA,fluid flash counter,IHC and western blotting were used to detect serum RBP4,HOMA-IR,glucose uptake rate and PI3-K expression,respectively.Results:Serum RBP4 and HOMA-IR increased more in RBP4 intraperitoneal injection exercise groups than normal control group,respectively.Non insulin-stimulated and insulin-stimulated glucose uptake rat decreased more in RBP4 intraperitoneal injection exercise groups than normal control group,respectively.Serum RBP4 and HOMA-IR decreased more in RE group than RR group,respectively.Non insulin-stimulated and insulin-stimulated glucose uptake rat increased more in RE group than RR group,respectively.PI3-K expression increased more in RE group than RR group.Conclusion:Exercise could increase PI3-K expression of skeletal muscle cells in RBP4-induced Insulin Resistance Rats,promote glucose uptake rat and improve insulin resistance.
exercise;retinal-binding protein-4;insulin resistance;PI3-K
G 804.7
A
1005-0000(2010)06-0482-04
2010-09-15;
2010-11-09;录用日期:2010-11-15
福建省教育科学“十一五”规划课题(项目编号:FJI10-050);福建省教育厅科技课题(项目编号:JA10229);莆田学院教育教学改革课题(项目编号:JG201019)
张明军(1968-),男,安徽滁州人,讲师,在读博士研究生,研究方向为运动人体科学。
福建师范大学体育科学学院,福建福州350007。
