有氧间歇训练对心梗大鼠心肌线粒体呼吸功能的影响
2010-01-03马晓宁
马晓宁
●研究报道
有氧间歇训练对心梗大鼠心肌线粒体呼吸功能的影响
马晓宁
目的:观察心梗大鼠8周有氧间歇训练后,心肌线粒体呼吸功能及电子传递链复合物酶活性变化,探讨间歇训练对心肌能量代谢及线粒体呼吸功能影响。方法:成年雄性SD大鼠(6周龄)40只,造模后随机分3组:假心梗组,心梗组,间歇训练组,10只/组。观察心梗面积、血流动力学,线粒体呼吸率、ROS、P/O及线粒体呼吸链复合物酶活性。结果:训练后,心梗面积减少12%;体重、心重及血压与安静组相比无显著性变化;血流动力学虽较安静组有负性变化,与心梗组相比则有明显改善;心肌线粒体RCR维持在较高水平;ROS显著性低于心梗组;复合物Ⅰ与心梗组相比有极显著性升高,复合物Ⅲ活性则有显著性升高,复合物Ⅱ和Ⅳ活性无显著性变化。结论:间歇训练有效维持线粒体膜结构;复合物酶活性改变可能与ROS降低相关。
心梗;间歇训练;呼吸功能;活性氧;复合物酶活
缺血性心脏病(ischemic heart diseases,IHD)因其高发病率、高死亡率,已经成为危害人类健康的主要疾病之一。而急性心梗是直接导致缺血性心脏病发生重要原因。其直接导致局部血供不足,引起组织能量供给匮乏,造成细胞凋亡加速,最终引起组织坏死。所以,如何尽快恢复缺血心肌组织血液灌注、恢复能量供应、遏制组织坏死是心肌缺血后治疗首要任务。
然而,无论是直接恢复缺血区域血液再灌注,还是作为补救措施的冠脉侧枝循环形成,其结果都会造成缺血再灌注(ischemia-reperfusion I/R)损伤。在缺血/再灌注过程中,线粒体作为能量合成的主要细胞器,则成为再灌注损伤的主要靶点。钙超载是I/R损伤形成的主要原因之一。钙超载(calcium overload)是指各种原因引起的细胞内钙浓度明显增多并导致细胞结构损伤和功能代谢障碍的现象。该损伤主要过程是:缺血使细胞内ATP含量减少,钠泵活性降低造成细胞浆内钠含量增高;再灌注时缺血的细胞重新获得氧及营养物质供应,细胞内高Na+除激活钠钾泵外,还迅速激活Na+/Ca2+交换蛋白,以加速Na+向细胞外转运,同时将大量Ca2+转入细胞内,造成细胞内钙超载。细胞内钙增多使肌浆网及线粒体消耗大量ATP;同时,线粒体内的Ca2+离子与含磷酸根的化合物反应形成磷酸钙,干扰线粒体氧化磷酸化,使能量代谢障碍,ATP生成减少,进一步加重线粒体损伤。
对于I/R损伤的治疗,目前研究主要集中在缺血预适应和后适应两方面。而运动作为治疗I/R损伤,主要运用在预适应领域,称之为“运动预适应”;在缺血后领域,则尚未提出“运动后适应”这一概念。近年来,随着康复疗法方式的不断更新,出现了新的康复方法,有氧间歇训练(aerobic interval training,AIT)就是其中之一。其源于间歇训练法,其主要是对多次练习的间歇时间做出严格规定,使机体处于不完全恢复状态下,反复进行练习的训练方法。
近年来众多研究表明,有氧间歇训练在治疗众多疾病,如二型糖尿病[1]、堵塞性肺病[2]、冠脉疾病[3]、心衰[4,5]等效果均优于单一中等强度有氧训练,故本实验从有氧间歇训练在改善和提高急性心肌缺血心肌线粒体呼吸功能,改善心肌能量恢复角度对其保护作用做探讨分析。
1 研究材料和方法
1.1 研究对象和动物造模
6周龄雄性SD大鼠40只(购自第四军医大学动物中心)。体重160~180 g,分笼饲养,每笼10只,自由饮食,室温23℃~25℃,湿度40%~60%,自然光照,自由饮食。
饲养1周,建立心梗模型,其中假心梗(开胸穿线而不结扎)10只,其余均为心梗模型(开胸结扎)。
1.2 运动方案
建模后,自主恢复1周。剔除死亡个体,随机分成3组,每组10只:假心梗组(CON);心梗组(MI);心梗有氧间歇组(MI+ IT)。假心梗组和心梗安静组不运动,间歇训练组训练方案为:适应性训练(15 m/min,30 min/天,5天/周)1周后,以最大吸氧量的40%~50%热身10 min,之后进行间歇性大强度有氧运动(75%~85%VO2max),速度为22 m/min,运动4 min;3 min 65%~75% VO2max,速度18~19 m/min,之后依次交替进行,最后冷却1 min结束训练。实验过程共进行8周。
1.3 实验方法
1.3.1 心功能测定 按1 mL/200 g体重剂量腹腔注射20%乌拉坦溶液麻醉大鼠,行右颈动脉插管,多功能电生理记录仪(Powerlab/4 SP,AD Instruments,Australia)记录主动脉、左心室压力曲线,测量左室舒张末压(LVEDP)及±dp/dtmax。
1.3.2 线粒体制备及蛋白定量 利用差速离心法[6]提取心肌细胞线粒体。心功能指标检测完毕,迅速摘取心脏,取下心室肌组织,剪碎,置于0.3 mmol/L蔗糖、10 mmol/L咪唑(pH 7.4,4℃)溶液中,使用电动玻璃匀浆器进行研磨,组织匀浆液在4℃条件下使用低温超速离心机800 g,离心10 min,弃沉淀,取上清液再次离心,4℃,10 000 g,离心20 min,沉淀物即为心肌线粒体。BCA试剂盒(碧云天)测定线粒体蛋白浓度。
1.3.3 线粒体呼吸功能测定 依据文献方法[6-7]:氧电极(Hansatech,UK)法测定线粒体耗氧。反应室温度保持37℃,孵育线粒体取1 mg置反应室中,加入37℃预热测定介质至反应体2 mL。分别以琥珀酸(终浓度5 mmol/L)、苹果酸和谷氨酸(终浓度均为2.5 mmol/L)为底物,测定无ADP耗氧速度(state4 respiration)及ADP(终浓度0.25 mmol/L)加入后的耗氧速度(state3 respiration)。计算:①Ⅲ态呼吸(加ADP后耗氧速率)及Ⅳ态呼吸(ADP耗尽后耗氧速率),即单位时间内,每毫克线粒体蛋白所消耗掉的摩尔原子氧(nmol/min·mg-1蛋白);②呼吸控制率(RCR):ADP供给充分时,线粒体氧耗速率乏ADP耗尽时氧耗速率之比,RCR=Ⅲ/Ⅳ态呼吸;③磷氧比值:为反应体系中加入ADP摩尔数与因此而消耗氧量摩尔原子数之比,磷氧比值=ADP/耗氧量。
1.3.4 线粒体呼吸链酶复合物 complex I、Ⅱ、Ⅲ、Ⅳ活性测定Complex I测定依据Trounce等的方法[8],测定混合液(10×buffer:0.5 mol/L Tris-HC1,1%BSA,10 μmol/L抗霉素A,3 mmol/KCN,0.5 mmol/L辅酶Q),线粒体终浓度20 μg/ml,DCPIP浓度2~100 μmol/L(DCPIP吸光系数为ε=21 mmol-1·cm-1·L),200 μmol/L NADH启动反应,37℃600 nm扫描2 min,另以上述体系加入3 μmol/L鱼藤酮作为测定空白。complexⅡ、Ⅲ、Ⅳ测定依据文献[6]。
1.3.5 活性氧(ROS)测定 采用H2DCF-DA法[9],用荧光测定荧光光谱仪检测设定为488 nm(激发光)和525 nm(发射光)。
1.4 统计学处理
2 实验结果
2.1 心肌梗死面积统计
结果显示,训练后,心梗大鼠心肌梗死面积显著性减小(见表1)。

注:与心梗组相比:*P<0.01表示有极显著性差异。
2.2 间歇训练对心梗后大鼠心脏功能指标改变
由表2可知,心梗可以造成大鼠体重减轻,心脏代偿性肥厚(心脏重量增加),降低血压(收缩压和舒张压),减小左心室收缩末压,增大舒张末压,±dp/dtmax显著性降低;间歇训练可以维持大鼠体重正常,保持血压在正常水平,有效地维持左室收缩末压,维持左室舒张末压,对±dp/dtmax也有同样效用,且均有显著性差异P<0.05。而对于心脏重量则无明显影响。

注:用Bonferroni's post hoc检验,进行单因素方差分析各组之间差异的显著性.*P<0.05和**P<0.01与安静对照(CON)组;#P<0.05和 ##P<0.01与心梗(MI)组。
2.3 线粒体呼吸功能改变
图1表明,心梗组与安静组相比,3态呼吸水平极显著性降低,而间歇训练组3态呼吸与安静组虽有显著性降低,但与心梗组相比却有极显著性升高。4态呼吸变化和3态相反。但心梗组RCR降低,而有氧间歇训练训练组则显著性升高,提示其能有效地遏制线粒体呼吸功能降低作用。心梗间歇组RCR则有显著性升高。P/O比值心梗组略有降低,但各组之间均无显著性变化。
2.5 有氧间歇训练对线粒体呼吸链复合物的影响
图2显示,与安静组相比,心梗组大鼠线粒体电子传递链复合物Ⅰ、Ⅲ酶活性有极显著性降低(P<0.01),复合物Ⅱ无显著性变化(P>0.05),复合物Ⅳ则有显著性降低(P<0.05);间歇训练可极显著性抑制复合物Ⅰ活性降低,显著性升高由于心梗造成的复合物Ⅲ活性,但对于复合物Ⅱ、Ⅳ活性无显著性影响(P>0.05)。
2.6 有氧间歇训练对线粒体呼吸ROS水平影响
图3显示,心梗后心肌线粒体ROS水平极显著性升高(P<0.01);AIT可以有效遏制这种升高趋势(P<0.05),但与对照组相比,其水平仍然处于一个较高水平(P<0.05)。
3 讨 论
本实验主要研究发现,(1)AIT可以有效对抗由于急性心肌缺血引起的心肌收缩功能下降;(2)首次研究证明AIT有效保护心肌组织,维持线粒体正常呼吸功能。(3)AIT抑制心肌缺血造成的ROS水平过度升高,减少ROS对由线粒体自身编码的电子传递链复合物Ⅰ、Ⅲ、Ⅳ酶活性的降低,对于维持电子传递活动具有重要意义。因此,将从AIT对大鼠心脏线粒体功能保
护以及其内在可能机制进行讨论。
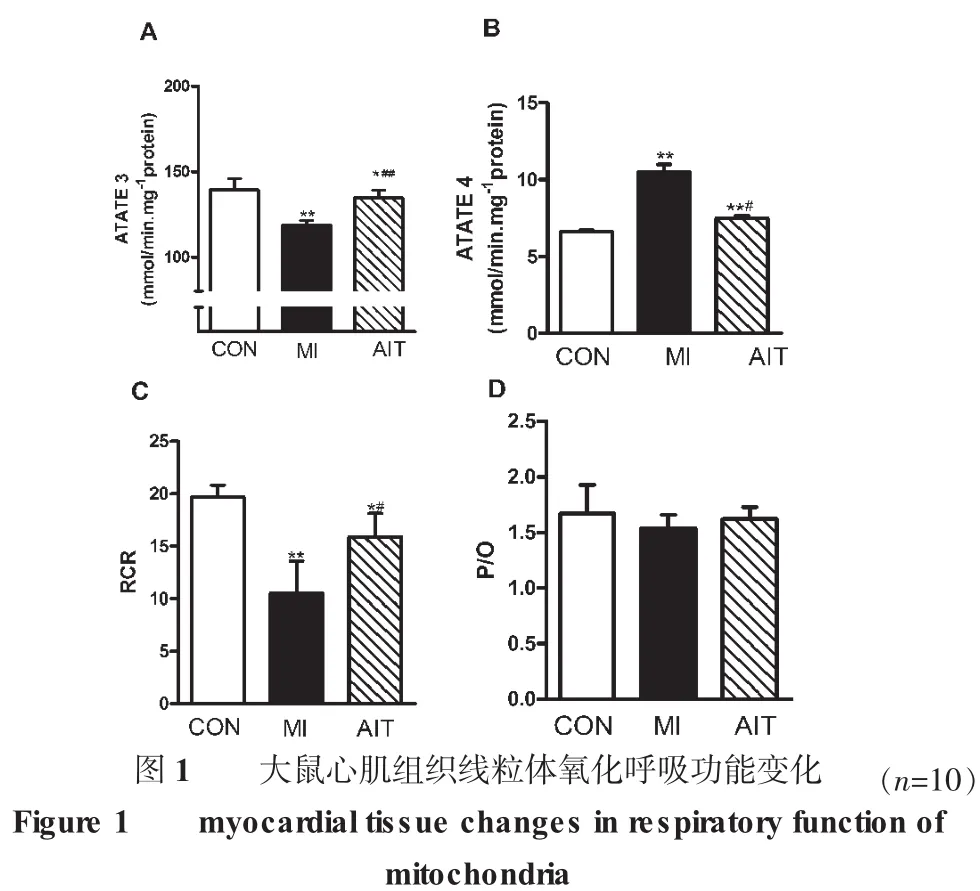
注:CON为安静对照组;MI为心梗组;AIT代表有氧间歇训练组。图A:STATE 3表示线粒体三态呼吸;图B:STATE 4表示线粒体四态呼吸;图C:RCR表示三态/四态;图D:P/O磷氧比值表示生成ATP与因此而消耗的氧原子比值。用Bonferroni's post hoc检验进行单因素方差分析各组之间差异的显著性.*P<0.05和 **P<0.01与安静对照(CON)组;#P<0.05和 ##P<0.01与 心梗(MI)组。
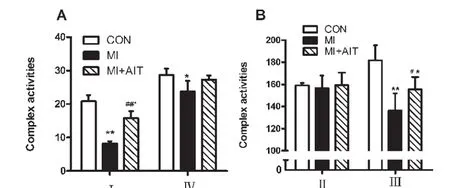
图2 8周AIT跑台训练对线粒体呼吸链复合物的影响Figure 2 8 weeks of AIT treadmill training on enzymes of mitochondrial respiratory chain complex

图3 8周AIT跑台训练后各组大鼠心肌线粒体活性氧(ROS)水平Figure 3 8 weeks of AIT treadmill training on ROS of heart mitochondria
3.1 间歇训练对大鼠心脏功能影响
实验结果表明,左前降支结扎后,造成心肌大面积缺血,梗死面积高达38%,间歇训练组心肌梗死面积则显著性降低,达到26%,有效地逆转了心肌缺血造成的组织坏死。
同时,由心功能指标来看,间歇训练可以有效抑制心梗造成的大鼠体重减轻;较好的维持血压(无论是收缩压还是舒张压),保持左心室收缩压和舒张压,可以纠正心肌缺血造成的±dp/dtmax病理状态;心脏重量在心梗组和间歇训练组都有所增加,但无显著性差异,但对血压、左心室收缩压均等心脏功能指标却存在显著性差异,其形成原因可能是[10],心梗安静组大鼠心肌代偿性肥厚,形成病理性心肌重构,虽然重量增加但功能却下降;间歇训练有效遏制病理性的心肌重塑的形成,抑制病理性心肌肥厚产生;同时,心肌纤维增粗,形成类似于所谓的“运动心脏[11,12]”,提高心功能。
3.2 间歇训练对大鼠心肌细胞线粒体呼吸功能影响
线粒体膜结构主要是磷脂,磷脂结构及组成正常与否,直接影响线粒体结构和功能。在存在自由基或缺血缺氧损伤时,磷脂极易降解,使膜脂质组分发生改变,导致膜脂质流动性发生变化,最终影响到与膜结合的膜蛋白或膜酶活性,导致其生物膜功能障碍,造成氧化磷酸化过程解耦联。
相关研究发现,心梗后,大鼠心室重构早期心肌线粒体4态呼吸升高,3态呼吸、RCR、磷氧比值均显著下降,其呼吸功能和氧化磷酸化能力明显受损,这可能是急性心肌梗死后形成慢性心力衰竭的重要原因[13]。
实验结果显示,心梗8周后,心梗组大鼠3态呼吸显著性降低,提示线粒体膜结构有不同程度的损伤或溶解。4态呼吸处于较高水平,提示其耗氧功能降低,进一步反映其膜结构损伤,使氧化呼吸功能受阻,导致呼吸功能降低。间歇训练提高线粒体呼吸率,改善心功能,其可能机理为:心肌缺血后,间歇训练在大强度训练时加剧心肌缺血,而强度较小时,又使缺血心肌得到血液灌注,如此反复缺血-再灌注,其作用效果类似缺血后适应[13],激活体内相关生存通路或相关活性物质,增强心肌对缺血环境耐受性,改善心功能。相关研究表明后适应改善不仅改善心功能,同时提高线粒体呼吸率[13]。
3.3 有氧间歇训练对线粒体呼吸链复合物酶活性和活性氧(ROS)影响
线粒体呼吸链(电子传递链)是位于线粒体内膜上酶系,主要由4个酶复合体(complexⅠ,Ⅱ,Ⅲ,IV),细胞色素C,泛醌(辅酶Q,COQ)库以及复合物V(H+-ATP酶)等组成。
线粒体呼吸链其基本功能是转换底物氧化还原势能为质子电化学势能,后者再转化为ATP合成的高能磷酸键能。当电子对连续地通过复合体Ⅰ,Ⅲ,Ⅳ时,在这三个阶段,其标准还原势变化都能释放出足够自由能来形成ATP。复合体Ⅱ催化的氧化-还原反应中,所释放自由能不足以形成ATP,其作用是将FADH2的电子脱下并转运到电子传递链。由此可见,Co I,Ⅱ,Ⅲ,Ⅳ在能量代谢中起不同作用,其活性改变势必影响能量代谢,而且功能变化都可以直接或间接反映线粒体呼吸功能变化。在正常生理状态下,绝大部分的氧在线粒体内被电子传递链传递来的电子还原为水,极小部分(3%~4%)氧被电子在传递过程中“漏出”的电子单价还原,从而形成超氧阴离子,成为细胞内活性氧(reactive oxygen species,ROS)主要来源,ROS主要以超氧阴离子()、过氧化氢(H:O:)、羟自由基(OH·)等形式存在。生理条件下线粒体内存在有效的抗氧化机制,自由基可被抗氧化酶(如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等)和抗氧化物(如维生素C、维生素E等)清除[14,15]。但在某些病理状态下,该系统平衡被打破,如心梗导致的缺血、缺氧等。
心梗导致心肌局部血液供应不足,引起组织缺血缺氧,线粒体自身抗氧化系统不足以清除过多自由基。由于mtDNA缺乏组蛋白保护(游离,无内含子),与氧化磷酸化场所(线粒体内膜)相距甚近,复制快速且无校读(proofreading)功能以及缺乏有效的DNA修复机制,所以mtDNA较易受自由基攻击,氧化损伤而引起突变,其突变率是核DNA的10倍。
线粒体能量转导系统的功能性装配依赖于核DNA(nDNA)和mtDNA的共同表达,尽管mtDNA只合成约10%的线粒体蛋白质,但线粒体蛋白质合成体系的产物均为呼吸链正常功能所必需。mtDNA包含有22个t RNA基因,2个rRNA基因,13个有关氧化磷酸化多肽编码的基因,即复合物Ⅰ(NADH-CoQ还原酶)的ND1、ND2、ND3、ND4、ND4L、ND5和ND6,复合物Ⅲ(CoQ-细胞色素c还原酶)的细胞色素b,复合物Ⅳ(细胞色素c氧化酶)的CoⅠ、CoⅡ、CoⅢ,以及复合物Ⅴ(ATPase)的亚单位6和8(AbL)。所有这些亚单位都是呼吸链的组成成分,因而直接参与氧化磷酸化。mtDNA的rRNA和tRNA基因为线粒体蛋白合成提供结构RNA,同时也是13种多肽表达所必需。急剧增多的氧自由基就能通过Fenton反应导致电子传递链酶复合体内的Fe-S中心失活,从而使线粒体能量合成出现障碍,呼吸链损伤可引起线粒体合成ATP功能发生障碍,造成线粒体及细胞内蛋白质、脂类及核酸的氧化,最终导致线粒体功能下降;同时,线粒体的功能障碍又可导致自由基产生增多,过多的氧自由基不能被及时清除,又可引起生物膜结构蛋白质和脂质过氧化,损害线粒体膜的通透性,引起电子传递链活性的进一步下降,进而形成恶性循环,使氧自由基生成进一步增加J[16]。
实验结果显示,心梗后,大鼠体内ROS水平极显著性上升(P<0.01),这与相对应的电子传递链复合物酶活的变化之间具有内在一致性。复合物Ⅰ、Ⅲ活性极显著性降低(P<0.01),复合物Ⅳ活性显著性降低(P<0.05),造成该现象的原因可能是:由于复合物Ⅰ、Ⅲ、ⅣmtDNA和nDNA共同编码,而mtDNA自身特殊性(见上),易于受到ROS攻击,从而在蛋白编码中容易出现缺失、错位等现象发生,损伤后可引起呼吸链有关蛋白质亚单位的合成障碍,形成有缺陷的呼吸链,正常的线粒体数量减少,ATP合成下降,细胞所需的能量不足引起酶活性降低。对于复合物Ⅱ而言,其蛋白编码完全由nDNA来完成,避免了在蛋白编码阶段遭受的损伤,所以其水平变化不明显。
而氧间歇训练组大鼠,其ROS水平显著性下降(P<0.05),尽管与对照组相比还显著性升高(P<0.05)。其电子传递链复合物酶活性均有不同程度提高,其中以其复合物Ⅰ变化最为明显(P<0.01);Ⅲ变化次之(P<0.05),Ⅱ、Ⅳ基本没变化(P>0.05)。这可能与AIT有效降低组织内ROS水平相关。然而,复合物I的7个亚单位和复合物Ⅳ的3个亚单位由mtDNA编码,前者酶活极显著性降低,而后者则无明显变化,从理论上讲,后者应该存在部分mtDNA损伤,其活性会存在一定程度降低,而结果是虽然其活性有相当降低,但无显著性差异。这可能与其3个亚单位较少受到ROS攻击,仍能提供合成正常复合物的肽段有关。
4总 结
间歇训练使线粒体呼吸功能得到改善,呼吸率RCR提高。其内在保护机制可能是间歇训练模拟缺血后适应,减少缺血心肌线粒体ROS水平,提高电子传递链复合物Ⅰ、Ⅲ酶活性,减小其对心肌线粒体损伤作用,维持线粒体膜的完整,提高呼吸功能,从而保护心肌。
[1]Tjonna A E,Lee S J,Rognmo O,et al.Aerobic interval training versus continuous moderate exercise as atreatment forthe metabolic syndrome:a pilotstudy[J].Circulation,2008,118(4):346-354.
[2]PuhanMA,BuschingG,SchunemannHJ,etal.Intervalversuscontinuous high-intensity exercise in chronic obstructive pulmonary disease:a randomizedtrial[J].Ann Intern Med,2006,145(11):816-825.
[3]Warburton D E,Mckenzie D C,Haykowsky MJ,et al.Effectiveness of high-intensity interval training for the rehabilitation of patients with coronaryarterydisease[J].Am J Cardiol,2005,95(9):1 080-1 084.
[4]Wisloff U,Stoylen A,Loennechen J P,et al.Superior cardiovascular effect of aerobic interval training versus moderate continuous training in heart failure patients:a randomized study[J].Circulation,2007,115(24):3 086-3 094.
[5]Beckers P J,Denollet J,Possemiers N M,et al.Combined enduranceresistance training vs.endurance training in patients with chronic heart failure:aprospective randomizedstudy[J].Eur Heart J,2008,29(15):1 858-1 866.
[6]Yang S,Tan T M,Wee A,et al.Mitochondrial respiratory function and antioxidant capacity in normal and cirrhotic livers following partial hepatectomy[J].Cell Mol Life Sci,2004,61(2):220-229.
[7]Tretter L,Sipos I,Adam-Vizi V.Initiation of Neuronal Damage by Complex I Deficiency and Oxidative Stress in Parkinson's Disease[J].Neurochemical Research,2004,29(3):569-577.
[8]Trounce I A,Kim Y L,Jun A S,et al.Assessment of mitochondrial oxidative phosphorylation in patient muscle biopsies,lymphoblasts,and transmitochondrialcelllines[J].Methods Enzymol,1996,264:484-509.
[9]Royall J A,Ischiropoulos H.Evaluation of 2',7'-dichlorofluorescin and dihydrorhodamine 123 as fluorescent probes for intracellular H2O2in cultured endothelial cells[J].Arch Biochem Biophys,1993,302(2):348-355.
[10]李红艳,田振军.运动性心肌肥大的生物学机制研究(综述)[J].西安体育学院学报,2004,(5):53-55.
[11]田振军,姜芹先,张志琪.运动性心肌肥大的细胞信号转导与基因表达[J].天津体育学院学报,2005,(1):54-58.
[12]李志梁,钱学贤,章同华,等.心肌急性梗塞后心室重构早期心肌线粒体呼吸功能和电子传递组分的改变 [J].中国应用生理学杂志,1995,(4):333-336.
[13]张崇健,谭宁,何鹏程,等.缺血后适应心肌线粒体能量代谢研究[J].岭南心血管病杂志,2008,(4):288-291.
[14]李洁,汪浩.不同强度急性疲劳运动对大鼠心肌线粒体电子传递链酶复合体活性的影响[J].中国运动医学杂志,2007,(3):304-307.
[15]Turrens J F.Mitochondrial formation of reactive oxygen species[J]. J Physiol,2003,552(Pt2):335-344.
[16]Perl A,Nagy G,Gergely P,et al.Apoptosis and mitochondrial dysfunction in lymphocytes of patients with systemic lupus erythematosus[J].Methods Mol Med,2004,102:87-114.
Influence of Aerobic Training on Mitochondrial Respiratory Function of Myocardial Infarction Rats
MA Xiaoning
(Dept.of PE,Nanyang Institute of Technology,Nanyang 473003,China)
Objective:To observe the myocardial mitochondrial respiratory function and the electron transport chain complex activity of myocardial infarction rats after 8 weeks of aerobic interval training,and explore the interval training on myocardial energy metabolism and mitochondrial respiratory function in rats.Methods:40 adult male SD rats(6 weeks),after the model randomly divided into 3 groups:sham MI group;myocardial infarction group;interval training group,10 rats in each group.Myocardial infarct size,hemodynamics,mitochondrial respiration,ROS,P/O and mitochondrial respiratory chain complex activity were observed.Results:After training,infarct size reduced by 12%;body weight,heart weight and blood pressure had no significant change compared with the quiet;quieter group were significantly improved compared with the MI group,although hemodynamic changes were negative;Mitochondrial RCR at a higher level;ROS significantly lower than the MI group;complexⅠwas significant increased compared with the MI group;activity of complexⅢsignificantly increased;complexⅡandⅣhad no significant change in activity.Conclusion:The interval training can effectively maintain the mitochondrial membrane structure;complex changes in activity may relate to the reduced ROS.
myocardial infarction;interval training;respiratory function;reactive oxygen species;complex activity
G 804.4
A
1005-0000(2010)06-0529-04
2010-08-23;
2010-10-26;录用日期:2010-10-28
马晓宁(1977-),男,河南南阳人,讲师,研究方向为运动与心血管研究。
南阳理工学院体育教学部,河南南阳473003。
