体外侵袭和化疗干预富集PANC1中CD24+CD44+细胞群的初步研究
2009-11-27沈俊王敏刘文松秦仁义
沈俊 王敏 刘文松 秦仁义
体外侵袭和化疗干预富集PANC1中CD24+CD44+细胞群的初步研究
沈俊 王敏 刘文松 秦仁义
肿瘤由异质性的肿瘤细胞组成,其中包含一个在肿瘤发生、发展、侵袭转移和耐药中起关键作用的亚群——肿瘤干细胞[1]。近年根据肿瘤干细胞理论分选到了胰腺癌干细胞(CD24+CD44+ESA+)[2],而且从胰腺癌细胞系PANC1中分离的CD24+CD44+细胞具有高致瘤性[3]。本实验探讨从胰腺癌细胞系PANC1中富集CD24+CD44+细胞的方法,为进一步研究这种细胞的生物学特性提供足量的细胞。
一、材料与方法
1.胰腺癌细胞株PANC1及分组:胰腺癌细胞株PANC1及NIH3T3 细胞株由武汉同济医院胆胰外科实验室提供。常规培养,每48 h胰酶消化传代1 次。PANC1细胞分为4组:对照组、高侵袭性细胞(PANC1-H)组、低侵袭性细胞(PANC1-L)组和吉西他滨耐药组。对照组为常规培养24 h的PANC1细胞。取对数生长期的NIH3T3细胞制备趋化因子。
2.PANC1-H和PANC1-L细胞的获取:采用Transwell小室方法筛选。Transwell小室购自美国Coster公司。RPMI-1640稀释人工基质Matrigel胶(美国Sigma公司)到1 mg/ml,均匀涂布于滤膜上,加入少量无血清的培养基水化,采用紫外线照射杀菌。Transwell小室的下室加入适量含20%胎牛血清的RPMI-1640培养液以及500 μl趋化因子,上室中加入1 ml无血清RPMI-1640悬浮的对数生长期PANC1细胞(500~1000个),常规培养6、12 h后用0.25%胰酶将穿膜细胞消化下来[3],为高侵袭性细胞(PANC1-H),上室中为低侵袭性细胞(PANC1-L)。
3.吉西他滨耐药细胞的获取:PANC1细胞中分别加入含盐酸吉西他滨(美国礼来公司)浓度为10 nmol/ml、100 nmol/ml的RPMI-1640培养液培养24 h,获取的细胞为吉西他滨耐药性细胞。
4.CD24+CD44+细胞分析:取上述各组细胞,PBS洗2遍后用PBS重悬,调整细胞浓度为(0.5~1)×106/ml。取20 μl细胞悬浮液,分别加入抗体CD24-PE、CD44-APC 37℃孵育30 min,PBS洗2遍后用300 μl PBS重悬,流式细胞仪检测。采用PBS代替一抗作为对照。实验重复3次。
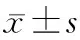
二、结果
PANC1-H 6、12 h组、PANC1-L 6、12 h组、吉西他滨10 nmol/ml、100 nmol/ml组和对照组中CD24+CD44+细胞的比例分别为 (26.1±0.3)%、(17.4±0.4)%、(26.4±0.4)%、(23.7±0.9)%、(50.3±0.4)%、(69.9±0.5)%和(31.7±0.3)%(图1)。PANC1-H与PANC1-L组中CD24+CD44+细胞的比例无显著差异,随着培养时间延长也没有发生显著变化(P值均gt;0.05);相反,吉西他滨10 nmol/ml、100 nmol/m处理可使CD24+CD44+细胞比例从31.4%~32.0%提高到69.4%~70.4%(图2),与对照组相比具有统计学意义(Plt;0.05)。
讨论目前得到的肿瘤干细胞主要是通过表面分子表型来确定的。在肿瘤干细胞分选过程中用胰酶消化肿瘤细胞成单细胞,可能会对细胞表面分子标志的状态及细胞内的基因表达调控产生一定程度的干扰,而且会对肿瘤干细胞造成极大损伤,不适合于对其更深入研究。胰腺癌细胞系PANC1的研究相对于原代细胞来说[4],虽然在分选过程中也会受到影响不能确保其原有生物学特性,但容易获得,而且无正常组织细胞干扰。近年发现,PANC1中的CD24+CD44+细胞有高致瘤性,是胰腺癌干细胞的候选细胞之一。肿瘤干细胞具有高侵袭能力和抗化学药物的能力[5]。为寻找富集CD24+CD44+细胞的方法,本研究采用了侵袭模型和化疗抵抗两种方法,并进行比较。

图1PANC1-H 6(A)、12 h组(B)、PANC1-L 6(C)、12 h组(D)和对照组(E)流式细胞检测CD24+CD44+细胞含量

图2对照组(A)、吉西他滨10 nmol/ml组(B)和100 nmol/ml组(C)流式细胞检测CD24+CD44+细胞含量
Transwell小室体外侵袭模型通过模拟体内侵袭能力较强的肿瘤细胞能够脱离原位肿瘤细胞群体,分泌基质蛋白溶解酶降解细胞外基质(ECM)成分——Matrigel胶,在某特异器官或组织(NIH3T3无血清培养上清)的趋化下发生侵袭过程。肿瘤细胞可通过Matrigel层,非转移性肿瘤细胞、成纤维细胞、表皮细胞不能通过[6]。应用该法可鉴定细胞的侵袭能力。本实验通过Transwell小室筛选出高侵袭性的PANC1胰腺癌细胞,但CD24+CD44+细胞仅占26%左右,且与低侵袭性的PANC1胰腺癌细胞及原代PANC1细胞中的CD24+CD44+细胞比例无显著差异,提示Transwell小室肿瘤侵袭模型不适合用来富集大量的CD24+CD44+细胞。这可能因为肿瘤细胞体内侵袭过程至少包括运动因子、黏附分子、趋化因子、胞外基质降解酶和血管形成因子5类因子参与穿越肿瘤血管内皮和基底膜进入循环[7],而Transwell小室体外侵袭模型只能通过降解Matrige胶模拟胞外基质降解酶和趋化因子的趋化作用,不能完全代替肿瘤细胞在体内环境下的侵袭过程,达不到富集CD24+CD44+细胞的目的。
本实验又采用化疗药物盐酸吉西他滨作用于PANC1胰腺癌细胞系,检测耐药癌细胞中CD24+CD44+细胞的含量,结果显示,CD24+CD44+细胞比例提高到50%以上,且随着盐酸吉西他滨浓度升高,CD24+CD44+细胞比例也有所提高,提示盐酸吉西他滨化疗干预是一种筛选富集胰腺癌细胞系PANC1中CD24+CD44+细胞较好方法。
[1] Reya T,Morrison SJ,Clarke MF,et al.Stem cells,cancer,and cancer stem cells.Nature,2001,414:105-111.
[2] Li C,Heidt DG,Dalerba P,et al.Identification of pancreatic cancer stem cells.Cancer Res,2007,67:1030-1037.
[3] 谭晓洁,侯建国,贺松琴,等.采用体外侵袭实验分离侵袭性人原代肾细胞癌细胞.第二军医大学学报,2006,3:318-321.
[4] 李锦军,顾健人.癌干细胞研究进展.生命科学,2006,18:333-339.
[5] Huang P,Wang CY,Gou SM,et al.Isolation and biological analysis of tumor stem cells from pancreatic adenocarcinoma.World J Gastroenterol,2008,14:3903-3907.
[6] Terranova VP,Hujanen ES,Loeb DM,et al.Use of a reconstituted basement membrane to measure cell invasiveness and select for highly invasive tumor cells.Proc Natl Acad Sci USA,1986,83:465-469.
[7] Kohn EC,Liotta LA.Molecular insights into cancer invasion:strategies for prevention and intervention.Cancer Res,1995,55:1856-1862.
2008-12-10)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2009.05.021
国家自然科学基金(30471693)
430030 武汉,华中科技大学同济医学院附属同济医院外科
秦仁义,Email:ryqin@ tjh.tjmu.edu.cn
