重组肠三叶因子对急性坏死性胰腺炎大鼠肠黏膜保护作用的研究
2009-11-27施琳琳孟立娜叶咸德赵承满包海标
施琳琳 孟立娜 叶咸德 赵承满 包海标
·论著·
重组肠三叶因子对急性坏死性胰腺炎大鼠肠黏膜保护作用的研究
施琳琳 孟立娜 叶咸德 赵承满 包海标
目的探讨重组肠三叶因子(rITF)对急性坏死性胰腺炎(ANP)大鼠肠黏膜的保护作用及其机制。方法SD雄性大鼠60只,按随机数字表法分为对照组、ANP组、rITF组,每组20只。逆行胰胆管注射5%牛黄胆酸钠100 μl/100 g体重制备ANP模型。rITF组制模前后尾静脉注射rITF 0.5 mg/100 g体重,对照组及ANP组注射等量生理盐水,术后12、24 h分批处死大鼠。取血检测淀粉酶含量,取末端回肠组织观察病理学改变并予评分、免疫组化法检测肠黏膜NF-κB活性,RT-PCR法检测肠黏膜TNF-α mRNA、ICAM-1 mRNA的表达。结果ANP组和rITF组血淀粉酶水平较同时点对照组均显著升高。ANP组肠黏膜损伤评分较同时点对照组高(Plt;0.05);ANP 12 h组较rITF 12 h 组高(Plt;0.05),但24 h组间评分无明显差异。对照组、ANP组与rITF组12 h肠黏膜NF-κB阳性细胞数分别为(26±4)个、(55±8)个、(49±4)个;回肠组织TNF-α mRNA相对表达量分别为0.050±0.005、1.040±0.031和0.792±0.0256;回肠组织ICAM-1 mRNA相对表达量分别为0.045±0.010、0.795±0.037和0.400±0.031。ANP组上述各项指标值均较对照组显著增加(Plt;0.05或Plt;0.01),而rITF组又较ANP组均显著减少(Plt;0.05)。结论重组肠三叶因子对ANP大鼠肠黏膜具有保护作用,其机制可能通过抑制肠黏膜NF-κB活化,下调TNF-α mRNA、ICAM-1 mRNA表达。
胰腺炎,急性坏死性; 肠黏膜; 核因子-κB; 肠三叶因子
全身炎症反应综合征(SIRS)及多器官功能衰竭(MOF)是重症急性胰腺炎(SAP)患者病死的主要原因。肠道黏膜屏障受损可引发肠道细菌易位,继发内毒素血症,造成二次打击,最终导致SIRS及MOF的发生[1]。因此,防治肠黏膜屏障功能障碍是治疗SAP的中心环节之一。肠三叶因子(intestinal trefoil factor,ITF)是近年来发现的一种对消化道黏膜具有保护作用的因子[2]。研究证实,SAP时肠黏膜屏障功能受损与NF-κB的活性密切相关。为此,本实验观察重组ITF(reorganized intestinal trefoil factor,rITF)对急性坏死性胰腺炎(ANP)大鼠肠黏膜屏障的保护作用,并探讨其可能机制。
材料和方法
一、实验动物及分组
60只12周龄雄性Sprague-Dawley大鼠,体重(300±40)g,购自中国科学院上海实验动物中心。按随机数字表法分为对照组、ANP组和rITF组,各20只。后两组参考Aho法[3],胆胰管逆行注射5%牛黄胆酸钠溶液100 μl/100 g体重制备ANP模型。对照组仅剖腹,翻动胰腺。对照组及ANP组手术前后尾静脉注射生理盐水0.5 ml/100 g体重;rITF组注射rITF 5 mg/100 g体重(由北京大学蛋白质工程及植物基因工程国家重点实验室提供)。术后12、24 h分批处死大鼠,取血检测淀粉酶含量(自动生化分析仪测定),取距回盲部10 cm左右的回肠组织备用。
二、肠道黏膜组织病理检查
剪取末端回肠2 cm,常规固定、脱水、石蜡包埋、切片、HE染色,参照Chiu等[4]方法将小肠黏膜损伤分为6级进行评分。0分:肠黏膜绒毛正常;1分:绒毛顶端上皮下出现囊状间隙,并伴有毛细血管充血;2分:上皮下间隙扩大,中度固有层水肿,中央乳糜管扩张;3分:固有层明显水肿,肠黏膜上皮层细胞变性、坏死,少数绒毛顶端脱落;4分:上皮细胞层变性、坏死、脱落,部分绒毛脱落,固有层裸露,毛细血管扩张、充血;5分:绒毛脱落,固有层崩解,出血或溃疡形成。
三、肠黏膜NF-κB活性检测
采用快捷免疫组化MaxVisionTM法,根据MaxvisionTM试剂盒(福州迈新公司)说明书操作。兔抗鼠NF-κB p65亚单位一抗(Santa Cruz公司)1∶50稀释。肠黏膜细胞的胞核、胞质棕褐色着色为阳性细胞,单纯胞质棕褐色着色为阴性。高倍镜下计数5个回肠横断面的阳性细胞数,取均数。
四、回肠组织TNF-α mRNA、ICAM-1 mRNA检测
用Trizol试剂(Invitogen 公司)抽提回肠组织总RNA,采用RT-PCR法检测TNF-α mRNA、ICAM-1mRNA。先用M-MLV逆转录试剂盒(Promega公司)逆转录合成cDNA,再以PCR扩增试剂盒(上海生物有限公司)进行扩增。TNF-α上游引物5′-CCACGTCGTAGCAAACCAC-3′,下游引物5′-TGGGTGAGGAGCACGTAGT-3′,扩增片段189 bp;ICAM-1上游引物5′-GATGCTGACCCTGGAGAGCA-3′,下游引物5′-CAGGGACTTCCCATCCACCT-3′,扩增片段409 bp;内参β-actin上游引物5′-TGGAAT-CCTGTGGCATCCATGAAAC-3′,下游引物5′-TAA-AACGCAGCTCAGTAACAGTCCG-3′,扩增产物349 bp。PCR反应条件:94℃ 30 s,55℃(TNF-α)或60℃(ICAM-1)或58℃(β-actin)30 s,72℃ 30 s,32个循环。扩增产物电泳分离后,利用GeneGenius凝胶成像分析系统进行扫描分析。以目的产物条带和β-actin条带的光吸收值比值表示其相对表达水平。
五、统计学分析

结 果
一、大鼠生存率
对照组大鼠全部存活;rITF 12 h组和ANP 12 h组各死亡1只;rITF 24 h组和ANP 24 h组各死亡2只。同一时间点不同组别大鼠和不同时间点的同一组别大鼠死亡率差异均无统计学意义。
二、大鼠血清淀粉酶变化
术后12 h,对照组、ANP组和rITF组血清淀粉酶分别为(723±135)U/L、(1905±286)U/L和(2836±521)U/L;24 h为(616±37)U/L、(2073±1092)U/L和(1562±755)U/L。ANP组和rITF组淀粉酶水平较同时点对照组均显著升高(Plt;0.01),而同时点rITF组与ANP组间无明显差异。
三、回肠组织病理改变
对照组小肠无水肿及肠腔胀气,镜下见肠上皮绒毛完整,上皮细胞下无间隙,间质仅少量淋巴细胞浸润;ANP组小肠肠壁水肿,肠腔胀气呈管状,肠周围可见皂化斑,部分大鼠出现腹水,镜下见肠道绒毛上皮细胞脱落、坏死,上皮下间隙扩大,淋巴管扩张明显,伴有毛细血管充血,并可见较多中性粒细胞、淋巴细胞浸润;rITF组肠壁水肿不明显,少见肠腔胀气及皂化斑,镜下见肠道绒毛上皮细胞坏死较少,毛细血管少量充血明显,淋巴管扩张不明显,少量淋巴细胞浸润(图1左)。ANP组肠黏膜损伤评分较同时点对照组高(t=114.5、t=113.5,Plt;0.05,表1);ANP 12 h组较rITF 12 h 组高(t=108.5,Plt;0.05),24 h组间评分无明显差异。
四、回肠黏膜NF-κB活性
术后12 h,对照组、ANP组和rITF组NF-κB阳性细胞数分别为(26±4)个、(55±8)个、(49±4)个;24 h分别为(37±9)个、(66±4)个、(40±9)个(图1右)。ANP组较对照组明显增加(Plt;0.01),rITF组较ANP组明显下降(Plt;0.05)。
五、回肠组织TNF-α mRNA、ICAM-1 mRNA表达及其与NF-κB相关性
术后12 h,对照组、ANP组和rITF组回肠组织TNF-α mRNA相对表达量分别为0.050±0.005、1.040±0.031和0.792±0.0256;24 h为0.049±0.007、1.73±0.132和0.918±0.0425(图2)。术后12 h回肠组织ICAM-1 mRNA相对表达量分别为0.045±0.010、0.795±0.037和0.400±0.031;24 h为0.060±0.005、1.156±0.095和0.590±0.067(图3)。ANP组TNF-α mRNA和ICAM-1 mRNA表达均较对照组明显增加(Plt;0.05),而rITF组又较ANP组明显降低(Plt;0.05)。回肠组织TNF-α mRNA和ICAM-1 mRNA表达均与NF-κB活性呈正相关(r=0.919,r=0.917,Plt;0.01)。

图1(左) 对照组(A)、ANP组(B)、rITF组(C)12 h大鼠小肠黏膜病理学改变(HE ×200);(右)对照组(A)、ANP组(B)、rITF组(C)12 h大鼠小肠黏膜NF-κB活化(免疫组化 ×40)

表1 各组大鼠肠黏膜损伤评分
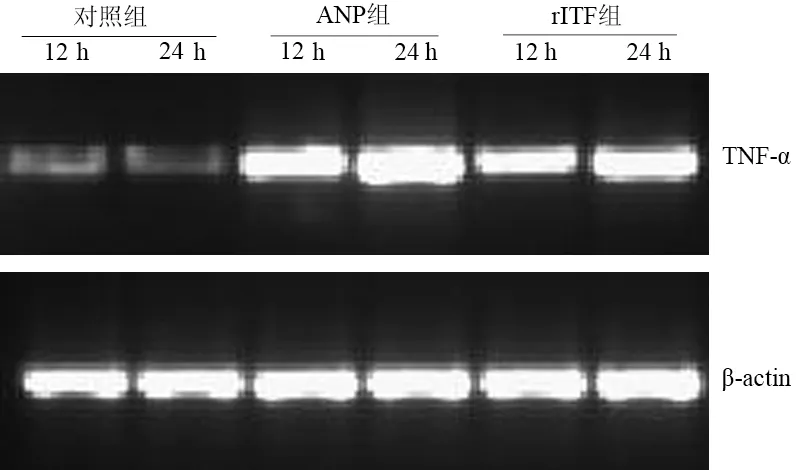
图2 各组大鼠肠黏膜TNF-α mRNA表达
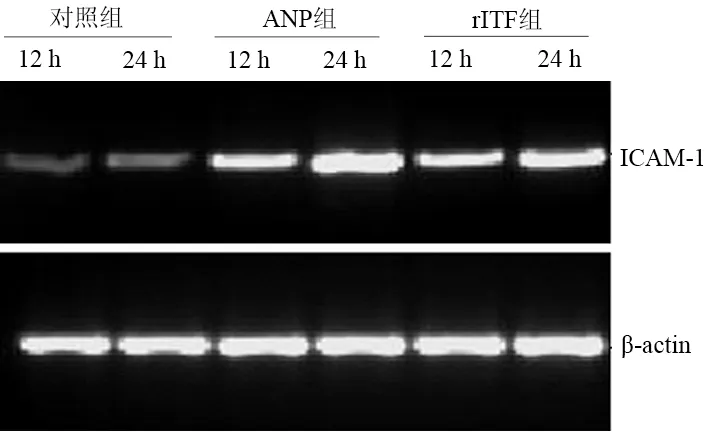
图3 各组大鼠肠黏膜ICAM-1 mRNA表达
讨 论
SAP时,肠道组织不仅是被损伤的靶器官,更是应激状态下机体内环境稳定和全身炎症反应的重要调节者。正常情况下,NF-κB处于抑制状态,当机体受到炎症因子(TNF-α、IL-1β等)、氧自由基、蛋白激酶C、病毒或细菌及其代谢产物等刺激时可激活NF-κB,NF-κB的活化又可诱导多种细胞因子(IL-1、IL-6、IL-8、TNF、粒-巨噬细胞集落刺激因子等)、ICAM-1、VCAM-1、白细胞黏附分子-1、趋化因子等表达增加。
TNF-α是NF-κB下游激活的重要细胞因子之一,是SAP并发多脏器损伤的始动因子之一[5]。现已证实,TNF-α可改变肠上皮细胞的形态,使其异常表达相关黏附因子和肌动蛋白从而影响肠屏障通透性。ICAM-1在正常情况下低水平表达,但在SAP患者,血清ICAM-1含量明显升高[6],应用外源性ICAM-1拮抗剂可减轻实验性ANP导致的肺损伤[7]。本实验结果显示,ANP大鼠早期肠黏膜NF-κB即明显活化,同时TNF-α mRNA、ICAM-1 mRNA表达明显上调。
ITF由59个氨基酸残基构成,相对分子质量约为6700,属三叶肽家族。ITF主要在肠道上皮细胞表达,结构稳定,不易被多种消化酶破坏,能抗酸、抗蛋白酶和抗热分解,主要生理功能为保持肠道结构及功能上的完整,对肠道黏膜的保护和修复起重要作用。研究表明[8],ITF具有很强的细胞保护作用,可明显减轻多种损伤因子介导的肠黏膜损害,它不仅具有一般生长因子所具有的促进细胞增殖与移行的能力,还能同黏液糖蛋白结合,稳定肠黏液层。因而ITF 在肠道的自我保护和损伤后修复机制中占重要地位。本实验结果显示,ANP大鼠静脉给予外源性rITF干预后,黏膜损伤明显减轻,肠上皮NF-κB的活化被明显抑制,同时TNF-α mRNA和ICAM-1 mRNA的表达亦较ANP组明显下降(P均lt;0.05),表明rITF的干预除能增加肠道表面黏液保护层和提高上皮细胞迁移外,还可能通过抑制肠上皮NF-κB的活化,下调其介导的炎性介质TNF-α和ICAM-1的过度表达,减轻级联瀑布反应形成,从而起到保护ANP大鼠肠屏障的作用。但rITF 24 h组与ANP 24 h组肠黏膜评分无显著差异,这可能与ITF半衰期较短有关,也可能因黏膜的恢复需要较长的时间有关,需要做进一步研究。
[1] Ammori BJ.Role of the gut in the course of severe acute pancreatitis.Pancreas,2003,26:122-129.
[2] Maslumo H,Wu DC,Podolsky DK,et al.Impaired defense of intestinal mucosa in mice lacking intestinal trefoil factor. Science,1996,274:262-265.
[3] Aho HJ,Koskensalo SM,Nevalainen TJ.Experimentol pancreatitis in the rat.Sodium taurocholate-induced acute haemorrhagic pancreatitis.Scand J Gastroenterol,1980,15:411-416.
[4] Chiu CJ,McArdle AH,Brown R,et al.Intestinal mucosal lesion in lowflow states.I.A morphological,hemodynamic,and metabolic reappraisal.Arch Surg, 1970, 101:478.
[5] Mew P,Philips P,Fahmy R,et al. Pancreatic stellate cells respond to inflammatory cytokines:potential role in chronic pancreatitis. Gut,2002,50:535-541.
[6] Krivoruchko IA,Boǐko VV,Pesotskiǐ ON,et al. The role of immune disorders in formation of local and systemic complications of severe acute pancreatitis. Klin Khir, 2003,9:20-24.
[7] Lundberg AH,Fukatsu K,Gaber L,et al. Blocking pulmonary ICAM-1 expression ameliorates lung injury in established diet-induced pancreatitis.Ann Surg,2001,233:213-220.
[8] Marchbank T, Cox HM, Goodlad RA,et al.Effect of ectopic expression of rat t refoil factor family 3 (intestinal t refoil factor) in the jejunum of transgenic mice. J Biol Chem,2001,276:24088-24096.
2008-11-12)
(本文编辑:屠振兴)
Effectofrecombinantintestinaltrefoilfactoronintestinalmucosaofacutenecrotizingpancreatitisinrats
SHI Lin-lin, MENG Li-na, YE Xian-de, ZHAO Cheng-man, BAO Hai-biao.
Department of Gastroenterology, First Affiliated Hospital, Zhejiang Chinese Medicine University, Hangzhou 310006, China
MENGLi-na,Emailmln6713@163.com
ObjectiveTo investigate the effect of recombinant intestinal trefoil factor (rITF) on the intestinal mucosa of acute necrotizing pancreatitis (ANP) rats and explore the mechanism.Methods60 male SD rats were randomly divided into control group (n=20), ANP group (n=20), rITF group (n=20). ANP was induced by retrograde injection of 5% sodium taurocholate (100 μl/100 g) into biliopancreatic duct. Rats in rITF group were injected with rITF (0.5 mg/100 g) before and after ANP induction. The rats in ANP group and control group
same amount of normal saline. Each group were sacrificed 12 h or 24 h later,respectively. Blood sample was taken to determine the serum level of amylase. Terminal ileum was resected to observe the pathologic changes; immunohistochemistry method was applied to detect the activity of NF-κB; the expression of TNF-α mRNA, ICAM-1 mRNA in intestinal mucosa was measured by RT-PCR.ResultsIntestinal injury score of ANP group was higher than that of control group (Plt;0.05), intestinal injury score of ANP 12 h group was higher than that of rITF 12 h group (Plt;0.05), but there was no significant difference between ANP 24 h group and rITF 24 h group. The number of positive NF-κB cells was 26±4, 55±8, 49±4,respectively; the relatively expression of TNF-α mRNA in terminal ileum was 0.050±0.005, 1.040±0.031 and 0.792±0.0256, respectively; the relatively expression of ICAM-1 mRNA was 0.045±0.010, 0.795±0.037 and 0.400±0.031, respectively, in control group, ANP group and rITF 12 h group. The corresponding values in the ANP group were significantly increased compared with those values in the control group (Plt;0.05 orPlt;0.01).ConclusionsrITF may protect the intestinal mucosa, the mechanism may include inhibit NF-κB activation, down-regulate TNF-α mRNA, ICAM-1 mRNA expression.
Pancreatitis, acute necrotizing; Intestinal mucosa; NF-kappa B; Intestinal trefoil factor
10.3760/cma.j.issn.1674-1935.2009.05.012
浙江省医药卫生科学研究基金项目计划(2006A088)
310006 杭州,浙江中医药大学附属第一医院消化科
孟立娜,Email:mln6713@163.com
